肠上皮11β⁃HSD1特异性敲除小鼠的小肠上皮屏障功能的研究
2021-06-03王梦茜丁国宪
王梦茜,金 燚,夏 凡,俞 静,丁国宪
南京医科大学第一附属医院老年医学科,江苏 南京 210029
内脏肥胖与胰岛素抵抗、2 型糖尿病等代谢综合征密切相关,更是一种“慢性低度炎症性疾病”,是心脑血管疾病的罪魁祸首[1]。临床研究发现,11β⁃羟类固醇脱氢酶(11β⁃hydroxysteroid dehydrogenase,11β⁃HSD1)的升高与内脏肥胖的发生密切相关。作为一种广泛的、高度可调控的酶,11β⁃HSD1是糖皮质激素作用的放大器,在人体内可催化无活性的可的松变成有活性的氢化可的松[2]。11β⁃HSD1 水平的升高导致糖皮质激素活性增加,进而产生内脏肥胖、高血压、血脂紊乱、胰岛素抵抗等[3]。
肠道是人体营养吸收的主要器官[4],同时又是抵御化学物质和病原侵袭的第一细胞屏障和免疫防御组织,因而在营养代谢和免疫反应中均起到重要的调节作用。肥胖不仅导致肠道微生物紊乱,还可通过紧密连接蛋白的破坏使肠道通透性增加,细菌内毒素穿透肠道,引起机体低度炎症[5]。但肠上皮局部的糖皮质激素过多对肠道功能的影响目前并不清楚。因此,本文主要研究肠上皮特异性11β⁃HSD1 敲除小鼠的肠道上皮屏障功能变化,为肠道功能研究提供新的思路。
1 材料和方法
1.1 材料
与南京大学模式动物研究院合作,本研究经实验动物使用及管理委员会审核通过(批准文号:GP⁃TAP002),通过条件性敲除的F1代杂合子与肠道特异性的Lgr5⁃cre 小鼠进行配对繁殖,将获得的Loxp片段11β⁃HSD1基因敲除鼠以及肠道特异性的Lgr5⁃cre 工具鼠配对繁殖,获得肠道上皮特异性的11β⁃HSD1基因敲除的纯合子(11β⁃HSD1-/-)小鼠。
将C57BL/6 小鼠(6 周,雄性)(南京大学模式动物研究所)分为2 组,每组各8 只,一组给予普通饲料(D12450,10%kcal 脂肪,70%kcal 碳水化合物,20%kcal蛋白质,Research Diets公司,美国),一组给予高脂饲料(D12492,60%kcal脂肪,20%kcal碳水化合物,20%kcal蛋白质,Research Diets公司,美国),喂养8 周。C57BL/6 背景高脂饮食喂养的11β⁃HSD1(-/-)小鼠(6 周,雄性)(南京大学模式动物研究所),8只,喂养8周,饲养在SPF级动物房。
1.2 方法
1.2.1 石蜡切片及HE染色
小鼠喂养8 周后颈椎脱臼法处死,各组分别完整取出肠道做成圈状,按照常规方法进行固定、洗涤、脱水、透明、浸蜡、包埋、切片、烘片等步骤制备石蜡切片,4℃冰箱保存。取石蜡切片,二甲苯中脱蜡5 min,新鲜二甲苯再次脱蜡5 min,无水乙醇5 min,90%乙醇2 min,80%乙醇2 min,70%乙醇2 min,蒸馏水2 min,苏木素染液5 min,浸自来水中洗去多余的染色液,约10 min,伊红染液2 min。70%乙醇洗涤2 次后脱水,用中性树胶封片。每组于光学显微镜下随机选取3个HE染色的区域进行观察。
1.2.2 过碘酸希夫(periodic acid⁃Schiff,PAS)糖原染色
取小鼠小肠组织石蜡切片,常规脱水包埋。取出过碘酸溶液,每个样品滴加过碘酸溶液,在湿盒中避光反应10 min 后,去除过碘酸溶液,置于摇床洗涤5 min。滴加Schiff 试剂,放入湿盒中,置于37 ℃烘箱避光染色1 h,去除染色液,置于摇床洗涤5 min。每个样品滴加苏木素染色液,染色30 s,去除染色液,蒸馏水漂洗2次以上,每次3 s,直到浮色洗去。待适当干燥后中性树胶封固。每组于光学显微镜下随机选取3个PAS染色的组织隐窝区域进行观察。
1.2.3 免疫组化
石蜡切片脱水,在组化圈内滴加3%BSA均匀覆盖组织,室温封闭30 min。去除封闭液,在切片上滴加PBS 按一定比例配好的一抗(F4/80,GB11027,1∶2 000;ZO⁃1,GB11195,1∶300,武汉Servicebio公司),切片平放于湿盒内4 ℃孵育过夜。洗涤后滴加与一抗相应种属的二抗(HRP 标记山羊抗兔,GB23303,1∶200,武汉Servicebio 公司)覆盖组织,室温孵育50 min。再次洗涤后滴加新鲜配置的DAB 显色液。苏木素复染3 min 左右,自来水洗后用1%的盐酸酒精分化数秒,自来水冲洗,苏木素分化液分化数秒,自来水冲洗,苏木素返蓝液返蓝,流水冲洗。最后将切片脱水后稍晾干,中性树胶封片。
1.2.4 定量方法
HE 染色选取多个视野拍照后测量绒毛、隐窝长度。PAS染色在光学显微镜下选取多个视野计数阳性染色细胞。免疫组化分析使用阳性着色细胞计数法,在光学显微镜下,随机多个视野下计数阳性着色细胞。
1.3 统计学方法
用GraphPad Prism 9 统计软件进行数据分析,计量数据以均数±标准差()表示,采用t检验进行两组比较。P<0.05为差异有统计学意义。
2 结果
2.1 高脂饮食喂养后小鼠体重变化
为了明确高脂饮食对小鼠的影响,对小鼠进行称重,发现与正常饮食野生型小鼠(WT/NC)比较,高脂饮食野生型小鼠(WT/HFD)体重明显增加,肠上皮11β⁃HSD1特异性敲除小鼠高脂饮食喂养后体重也明显增加(图1)。
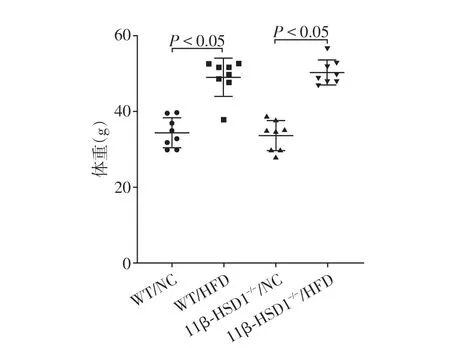
图1 小鼠体重Figure 1 Weight of mice
2.2 高脂饮食导致小鼠小肠上皮绒毛、隐窝、杯状细胞数量变化
为了明确高脂饮食对小肠形态的影响,利用小肠上皮组织HE 染色和小肠杯状细胞PAS 染色,发现与正常饮食组小鼠比较,高脂饮食小鼠小肠绒毛长度明显增加,隐窝深度无明显变化,杯状细胞数量较正常饮食组有增多趋势(图2)。上述结果提示高脂饮食可导致小肠上皮吸收功能增加。
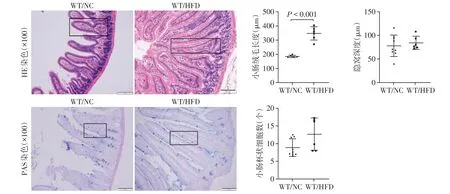
图2 小鼠小肠上皮组织HE&PAS染色及定量Figure 2 HE&PAS staining and quantitative analysis of intestinal epithelium in mice
2.3 高脂饮食导致小鼠小肠上皮ZO⁃1 与F4/80 表达变化
为了进一步研究高脂饮食对小肠上皮屏障功能和炎症的作用,对紧密连接蛋白ZO⁃1和炎症标志物F4/80 进行了免疫组化染色,结果发现与正常饮食组小鼠比较,高脂饮食小鼠小肠上皮ZO⁃1表达明显增加(图3);炎症标志物F4/80表达也增加(图3),说明高脂饮食可导致小肠上皮炎症增加,而紧密连接蛋白可能代偿性增加。

图3 小鼠小肠上皮组织ZO⁃1&F4/80染色及定量Figure 3 ZO⁃1&F4/80 immunohistochemistry staining and quantitative analysis of intestinal epithelium in mice
2.4 肠上皮11β⁃HSD1特异性敲除对小鼠小肠上皮绒毛、隐窝、杯状细胞数量的影响
为了明确小鼠小肠上皮局部的糖皮质激素活性对小肠上皮屏障功能的影响,构建了肠上皮11β⁃HSD1 特异性敲除小鼠(11β⁃HSD1-/-)。结果发现,给予高脂饮食后,虽然肠上皮11β⁃HSD1 特异性敲除小鼠体重依然显著增加,但小肠绒毛长度明显变短,隐窝变浅,杯状细胞数量增加(图4),提示敲除11β⁃HSD1逆转了高脂饮食导致的肠上皮形态变化。

图4 肠上皮11β⁃HSD1特异性敲除小鼠小肠上皮组织HE&PAS染色及定量Figure 4 HE&PAS staining and quantitative analysis of intestinal epithelium in 11β⁃HSD1 specific knockout mice
2.5 肠上皮11β⁃HSD1特异性敲除对小鼠小肠上皮ZO⁃1与F4/80表达的影响
通过对肠上皮11β⁃HSD1特异性敲除小鼠紧密连接蛋白ZO⁃1、炎症标志物F4/80的免疫组化染色,结果发现,与高脂饮食野生型对照组小鼠比较,高脂饮食11β⁃HSD1 敲除组小鼠小肠ZO⁃1 表达降低,F4/80 表达也明显减少(图5),提示11β⁃HSD1 敲除可以减轻高脂饮食导致的肠道炎症。

图5 11β⁃HSD1特异性敲除小鼠小肠ZO⁃1&F4/80免疫组化染色Figure 5 ZO⁃1&F4/80 immunohistochemistry staining and quantitative analysis of intestinal epithelium in 11β⁃HSD1 spe⁃cific knockout mice
3 讨论
肠道不仅是人体最重要的营养吸收器官,而且发挥物理和化学屏障作用,以维持组织稳态[6]。与正常饮食比较,高脂饮食状态下的肠道屏障系统发生明显改变[7]。此外,高脂饮食后杯状细胞中的脂肪酸诱导的未折叠蛋白会抑制黏液的分泌[8]。同时,高脂饮食会改变肠道菌群的分布,增加致病菌的数量[9]。小肠通透性增加,饮食及细菌代谢产物可从肠腔转移至循环及外周组织,进一步导致全身炎症、胰岛素抵抗等。对于肥胖人群的研究也证实,其抗菌肽和黏液分泌减少、紧密连接蛋白表达下降,肠道屏障功能被明显破坏[10]。本研究也发现高脂饮食导致小鼠小肠绒毛长度、杯状细胞数量、紧密连接蛋白ZO⁃1、炎症标志物F4/80明显增加,提示高脂饮食可导致小肠上皮细胞吸收功能增强、炎症增加。
既往研究表明,抑制11β⁃HSD1 可减轻高脂饮食导致的脂肪组织的炎症[11],这为11β⁃HSD1 调控肠道组织的炎症提供了基础。有研究表明,糖皮质激素可引起肠道屏障功能破坏,而用黏液补充剂可增强屏障功能从而防止糖皮质激素所引起的肠道渗漏[12]。糖皮质激素还可以通过糖皮质激素受体依赖的方式诱导跨上皮电阻的时间和剂量依赖性增加,细胞旁阳离子通量减少,从而使得成孔紧密连接表达减少[13]。本课题组之前的研究表明,作为内源性糖皮质激素作用的放大器,全面抑制11β⁃HSD1可改变肠道黏膜形态,增强肠道屏障功能[14]。但肠道组织中11β⁃HSD1的作用仍不清楚。本研究发现,尽管给予高脂饮食喂养,但肠道特异性11β⁃HSD1基因敲除小鼠的小肠绒毛变短、隐窝变浅,杯状细胞数量增加,紧密连接蛋白ZO⁃1、炎症标志物F4/80明显减少,与野生型小鼠给予高脂饮食喂养后的表型相反,提示11β⁃HSD1敲除后可逆转高脂饮食导致的肠道屏障功能变化。高脂饮食导致的小鼠小肠上皮屏障功能变化与11β⁃HSD1的作用密切相关。而肠道特异性11β⁃HSD1是否会影响肠上皮细胞分化及增殖以及是否会对肠道微生物产生有利影响,尚需进一步研究。
