髓源性生长因子促进血管生成能力的实验研究
2021-06-02龚文辉葛圣林
杨 振,文 志,江 石,龚文辉,葛圣林
血管生成不仅存在于生物体的正常生长发育全过程中,更参与了许多病理性疾病的进程以及修复过程。冠状动脉粥样硬化性心脏病是冠状动脉血管发生动脉粥样硬化病变而引起血管腔狭窄或阻塞,造成心肌缺血、低氧或坏死而导致的心脏病。对于部分病人保守治疗效果不佳,又不适宜行血运重建的病人,以及术后部分再狭窄的病人尚无满意的解决办法。因此不少学者设想通过促进血管生成及增加冠脉的侧枝循环来改善心肌的缺血性损伤,常见的促血管内皮细胞生长的因子包括血管内皮生长因子(vascular endothelial growth factor,VEGF)、碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)、肝细胞生长因子(hepatocyte growth factor,HGF)、表皮生长因子(epidermal growth factor,EGF)等。
骨髓源性生长因子(myeloid-derived growth factor,MYDGF)为19号染色体上开放阅读框10编码的一种蛋白,最近研究证实MYDGF不仅能促进内皮细胞生成,也能抑制心肌细胞的凋亡并改善心肌梗死后心肌细胞存活,保护、修复心肌梗死后的心脏。关于MYDGF对促进血管生成能力的研究报导较少,因此,探究MYDGF在血管形成中的作用,对于寻找冠心病有效的临床治疗靶点有重要意义。
1 材料与方法
1.1 材料
1.1.1
种蛋 皖南三黄鸡种蛋购于铜陵天健养殖场;人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVEC)(武汉普诺赛生命科技有限公司)。1.1.2
主要仪器和试剂全自动种蛋孵化器(山东威振孵化设备公司);MYDGF(上海近岸科技有限公司);磷酸盐缓冲液(phosphate buffer saline,PBS)(上海碧云天生物技术有限公司);迷你手钻打孔器(山东美科工具有限公司);定性滤纸(南通邦杰曼滤纸公司);移液枪(美国赛默飞世尔科技公司);Matrigel基质胶(美国Corning公司)。
1.2 方法
1.2.1
MYDGF对鸡胚绒毛尿囊膜(
chickchorioallantoic
membrane,CAM
)
血管新生影响 选择1周之内产出、质量范围在(50±10)g的新鲜皖南三黄鸡种蛋 。用温度为30 ℃左右的1‰新洁尔灭液擦洗消毒,将擦洗后的种蛋晾干后放入温度37.5 ℃,相对湿度60%~70%的孵箱内孵育。将种蛋钝头朝上,使种蛋与蛋托约呈45°~60°夹角,为防止蛋胚黏连,每日早晚各翻转种蛋1次。孵育至满7 d时(满 24 h 为1 d) ,照蛋等检查种蛋孵育存活情况,并用记号表标记出鸡胚气室区域。成活鸡胚可见CAM主要血管,未成活鸡胚见不到CAM主要血管,弃取未成活鸡胚。从中选择成活鸡胚用随机数字表分组法将其分为5组,每组10枚鸡胚,将5组分别命名为对照、PBS、低剂量MYDGF(10 ng/ml)、中剂量MYDGF(100 ng/ml)与高剂量MYDGF(500 ng/ml)组。用酒精棉球对各组鸡胚进行消毒, 用迷你手工钻在所标记出的鸡胚气室区域中央处钻1小孔,用眼科镊以此小孔为中心、向四周范围逐渐轻柔剥取蛋壳,使开窗大小形状约为(1.5×1.5)cm的类圆形。于开窗处滴加3滴无菌0.9%氯化钠溶液,等待约1 min,使鸡胚绒毛尿囊膜充分下陷以减少后续分离所形成的损伤,去除卵壳膜, 适当暴露出鸡胚绒毛尿囊膜。提前选择直径为0.6 cm的手工打孔器,将定性滤纸打孔后进行高压蒸汽灭菌,将灭菌后的直径为0.6 cm的滤纸作为载体置于鸡胚绒毛尿囊膜上,选择尿囊膜血管区域相对较少区域处放置。用移液枪向载体上滴入30 μl药物,用无菌PVDF膜封口,将操作后的鸡胚封口处朝上放入孵育箱继续孵育,每经过12 h揭去鸡胚上的PVDF膜,向载体滤纸滴入相应的30 μl药物,用新的无菌PVDF膜封口后继续孵育。如此孵育2 d后,揭去PVDF膜 ,于载体上滴加2滴无菌生理盐水便于后续分离,最大限度暴露CAM以便观察拍照。向经拍照后的鸡胚内注入甲醇与丙酮1 ∶1的混合固定液5 ml,室温下固定20 min,待CAM上血管完全凝固后用眼科剪完整剪下CAM,将其放置于盛有蒸馏水的平皿中铺展开来,用低倍显微镜观察CAM上的血管生长情况,以载体为中心选择大小形状约(1×1) cm的圆形区域为计数圈,计数CAM上的血管与计数圈边缘的交叉点记为血管数目(vascular number,VN)。将数码相机所拍取的图片(图1A)用Image ProPlus 6.0软件,根据光度与颜色等差异,对图片进行处理(图1B、C)。得出血管区域所占像素点个数记为VAi,得出图片总像素点个数记为CAMi,将两者比值记为VAi/CAMi,以此作为每张图片上CAM的血管区域所占面积与CAM面积之比。由于Image ProPlus 6.0软件是基于图片颜色及明亮程度差异等选取血管区域,所以每次用选取图片中血管所代表区域时会产生细微差别,所以,对每一张图片进行3次测量,取其平均值作为VAi/CAMi的比值。1.2.2
HUVEC的培养 显微镜下观察HUVEC细胞形态呈铺路石样,24~36 h进行细胞换液,待其长至培养瓶单层的80%~90%时传代。弃去旧培养基,无菌PBS溶液洗3遍,1 ml 0.25%胰酶消化液作用约2~3 min。显微镜下观察,细胞变圆时,弃去消化液,用含10%胎牛血清的Ham′s F12培养液终止反应。用移液枪吹匀细胞1 ∶3进行传代,于37 ℃、5%CO培养箱中培养。1.2.3
CCK-8法检测HUVEC增殖作用 取对数生长期HUVEC细胞,调整细胞密度,以2 000个/孔种植于96孔板中,分别设计对照组、MYDGF组(10 ng/ml、100 ng/ml)作用24 h,终止培养前每孔加入10 μl CCK-8试剂,轻微振荡30 s混匀后放入培养箱中继续培养1~4 h。于酶标仪中读取450 nm处吸光度值。结果以5个复孔的均值表示。1.2.4
检测HUVEC的成管能力 4 ℃过夜融化matrigel胶,-20 ℃预冷24孔板和枪头,在冰上以80 μl量的基质胶对24孔板铺板,保证平铺且没有气泡。将铺好的24孔板放入细胞培养箱中培养1 h,待基质胶凝固。取生长状态良好的对数生长期的HUVEC细胞,用浓度为0.25%胰酶消化后离心收集细胞,分别用无血清Ham′s F12培养基和用无血清Ham′s F12培养基所配浓度为100 ng/ml 的MYDGF混合液重悬细胞,重悬后将细胞浓度调至至2×10/ml。将细胞悬液沿孔壁加入铺有基质胶的24孔板中,每孔500 μl。每组设置3个复孔。37 ℃、5%CO饱和湿度条件培养6 h;每隔2 h显微镜下观察,100倍显微镜下拍照统计成管数目,每孔选择3个视野拍照,用Image J软件对分析处理,将3个视野计算所得平均值代表这个孔的相应数值。
2 结果
2.1 MYDGF对CAM血管生长影响
经数码相机摄像后的图片与经IPP 6.0软件处理后的图像中CAM血管对比,看出经IPP 6.0软件处理后的图片中血管显示良好(图1)。对照组、PBS组、低剂量MYDGF组CAM血管未见明显差别,CAM血管发育良好,各级血管呈树叶状分布,但微血管数量不密集;中剂量MYDGF组与高剂量MYDGF组2组CAM血管发育良好,各级血管呈树叶状分布,血管清晰可见,较前面3组相比,可见二级分支血管及微血管数量增密(图2)。
图1 CAM原始图像与处理后图像血管显示对比 ×4A:原始图像;B:经Image Pro Plus中RGB处理后图像;C:经灰度处理后的图像
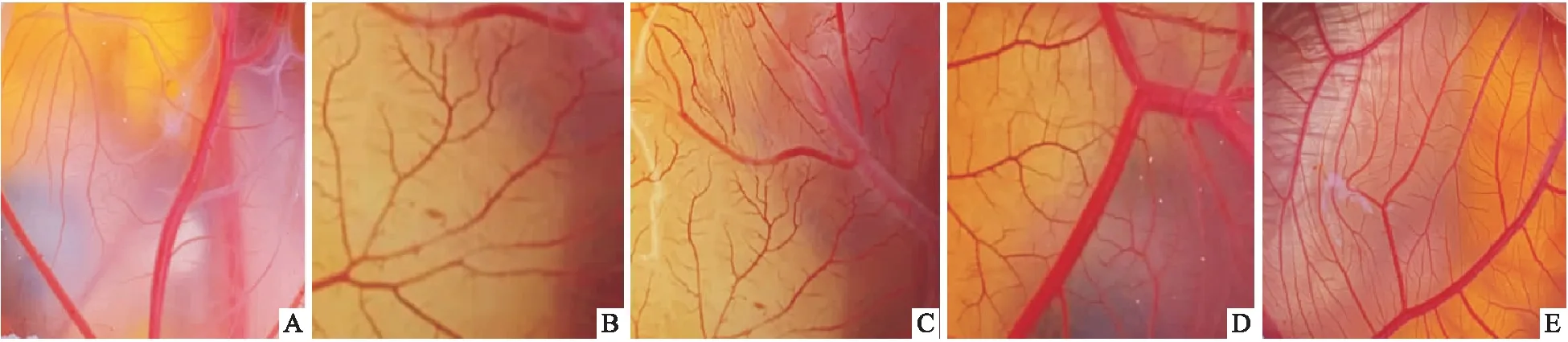
图2 MYDGF对CAM血管生成的影响 ×4 A:对照组;B:PBS组;C:低剂量MYDFG组;D:中剂量MYDGF组;E:高剂量MYDGF组
2.2 CAM新生血管的定量观察指标
与对照组CAM新生血管单位面积的VN、VA/CAM相比,用浓度100 ng/ml的MYDGF作用于CAM新生血管2 d后,CAM新生血管的VN、VA/CAM明显增加,差异有统计学意义(F
=25.815,P
<0.01)。对照组、PBS组、低剂量MYDGF组3组中CAM新生血管条数VN及VA/CAM面积比值结果无明显变化,差异均无统计学意义。用不同浓度MYDGF(浓度分别为10 ng/ml,100 ng/ml,500 ng/ml)作用于CAM新生血管2 d后,VN及VA/CAM面积比值变化显示MYDGF对CAM新生血管呈现浓度依赖性(F
=16.856,P
<0.01)。见表1。
表1 各组VN与VA/CAM结果比较
2.3 MYDGF对HUVEC增殖功能的影响
与对照组比较,中剂量MYDGF组OD值增加,差异有统计学意义(F
=25.51,P
<0.05),与对照组比较,低剂量MYDGF组OD值无明显变化。见图3。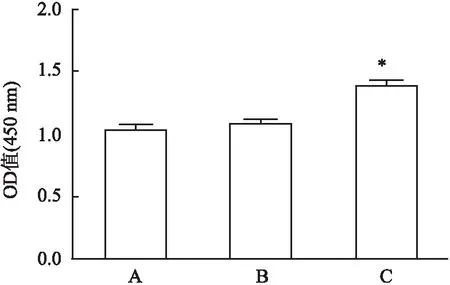
图3 MYDGF对HUVEC增殖的影响
2.4 MYDGF对HUVEC成管功能的影响
中剂量MYDGF组与对照组HUVEC成管图像见图4。与对照组成管的主干长度总计比较,低剂量MYDGF组组作用的HUVEC,其成管的主干长度总计明显升高,差异有统计学意义(F
=231.65,P
<0.01)。与对照组成管的网格数比较,中剂量MYDGF组作用的HUVEC,其成管网格数目明显升高,差异有统计学意义(F
=268.13,P
<0.01)。见图5、6。3 讨论
冠心病主要由于动脉粥样硬化,造成动脉血管堵塞、狭窄或者痉挛从而导致心肌低血低氧发生一系列病变的疾病。冠心病是致残率及病死率极高的疾病,严重威胁着人类的健康与生命。数据显示,中国心血管病患病率及病死率仍处于上升阶段,中国心血管病患者已达2.9亿例,其中冠心病患者约有1 100万;心血管病病死率高居首位,占居民疾病死亡构成组成比40%以上,肿瘤及其他疾病,占居民疾病死亡构成的40%以上,其中45岁以下人群发病率呈逐年上升趋势。因此,研究这一重大疾病的防治策略具有重大意义。应用药物扩张冠状动脉,使狭窄的心肌血管再生及建立有效的侧枝循环,改善心肌缺血低氧目前已成为是药物治疗冠心病研究中的热点之一。既往有研究表明,MYDGF能通过Akt及PI3K信号通路抑制小鼠心肌细胞凋亡,不止减少了小鼠心肌梗死区域的面积,还改善了小鼠的心室重构及心脏收缩功能。有多种组织和器官可以合成MYDGF,在急性心肌梗死患者的血浆及心肌梗死区域,MYDGF表达上调被认为是心肌损伤的适应保护机制。MYDGF还可通过STAT3、MAPK1/3信号通路和细胞周期蛋白D1的信号通路,以此增强内皮细胞的增殖。还有研究表明MYDGF能促进肝癌细胞增殖、对糖尿病肾病小鼠损失的足细胞有保护作用。该研究以CAM血管为模型,研究表明MYDGF可促进CAM新生血管的生成数目、CAM新生血管面积与CAM面积比值的增加,提示MYDGF能促进CAM新生血管生成能力,并呈现一定的浓度依赖性,而PBS对CAM新生血管的作用无明显影响作用。MYDGF能促进HUVEC细胞OD增加,并增加其成管的主干长度及成管网格数目,提示MYDGF能提高HUVEC的增殖及成管能力。以上实验提示MYDGF可促进血管生成,为MYDGF促进心肌血管狭窄后其侧支循环血管的新生及狭窄部位血管再通的维持治疗提供了新的实验依据。
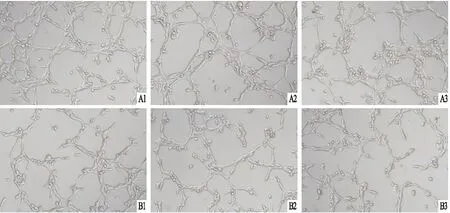
图4 MYDGF对HUVEC成管能力的影响 ×100A:中剂量MYDGF组;B:对照组;1、2、3:随机选取不同位置
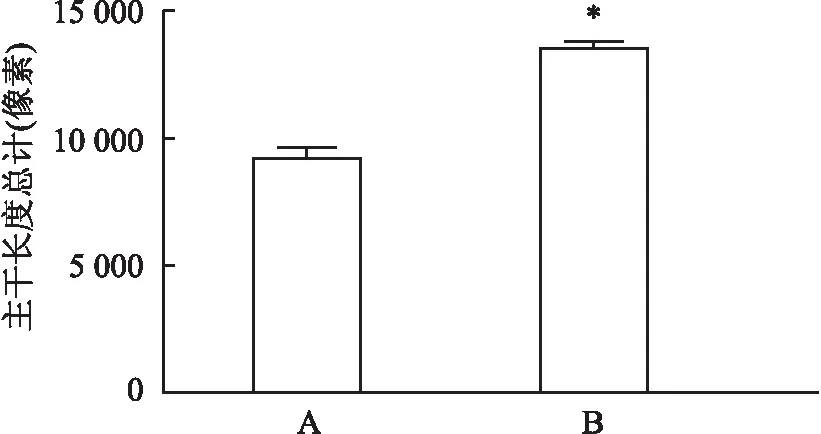
图5 MYDGF对HUVEC成管主干长度总计影响
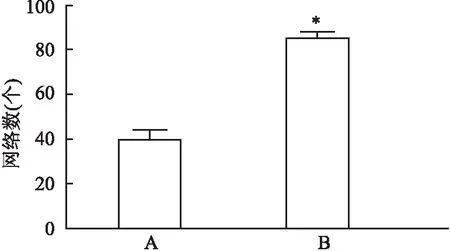
图6 MYDGF对HUVEC成管网格数影响
血管生成常用的研究模型方法有CAM法、人脐静脉血管内皮细胞成管实验法、血管内皮细胞模型法、锯齿动物皮下气囊、锯齿动物虹膜和无血管的角膜等多种研究方法。CAM是鸡胚的一层外膜,鸡胚通过CAM进行气体交换,同时CAM功能的发挥有赖于CAM中血管网的支撑,由于鸡胚发育中大量尿囊膜血管生成,为研究血管生成提供的很好的实验模型。而且鸡胚发育早期,免疫系统尚发育不全,对测试药物不会产生排斥反应,实验结果易得且肉眼直观可见。同时,该模型具有实验材料易得、操作简易、结果直观、周期短等优点。
评价CAM血管常用的方法有人工计数血管数量、计数单位范围内血管条数VN、计算血管平均直径、计算CAM上的血管面积以及计算VA/CAM等。
本研究选择人工计数单位范围内血管条数VN及计算机软件计算VA/CAM比值2种方法,使血管生成定量指标较为客观且更符合肉眼观察的实际情况。但由于CAM血管脆弱,即便小心操作,仍有一小部分CAM血管处破裂。而计算机软件选择CAM血管时,由于摄取图片清晰度软件自身功能影响,也会使处理后图片中CAM血管于原始图片存在少许误差。因此,CAM血管生成定量研究方法有待于进一步完善。
促进血管生成是冠心病治疗方法中的一个新领域,但因各类血管生成因子类制品在促进血管生成的同时,还潜在有着促使肿瘤、糖尿病性视网膜疾病等加速进展的可能。因此,MYDGF促进血管生成的具体作用机制尚有待进一步研究,MYDGF在临床方面的应用及其潜在不良影响尚待进一步发现。对于缺血性疾病,MYDGF可能作用一种新的生长因子或新的潜在治疗点。今后仍需要对MYDGF作用的受体或信号通路分子、MYDGF在心血管疾病中的作用及临床应用等方面进行探索。
