α7烟碱型乙酰胆碱受体在烟碱成瘾不同阶段发挥的作用及其作用机制
2021-06-01田慧娟王红娟侯宏卫胡清源
田慧娟,陈 欢,王红娟,侯宏卫,胡清源
(国家烟草质量监督检验中心,中国河南郑州450001)
烟碱是烟草中备受关注的致瘾性物质,同时也是吸烟者持续使用烟草制品的主要原因之一,但烟碱成瘾的作用机制尚未被完全揭示。烟碱随卷烟烟气吸入肺部,经肺泡血液交换迅速进入动脉循环,透过血脑屏障后与中枢神经元表面的烟碱型乙酰胆碱受体(nicotinic acetylcholine receptors,nAChRs)结合,作用于中脑边缘多巴胺系统,进而产生奖赏效应[1]。在所有 nAChRs中,α4β2nAChRs和α7nAChR的表达丰度最高,分布最广泛,普遍存在于神经元和非神经元细胞中,占大脑中nAChRs的90%以上。
α7nAChR是由5个相同亚基组成的五聚体跨膜寡蛋白[2~4],由502个氨基酸组成,相对分子质量约56 kD,其N-端结构域含有胞外二硫键,可以产生1个半胱氨酸环,形成半胱氨酸环配体门控离子通道[5~6],对钙离子高度敏感,参与调节细胞间信号转导和神经递质释放[7]。作为大脑中最丰富的乙酰胆碱受体,α7nAChR与α4β2nAChRs在分布位置、功能特性(例如激活动力学、脱敏和脱敏恢复)及钙离子渗透性等方面都存在较大区别。首先,α7nAChR的5个亚基系属相同类型,而α4β2*nAChRs则是异源五聚体,并且有可能再与其他亚基相结合(符号“*”表示可能存在其他亚基);其次,α7nAChR在神经系统中大多位于突触前,而α4β2nAChRs则大多是突触后定位[5,8~9];第三,α7nAChR对钙离子具有更强的通透性,钙离子可以引发谷氨酸的释放,而α4β2nAChRs具有更强的钠、钾、氯离子通透性[5];第四,突触前定位的α7nAChR主要通过下列方式发挥作用:烟碱等与乙酰胆碱结构类似的激动剂与受体结合后通过轴突-轴突型突触改变突触前膜的结构,打开钠、钙离子通道,阳离子进入细胞进一步激活电压依赖性钙通道,从而允许更多的钙离子进入,进入神经元细胞的钙离子促进谷氨酸等神经递质的释放,实现突触传递的变化[10~14](图1)。而突触后定位的α4β2nAChRs发挥作用则是由兴奋的中间神经元末梢释放γ-氨基丁酸等神经递质,这些神经递质与突触后膜受体结合,增加其对钾、氯离子的通透性,产生突触后电位,实现超极化现象[5];第五,与α4β2nAChRs相比,α7nAChR的脱敏速度和脱敏恢复速度均较慢[15],因此早期被认为与烟碱的亲和力低,对烟碱致瘾作用的贡献度有限。
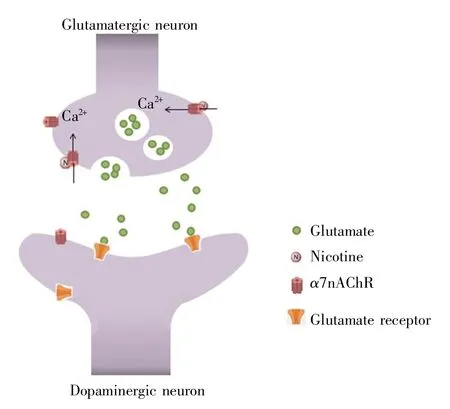
图1 α7nAChR结合烟碱借由钙离子调控谷氨酸释放Fig.1 α7nAChR binds nicotine to regulate glutamate release through calcium ion
相关证据显示,α7nAChR在精神分裂症[16~18]、认知障碍[19]、阿尔茨海默病等神经退行性疾病[20]以及学习记忆[21]等方面发挥着重要作用。α7nAChR在神经系统中的重要性主要体现在两个方面:1)其在外周免疫细胞和负责学习、记忆脑区的神经元中表达,可通过信号转导调节学习、记忆[22]和疼痛反应,并通过抑制炎症来发挥神经保护作用[23~24];2)α7nAChR可调节γ-氨基丁酸、谷氨酸、多巴胺等多种神经递质的释放,在突触前神经递质释放的短期变化以及突触后树突可塑性的信号转导中具有重要意义。近年来,α7nAChR在烟碱成瘾过程中发挥的重要作用逐渐受到关注[7,16,25]。课题组前期成功构建了烟碱条件性位置偏爱(conditioned place preference,CPP)模型,该模型包括烟碱成瘾的获得、消退和重建3个阶段,以模仿吸烟成瘾、戒烟和复吸[26]。通过对比不同阶段大鼠中脑腹侧被盖区的α7nAChR表达量,发现大鼠中脑腹侧被盖区的α7nAChR表达量在CPP成瘾阶段未发生显著变化,但在消退阶段显著下调,提示α7nAChR在烟碱成瘾和戒断过程中可能发挥重要作用(尚未发表)。大量研究显示,调控α7nAChR对实验动物烟碱成瘾模型的构建和戒断均产生重要影响,这里将针对α7nAChR在烟碱成瘾不同阶段所起的作用进行详细综述,并阐述其潜在作用机理。
1 烟碱暴露对α7nAChR表达量的影响
多重证据显示,烟碱暴露将引起各个脑区α7nAChR表达量的变化。相关研究对大鼠进行烟碱皮下暴露(6 mg·kg-1·d-1)14 d后,制备脑冷冻切片,并进行[125I]-银环蛇毒素定量放射自显影,结果显示慢性烟碱暴露导致所有脑区的α7nAChR表达量上调[27~28]。在Slotkin等[29]的研究中,对大鼠进行烟碱皮下暴露(6 mg·kg-1·d-1)15 d后,不同脑区α7nAChR表达量上调程度依次为:纹状体区域>脑干区域>小脑区域。Small等[30]在大鼠烟碱静脉暴露(5 mg·kg-1·d-1)8~10 d的实验中利用放射自显影的手段发现,小鼠脑部海马区域的α7nAChR表达量升高。Pakkanen等[31]在电子显微镜下观察到,通过饮水实施烟碱暴露8周的大鼠(前3周:50 μg/mL;3~7 周:350 μg/mL;7~8 周:500 μg/mL),其腹侧被盖区α7nAChR的免疫标记增加,α7-nAChR表达量增加。另外,含烟碱的卷烟烟气和电子烟气溶胶暴露也可以引发脑区α7nAChR表达量的变化。Small等[30]在卷烟烟气暴露的研究中借助放射自显影发现,卷烟烟气暴露28 d可以增加小鼠海马CA2/3区域和角质层中的α7nAChR表达量。Alasmari等[32]利用蛋白质印迹法发现,吸入电子烟气溶胶6个月后小鼠纹状体中α7nAChR的表达量上调。
此外,停止烟碱暴露也会相应引发α7nAChR表达量的变化。Slotkin等[29]对大鼠进行烟碱皮下暴露(6 mg·kg-1·d-1)7 d后,停止烟碱暴露3 d,放射自显影结果显示α7nAChR水平恢复至正常或略低于正常水平,且直到停止烟碱暴露30 d后都没有进一步变化。在烟碱戒断24 h后,Borkar等[33]利用荧光显微镜发现在小鼠海马神经元上α7nAChR共标记抗体的免疫应答增强,α7nAChR表达量增加。Barik等[34]将大鼠烟碱皮下暴露(4 mg·kg-1·d-1)14 d后,戒断3 d,免疫荧光染色结果显示,与对照组相比α7nAChR表达量短暂性上调;戒断7 d后,α7nAChR表达量回落至与对照组相同的水平,α7nAChR的短暂上调伴随着实验大鼠戒断反应的增强,提示下调α7nAChR的表达量可能有助于烟碱戒断。
上述文献表明,烟碱暴露后实验动物不同脑区的α7nAChR表达量都存在一定程度的上调,烟碱戒断后α7nAChR的表达量又恢复正常水平。这种α7nAChR表达量水平随烟碱暴露情况改变而变化的现象,暗示α7nAChR可能与烟碱暴露密切相关。此外,α7nAChR表达量上调不仅在烟碱单独暴露时发生,在卷烟烟气、电子烟气溶胶等含烟碱的复杂成分暴露中也存在,这意味着α7n-AChR对于烟碱成瘾甚至烟草依赖都可能有着重要意义。
2 α7nAChR参与烟碱成瘾
2.1 调控α7nAChR对烟碱成瘾模型构建的影响
研究发现,在构建烟碱成瘾动物模型的过程中,采用特异性抑制剂或基因敲除等相关手段抑制α7nAChR的功能,对烟碱成瘾模型的构建无明显负面影响。Stolerman等[35]在对野生型和烟碱型乙酰胆碱受体α7亚基基因CHRNA7(α7 neuronal nicotinic acetylcholine receptor gene)敲除小鼠的对比中发现,CHRNA7的缺失并不影响小鼠对烟碱的获取,CHRNA7敲除小鼠同野生型小鼠一样都可以成功构建烟碱自身给药成瘾模型(0.4 mg/kg、0.8 mg/kg)。Walters等[36]使用 5.0 mg/kg、10.0 mg/kg两种不同剂量α7nAChR拮抗剂甲基乌头碱(methyllycaconitine,MLA)对实验小鼠进行皮下注射(subcutaneous,sc)预处理,发现其和CHRNA7敲除小鼠均可成功构建烟碱(0.5 mg/kg,sc)CPP模型。Liu[37]借助MLA的腹腔注射(intraperitoneal,ip)预处理(2.5 mg/kg、10 mg/kg)和烟碱自身给药模型(0.03 mg/kg)证明了下调α7nAChR的功能并不阻碍烟碱自身给药模型的构建。Pons等[9]的实验结果也表明,CHRNA7敲除的大鼠在烟碱自身给药方式(8.7~52.6 μg/kg)下,仍可表现出烟碱急性奖赏效应。Brunzell等[38]通过大鼠静脉注射烟碱自身给药模型(0.03 mg/kg)发现,敲除CHRNA7或施予拮抗剂减弱α7nAChR的功能之后,实验大鼠仍可成功构建烟碱成瘾模型,且相较于对照组提升了烟碱自身给药的动机。
相反,采用特异性激动剂等手段上调α7n-AChR功能,将对烟碱成瘾动物模型的构建产生负面影响。Zhou等[39]发现,烟碱暴露后的大鼠因运动强度(久坐、高强度、中等强度和低强度)不同大脑中α7nAChR和下游信号分子的表达量出现差异,而α7nAChR和下游信号分子的表达量与Go/NoGo准确性和水迷宫(Morris water maze,MWM)测试性能呈正相关,与CPP评分呈负相关。Brunzell等[16,38]向大鼠脑部伏隔核区局部显微注射α7-nAChR激动剂,以揭示其在烟碱成瘾构建中的潜在作用,结果显示在自身给药模型中大鼠单次输注烟碱的能力降低(0.03 mg/kg),上调α7nAChR的功能与烟碱强化和奖赏之间存在反比关系。Jackson等[40~41]在小鼠烟碱CPP模型中使用正变构调节剂(positive allosteric modulator,PAM)(0.5 mg/kg)验证了上调α7nAChR功能可引起烟碱CPP评分显著降低,导致小鼠烟碱CPP模型构建时长增加。总之,多重证据显示,烟碱成瘾模型构建的难度与α7nAChR的表达量呈反比关系,α7nAChR的表达量越高,实验动物自主获取烟碱的能力越弱,烟碱依赖的程度越低。
通过不同调控手段对α7nAChR的功能进行抑制或增强,所得到的研究结论并不一致(表1)。当采用基因敲除或特异性抑制剂下调α7nAChR的功能时,并不影响烟碱成瘾模型的构建,因此有学者认为α7nAChR在烟碱成瘾构建过程中并不是必不可少的,其作用和贡献可以被其他乙酰胆碱受体替代;当使用特异性激动剂上调α7nAChR的功能时,实验动物的烟碱成瘾模型构建受到了阻碍,构建时长明显增加或者难以构建烟碱成瘾模型,因此部分学者认为α7nAChR对烟碱成瘾的构建并非毫无贡献,上调α7nAChR是解决烟碱依赖问题的一种有前景的手段。
2.2 调控α7nAChR对烟碱成瘾戒断和重建的影响
戒断和重建是烟碱成瘾过程中的重要阶段,对于探究烟碱成瘾机制具有重要意义。研究者普遍使用拮抗剂或激动剂调控α7nAChR的表达,发现α7nAChR在烟碱暴露后的戒断和重建过程中同样起着重要作用。
在烟碱戒断过程中,通过下调和上调α7n-AChR的功能发现,α7nAChR与烟碱戒断症状密切相关,α7nAChR的下调可以减弱戒断症状,利于实验动物完成戒断,而α7nAChR的上调可以加重戒断症状。Salas等[42]以 24 mg·kg-1·d-1的剂量实施烟碱皮下暴露,成功构建烟碱成瘾模型后开展烟碱戒断实验,发现无论是CHRNA7敲除小鼠还是α7nAChR特异性拮抗剂MLA预处理(7.5 mg/kg)的小鼠,在停止烟碱暴露后,梳理毛发、抓挠、咀嚼、摇晃、旷场移动距离等戒断反应均明显减少。Jackson 等[43]以 36 mg·kg-1·d-1的剂量实施烟碱暴露14 d后停止暴露,发现CHRNA7敲除小鼠相较于野生型小鼠的戒断反应减少(如摇头、爪子震颤、身体震颤、后退、眼睑下垂、毛发卷起和跳跃等),同时,通过十字迷宫评价的焦虑样行为也有所减轻。此外,相关研究报道,非选择性nAChRs拮抗剂美卡拉明(3.5 mg/kg,ip)可通过抑制所有乙酰胆碱受体功能减弱实验小鼠的戒断症状,而在此基础上再给予α7nAChR的完全激动剂PNU-282987(1 mg/kg、3 mg/kg、9 mg/kg,sc),可通过仅上调α7nAChR的功能逆转这种作用效果,加强戒断症状[41]。
在烟碱成瘾的重建过程中,下调α7nAChR表达量可阻碍烟碱成瘾重建。Liu等[25,37]采用自身给药系统对实验大鼠实施烟碱暴露(0.03 mg/kg),成功构建烟碱自身给药模型后停止给药,完成戒断后,恢复摄入烟碱和自身给药系统中提示信号的联系,发现α7nAChR特异性拮抗剂MLA预处理(10 mg/kg)的大鼠寻求烟碱反应减弱,戒断后重建失败。
综上可知,α7nAChR在烟碱戒断和重建阶段行使了一定的功能,下调α7nAChR的表达可以减弱烟碱戒断阶段的戒断反应,降低重建的可能性;相反,通过α7nAChR激动剂上调α7nAChR的功能,将加重戒断症状,增加重建的可能性(表1)。
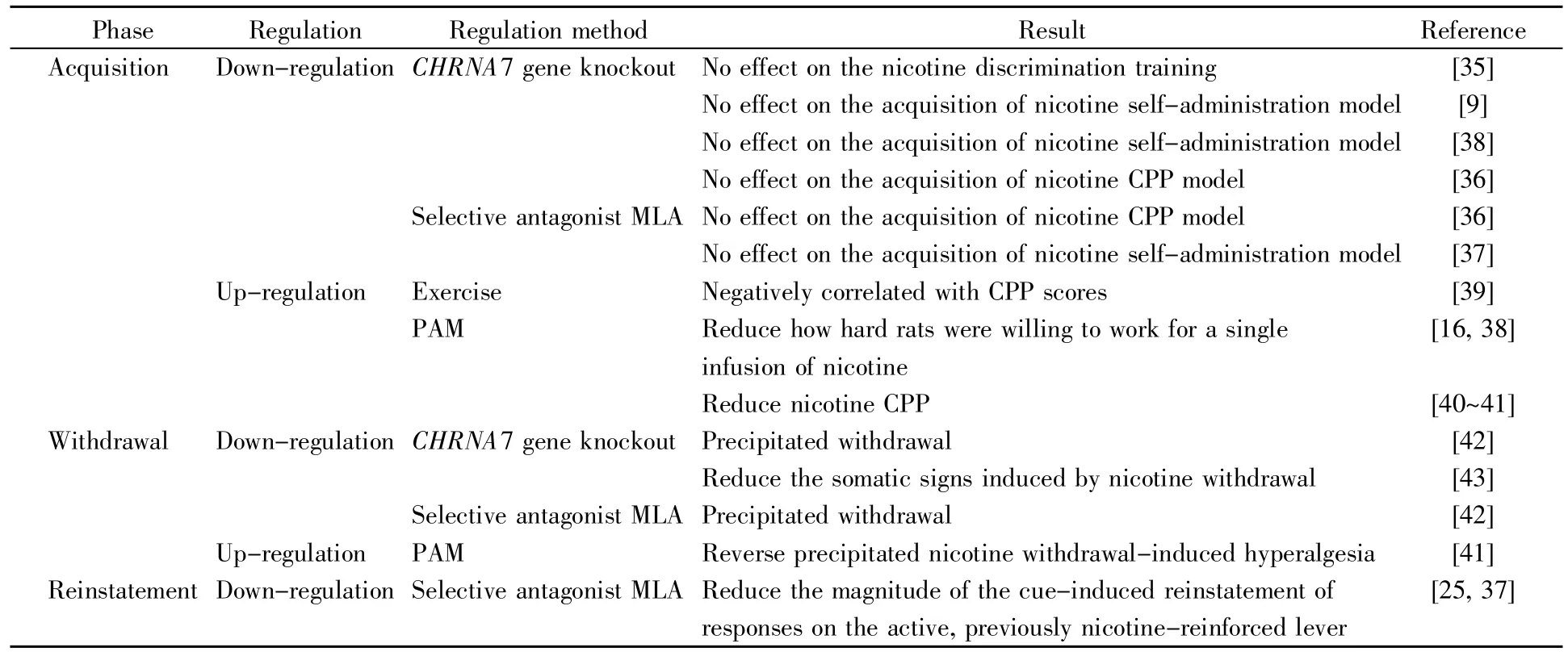
表1 调控α7nAChR对烟碱成瘾形成、戒断和重建的影响Table 1 Effects of regulating α7nAChR on the acquisition,withdrawal and reinstatement of nicotine addiction
2.3 α7nAChR在烟碱暴露中的调控与环境线索有关
环境线索对于药物成瘾尤其是烟碱成瘾有着重要意义,环境线索是烟碱成瘾重要且不可或缺的因素之一,因为吸烟行为相较于其他滥用药物要包含更多的环境线索。近年来,研究者不断认识到环境线索暴露在戒烟后复吸中的重要性,但相关神经生物学机制还知之甚少。通过对α7nAChR的表达量实施调控,目前已证实α7nAChR的功能与烟碱成瘾过程中的环境线索特异性相关。
Liu等[37,44]在构建大鼠烟碱自身给药模型(0.03 mg/kg)的过程中,将烟碱输注与听觉/视觉刺激进行关联,所述听觉/视觉刺激包括5 s声音刺激和20 s活动杠杆上方的光照射,完成关联训练后,对大鼠腹腔施与不同剂量的α7nAChR特异性拮抗剂MLA(2.5 mg/kg、10 mg/kg)以下调 α7n-AChR的表达,结果显示实验大鼠在环境线索诱导下的烟碱觅药行为显著减弱,戒断后重建失败,下调α7nAChR的表达可抑制环境线索诱导的烟碱觅药行为。研究者提出调控α7nAChR的表达量有望成为减少由环境线索诱导复吸的一种手段,且指出同样高表达的α4β2nAChRs并不具备这种特性[25,37,44]。在该项对比研究中,Liu等[37]认为α4-β2nAChRs和α7nAChR在烟碱成瘾中发挥着不同的作用,α4β2nAChRs更多地参与烟碱引起的长时程增强作用,而α7nAChR则更多地调控烟碱线索诱导的条件增强作用。这两种不同亚型的乙酰胆碱受体在烟碱成瘾方面的神经生物学机制是不同且相互独立的,分别是烟碱的增强作用和烟碱线索诱导的增强作用。
3 α7nAChR在烟碱成瘾中的作用机制
3.1 α7nAChR通过谷氨酸调控多巴胺释放
烟碱与乙酰胆碱受体结合介导释放多巴胺是烟碱成瘾的关键环节[45]。大量释放多巴胺是烟碱引起愉悦感的主要原因,并被认为是引发和维持烟碱成瘾的关键机制。研究发现α7nAChR可以影响多巴胺的释放。Waeiss等[46]直接将3 μL烟碱显微注射到大鼠后腹侧被盖区,利用高效液相色谱-电化学检测对微透析结果进行分析,发现烟碱可刺激伏隔核中的多巴胺释放,α7nAChR是后腹侧被盖区中多巴胺能活性的有效调节剂。Neves等[17]研究发现,α7nAChR激动剂PNU120596可增加正常大鼠中腹侧被盖区活跃多巴胺神经元的数量,进而导致多巴胺的释放量显著增加。
大量研究探讨了α7nAChR调控谷氨酸进而影响多巴胺释放的分子机制。谷氨酸是大脑中一种关键的兴奋性神经递质,在药物依赖的发展和维持过程中起着重要作用,如强化、致敏、渴求和复吸[47],谷氨酸能神经元的可塑性变化也介导药物依赖的强化[32,48]。研究表明,烟碱与α7nAChR结合,开启离子通道,钙离子流入[10~13]。进入细胞的钙离子进一步激活电压依赖性钙通道,从而允许更多的钙离子流入,进而引起谷氨酸的释放[34,49~51]。同时,钙离子浓度的增加,也会引发α7nAChR的上调[14],这解释了为何烟碱暴露后大脑中α7nAChR的表达量上调。众多研究表明,烟碱暴露会增加中脑皮质[32]、纹状体[47,52]和腹侧被盖区[53]等区域内谷氨酸的浓度。Ryu等[54]使用实时谷氨酸生物传感器和开放式行为评估,研究大鼠在卷烟烟气冷凝物(cigarette smoke condensate,CSC)重复暴露下背侧纹状体中谷氨酸水平的变化与行为变化的关系,发现将实验大鼠重复暴露于包含0.4 mg烟碱(1.0 mL·kg-1·d-1,sc)的 CSC 中 14 d,大鼠背侧纹状体区域细胞外谷氨酸浓度显著增加。现已有研究证实,长期暴露于烟碱可通过刺激α7nAChR加强烟碱的长时程增强作用,从而导致腹侧被盖区、伏隔核、前额叶皮层和海马等脑区的谷氨酸释放量大量增加[55]。通过对α7nAChR表达量的调控,研究者进一步验证了α7nAChR对谷氨酸释放的调控作用。Jiang等[56]在野生型小鼠和CHRNA7敲除小鼠的对比研究中发现,烟碱暴露使谷氨酸能突触传递增强,其中α7nAChR发挥促进谷氨酸能传递的作用。Ryu等[47]报道,通过在大鼠背侧纹状体显微注射MLA的方式下调α7nAChR的功能后,实验大鼠中烟碱诱导的纹状体区域细胞外谷氨酸浓度和神经元活动水平显著降低。与此类似,Howe等[57]使用谷氨酸生物传感器以高时间精度监测大鼠背侧纹状体中谷氨酸的释放,证实α7nAChR增加了谷氨酸的释放量。
同时,谷氨酸能的传递将引发多巴胺能神经元兴奋[58],使其释放大量多巴胺[59],从而带来愉悦、欣快感[8,60~63]。Spanos等[64]利用快速扫描循环伏安法证明,乙酰胆碱和谷氨酸协同作用于腹侧被盖区中的多巴胺神经元,以调节腹侧被盖区、伏隔核的多巴胺能输出。McGehee等[11,65]利用CHRNA7敲除大鼠和电生理技术证实,烟碱通过结合中脑边缘多巴胺系统腹侧被盖区α7nAChR,增强谷氨酸能输入,促进谷氨酸释放,同时,腹侧被盖区显微注射谷氨酸受体拮抗剂DNQX可以可逆性地阻断多巴胺神经元超极化所激发的电流,这证明谷氨酸对多巴胺能神经元具有激活作用,可诱导其兴奋性的长时程增强,促进多巴胺的释放。Stoker等[66]认为烟碱通过激活位于腹侧被盖区多巴胺能神经元突触后的谷氨酸能神经元末端的α7nAChR,增加谷氨酸能传递,激活从腹侧被盖区到伏隔核的多巴胺能投射(图2)。综上可知,α7n-AChR主要通过谷氨酸能和多巴胺能的传递实现对多巴胺释放的调控,进而影响烟碱成瘾。
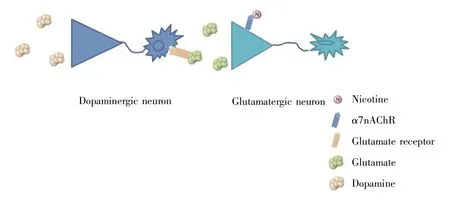
图2 烟碱结合α7nAChR释放谷氨酸进而调控多巴胺释放的示意图Fig.2 Schematic diagram showing nicotine binding to α7nAChR to release glutamic acid and then to regulate dopamine release
另外,对于α7nAChR在烟碱戒断过程中的调控作用,Barik等[34]聚焦于α7nAChR对去甲肾上腺素的调控,认为α7nAChR通过对谷氨酸释放的调控影响肾上腺素的水平,而肾上腺素的释放与γ-氨基丁酸密切相关,γ-氨基丁酸作为一种抑制性神经递质与烟碱戒断密切相关。
3.2 α7nAChR参与神经突触可塑性改变
烟碱慢性、反复作用将导致奖赏系统、学习记忆环路中一系列神经适应性变化,其中的重要机制是神经突触可塑性改变[67]。烟碱成瘾涉及烟碱所引发的突触可塑性的细胞和分子水平的病理变化[68],形态表现为树突分支和树突棘密度的增加,功能上表现为突触传递的长时程增强和长时程抑制等变化。有研究证实α7nAChR参与了神经突触可塑性的改变。研究者利用免疫荧光染色和共聚焦显微成像等手段发现,CHRNA7敲除小鼠海马区的谷氨酸能神经元突触减少,同时膜片钳记录也显示谷氨酸能输入减少,这说明α7nAChR可以引发谷氨酸能突触可塑性变化,并在谷氨酸能神经元的形态和功能成熟中起着重要作用[69~70]。在此之前,有研究利用单细胞记录法等手段证实,全身性的烟碱暴露通过α7nAChR增强突触前和突触后的谷氨酸功能,并引发谷氨酸能神经元的突触可塑性变化[53,71]。此外,基于CHRNA7基因敲除小鼠的研究发现,CHRNA7缺失的小鼠在发育期间皮质N-甲基-D-天冬氨酸(N-methyl-D-aspartic acid,NMDA)受体的表达和谷氨酸能神经元突触的形成减少[48]。Morel等[72]利用体外电生理等手段也证实,α7nAChR激动剂和烟碱一样都可以激活谷氨酸能神经元并使其产生可塑性变化。
α7nAChR在兴奋性信号输入中参与谷氨酸能神经元突触可塑性变化的形成和对多巴胺能神经元的长时程增强作用,进而在学习和记忆控制中发挥作用,这也解释了α7nAChR在线索诱导的成瘾模型中的特有影响。
3.3 α7nAChR的作用随烟碱暴露时间不同而显现出差异
随烟碱暴露时间的延长,α7nAChR对实验动物行为的调控会发生变化。Levin等[73]在CHRNA7敲除小鼠的烟碱长期暴露研究中发现,α7nAChR在烟碱暴露全过程不同阶段显现出不同的作用,在烟碱暴露的最初几周内,CHRNA7敲除小鼠与野生型对照小鼠没有显著差异,并不影响烟碱成瘾模型的构建,但在之后的较长时间内,CHRNA7敲除小鼠的烟碱自主消耗急剧下降,而且在整个研究的5个月期间,CHRNA7敲除引起的烟碱消耗减少持续存在。该长期对照实验提示,在烟碱暴露初期,下调α7nAChR功能并未影响烟碱成瘾模型的构建和自主获取烟碱的行为;但当烟碱暴露时间加长时,下调α7nAChR的功能则会对自主获取烟碱行为产生负面影响。
另外,在烟碱急性暴露和长期暴露的条件下,α7nAChR对谷氨酸释放的调节作用不同。通常,α7nAChR引起谷氨酸释放[34,49~51],α7nAChR特异性激动剂PAM可以增加α7nAChR介导的谷氨酸释放[74]。但是,急性烟碱暴露不会通过α7nAChR增加谷氨酸释放量。Pons等[9]的实验结果表明,CHRNA7敲除大鼠与对照组大鼠在烟碱急性暴露(8.7~52.6 μg/kg)下并无差异,烟碱不会使腹侧被盖区中谷氨酸能轴突上的α7nAChR脱敏,进而释放多巴胺并改变多巴胺能神经元的放电模式。Ryu等[47]证实烟碱急性暴露不会引起细胞外谷氨酸浓度变化。在一项卷烟烟气冷凝物暴露的动物实验中,Ryu等[54]借助谷氨酸生物传感器发现,长期烟碱暴露(1.0 mL·kg-1·d-1,sc)的大鼠相较于烟碱暴露1 d的大鼠,谷氨酸能神经元超敏化时间延长,背侧纹状体区域细胞外谷氨酸浓度显著增加。这是基于α7nAChR对谷氨酸能神经元可塑性的影响,随着烟碱暴露时间延长,α7nAChR对谷氨酸能神经元的影响逐渐加强,新的神经回路形成,故其对谷氨酸释放量的调控也随之变化。
随着烟碱暴露时间的变化,α7nAChR对多巴胺的调控也会发生改变。Besson等[75]利用自身给药系统和微透析等手段,在野生型和CHRNA7基因敲除大鼠的对比研究中发现,烟碱诱导的多巴胺释放受α7nAChR调控,随着暴露时间延长,细胞外多巴胺水平升高,而后逐渐降低。
综上可知,在烟碱暴露的过程中烟碱的作用不断加强,并通过α7nAChR影响谷氨酸能神经元的可塑性,逐渐构建α7nAChR通过谷氨酸介导释放多巴胺的神经回路,因此α7nAChR对谷氨酸、多巴胺的调控会随烟碱暴露时长的变化而调整,实验动物在行为学上也会随之表现出不同。
3.4 α7nAChR在多巴胺调控中的维稳作用
α7nAChR在中枢神经中的表达量虽然很高,但是却不是调控多巴胺释放的唯一因素。Besson等[75]发现在缺乏α7nAChR的情况下,烟碱在腹侧被盖区内多巴胺能神经元的长时程增强作用减弱,但仍然存在。Liu等[76]也借助MLA的预处理和烟碱自身给药模型(0.03 mg/kg)证明,在烟碱成瘾构建阶段主要是α4β2nAChRs而不是α7nAChR介导了烟碱的长时程增强作用。Parikh等[77]的研究发现,烟碱所诱发的胆碱能和谷氨酸能变化是瞬变的衰减而不是振幅衰减,α7nAChR对谷氨酸能和多巴胺能的调控是减缓其变化速率。Wickham等[78]通过在腹侧被盖区内微注射特异性拮抗剂MLA下调α7nAChR的功能,评估α7nAChR对多巴胺释放的调控,结果证实α7nAChR调节伏隔核中多巴胺的阶段性释放,放缓多巴胺的释放速度,避免多巴胺瞬时剧烈变化。Mameli-Engvall等[79]则认为,在中脑边缘多巴胺系统的烟碱和内源性乙酰胆碱所介导的多巴胺能神经元调节过程中,β2*nAChRs做直接性调节,α7nAChR则更精细地调节这些神经元的反应。激活β2*nAChRs可将多巴胺能神经元从静止状态转变为激发状态,而激活α7nAChR可以很好地调节激发状态下多巴胺能神经元的状态,且这种调节只有当β2*n-AChRs激活多巴胺神经元之后才起作用。同时,当腹侧被盖区中的烟碱浓度显著增加时,对烟碱具有低亲和力的其他nAChRs可能被激活并补偿α7nAChR 的缺乏[75]。Brunzell等[38]还发现,上调α7nAChR的功能对β2*nAChRs的功能产生负面影响。α7nAChR的功能上调可弥补其他nAChRs功能下调带来的多巴胺释放量不足,下调则可以减弱其他nAChRs功能上调引发的多巴胺过量释放,进而使nAChRs的多巴胺总调控能力保持在一定的水平,因此敲除CHRNA7或使用α7nAChR特异性抑制剂等手段并不能阻碍烟碱成瘾模型的构建。
α7nAChR在成瘾过程中对多巴胺的调控作用主要是维持多巴胺释放的稳态[80]。α7nAChR的维稳作用与其亲和力低、脱敏速度慢等特点相关,也与其减缓多巴胺释放速率的特性相关。由于α7nAChR对谷氨酸、多巴胺的调控作用随烟碱暴露时间不同而不同,且其在成瘾不同阶段对多巴胺释放起到维稳作用[81],因此在成瘾、戒断等不同阶段对α7nAChR实施调控,可能引发实验动物行为学表征结果的差异。在烟碱成瘾模型构建阶段,为了维持多巴胺稳态,α7nAChR的表达量会上调,以控制多巴胺的释放速度和释放总量,减缓多巴胺大量且长时间释放带来的冲击,因而在这个时候下调α7nAChR的功能,对烟碱成瘾模型的构建并无负面影响,但是上调α7nAChR的功能却无法成功构建烟碱成瘾模型。随着烟碱暴露时间延长,α7nAChR会影响谷氨酸能神经元的突触可塑性,可以借由谷氨酸能传递兴奋引发多巴胺能神经元兴奋,使机体释放大量多巴胺。在此时进行烟碱戒断,α7nAChR为了维持体内稳态,会出现短暂性的上调,使机体释放大量谷氨酸进而释放大量多巴胺,弥补烟碱不足引发的多巴胺缺口,所以在戒断阶段下调α7nAChR的功能,避免了大量多巴胺释放带来的强烈兴奋,因而无法完成重建。
3.5 α7nAChR与学习记忆环路密切相关
烟碱成瘾涉及的神经环路与学习记忆环路密切相关,且有很大部分重叠。烟碱引发的突触可塑性的细胞和分子水平的病理变化主要发生在奖赏和学习记忆的神经环路,如腹侧被盖区、伏隔核、前额叶皮层、海马CA1脑区等[67~68]。
有证据显示α7nAChR在学习记忆方面发挥着重要作用。Wright等[22]将α7nAChR特异性拮抗剂MLA(6.7 μg)显微注射于大鼠的腹侧海马中以下调α7nAChR的功能,结果显示,与正常大鼠相比,下调α7nAChR的功能致使大鼠无法完成阿片类药物CPP的重建,提示α7nAChR在检索并唤起药物记忆中发挥特定作用。Zhou等[39]的研究显示,不同程度的运动致使烟碱暴露(0.5 mg/kg)的大鼠α7nAChR的表达量不同,而实验大鼠的两项学习记忆行为评价范式Go/NoGo和MWM测试性能与α7nAChR表达量呈正相关,α7nAChR的高表达使实验大鼠的学习记忆能力明显提高。另外,Young等[82]通过对野生型和CHRNA7敲除小鼠实施对比训练证实,烟碱成瘾和学习记忆存在密切联系,CHRNA7的缺失并不影响实验小鼠对烟碱的获取,也不影响空间记忆任务的完成,但是随着任务难度的加大,CHRNA7敲除小鼠与野生型小鼠相比,如果要获得相同的完成度则需要更久的时间。
大脑中药物暴露引发的神经突触可塑性变化使机体对药物和环境产生异常联系,当再次暴露于相关环境就会检索并唤起相关记忆,然后产生强迫性的用药和心里渴求[83]。Stoker等[66]认为,线索诱导的烟碱觅药行为主要是因为α7nAChR引发的伏隔核中的谷氨酸能传递,伏隔核中的谷氨酸能传递不但参与烟碱引发的中脑边缘神经回路的长时程增强,在恢复线索诱导的烟碱觅药行为中也起到重要作用,所以当α7nAChR功能缺失时,即便相关环境线索再次出现,但是谷氨酸能传递受其影响无法被激活,环境线索的记忆也因此无法被唤起,重建无法完成。
烟碱成瘾神经环路和学习记忆环路密切相关,当前越来越多的研究者把烟碱成瘾研究的关注点放在成瘾记忆的编码、储存和提取上。α7nAChR在学习记忆方面发挥着重要作用,通过影响谷氨酸能等神经元的可塑性变化,使实验动物对烟碱和环境因素产生关联,进而调控烟碱暴露下环境线索记忆的编码、储存和提取[36]。环境线索记忆作为成瘾记忆的重要组成部分,在烟碱成瘾的获得、戒断、重建等不同阶段都有着重要影响。
4 总结与展望
烟碱暴露引发大脑中α7nAChR表达量的变化,而上调和下调两种调控α7nAChR功能手段的实施也验证了α7nAChR在烟碱成瘾形成、消退、重建(包括线索诱导的重建)过程中起着重要作用。在烟碱成瘾构建阶段,基因敲除或者抑制剂等手段并不阻碍烟碱成瘾模型的构建,而使用α7nAChR激动剂反而会对烟碱的自主消耗和成瘾模型的构建产生负面影响。在烟碱戒断阶段,抑制α7nAChR会促进实验动物成功戒断,阻碍重建,而使用激动剂上调α7nAChR功能则对实验动物的戒断症状无明显影响,这与成瘾阶段α7nAChR所行使的功能相反。另外,在烟碱暴露过程中,下调α7nAChR功能致使线索诱导的烟碱寻求失败,证实了α7nAChR在烟碱暴露中的调控与环境线索密切相关。再有,α7nAChR在烟碱暴露过程中的调控随时间发生变化,这种变化依赖于α7nAChR对谷氨酸能神经元可塑性的影响,α7nAChR引发谷氨酸的释放进而引发多巴胺的大量释放,引起兴奋,最终达到维持多巴胺稳态的作用效果。
α7nAChR作为大脑中广泛存在的乙酰胆碱受体之一,由于受其亲和力低的说法所限,其机制研究尚不充分,研究手段也很局限。当前,对于α7nAChR上游调控机制的研究更偏向于基因敲除等手段,首先基因敲除的精准调控程度和无损程度较差,其次转基因动物模型构建耗费时间长。另外,目前针对α7nAChR的RNA层面的调控研究还较少,随着基因编辑和光遗传等新兴技术的兴起与完善,研究层面从DNA调控转变为RNA调控或许对α7nAChR的深入研究更为有利。对于其下游调控机制的研究,目前更多的还是关注神经环路的探索及其对神经递质释放的影响,虽然国内外研究对于这些领域的探索还在不断深入中,但是其已知功能机制的解释还不够明确,未知的功能和作用仍待挖掘。其中,α7nAChR对多巴胺的维稳作用及其作用下神经回路的逐渐构建过程的神经生物学机制还不够详尽。现有研究显示,α7nAChR在线索诱导的烟碱寻求恢复中发挥重要作用,但其中详细机理仍未阐明。α7nAChR发挥作用的核团和神经环路也尚未完全揭示,如对药物成瘾也具有重要意义的缰核、与记忆储存唤起密切相关的海马,且α7nAChR在烟碱戒断阶段的神经生物学机制是否与“戒断因子”促肾上腺皮质激素释放因子或γ-氨基丁酸和5-羟色胺等抑制性神经递质相关还有待探索。同时,同源五聚体α7nAChR有5个功能性激动剂结合位点,通常需要两个激动剂(乙酰胆碱、烟碱等激动剂)占用结合位点才能实现通道开放,独特结构和子通道的脱敏或重新敏化速率所带来的与其他乙酰胆碱受体功能上的不同仍有待挖掘。并且,α7nAChR的功能可以被其他乙酰胆碱受体所代偿的具体机制也有待探索。最后,α7nAChR已知与多种复杂行为如学习、成瘾、记忆密切相关,其功能、机制间如何相互影响也有待进一步探索。
