电离辐射及不同条件培养基诱发骨髓间充质干细胞基因组不稳定性的比较研究
2021-06-01张利英张苡铭周妮娜卢志伟华君瑞李洋洋刘永琦
张利英,张苡铭,周妮娜,卢志伟,丁 楠,华君瑞,李洋洋,周 婷,刘 颖,3*,刘永琦,4*
(1.甘肃中医药大学甘肃省高校重大疾病分子医学与中医药防治研究省级重点实验室,中国甘肃兰州730000;2.中国科学院近代物理研究所甘肃省空间辐射生物学重点实验室,中国甘肃兰州730000;3.甘肃中医药大学附属医院急诊科,中国甘肃兰州730000;4.甘肃中医药大学敦煌医学与转化省部共建教育部重点实验室,中国甘肃兰州730000)
国家癌症中心2019年数据显示,肺癌是我国发生率、死亡率最高的癌症[1]。放疗是临床上肺癌治疗比较常用且有效的方法之一[2],但是在放疗的过程中,高能射线除了能够杀死肿瘤细胞,也会给放疗病人带来一些毒副作用,导致微核形成、DNA双链断裂(DNA double-strand break,DSB)、氧化自由基产生、免疫系统功能改变以及造血系统损害[3]。辐射生物学中把受照射细胞影响其周围没有受到辐射的细胞,使未受照射细胞也出现相同的损伤现象称为辐射旁效应(radiation-induced bystander effect,RIBE)[4]。多项研究已证明,活性氧(reactive oxygen species,ROS)、一氧化氮(nitric oxide,NO)、转化生长因子-β1(transforming growth factor β1,TGF-β1)等可溶性因子可介导RIBE 的发生,引起旁组织细胞或远端组织器官出现基因突变、基因组不稳定性增加、染色体畸变和细胞凋亡等损伤[5~6]。课题组前期研究也发现ROS、NO和TGF-β1在RIBE中发挥关键作用[7]。因此,研究上述因子在肺癌放疗时由于RIBE而诱发的旁组织、细胞等基因组不稳定性中的作用非常必要。
骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMMSCs)是造血微环境的核心,易受到辐射出现急性损伤[8],而其结构和功能的完整性是生理状态尤其是应激条件下维持造血功能稳定和造血重建的基础[9]。在肺癌放疗过程中,BMMSCs会受到直接照射,或者由于可溶性因子介导RIBE而发生损伤,但是哪种因素占主导作用仍未可知。本研究拟建立直接辐照BMMSCs(即IR组)、转移辐照A549的条件培养基作用于BMMSCs(即A549-medium组)、转移辐照BMMSCs的条件培养基作用于BMMSCs(即BMMSCs-medium组)3种模型,观察BMMSCs在3种模型中的基因组损伤情况,以衡量在肺癌辐照时引起BMMSCs旁损伤的权重因素,为BMMSCs的防护靶点研究提供依据。
1 材料与方法
1.1 实验材料
二氧化碳培养箱(Thermo公司,美国);荧光显微镜(Nikon公司,日本);BMMSCs及其专用培养基(ScienCell公司,美国);人A549细胞株(中国科学院上海生命科学研究院细胞资源中心);DMEM/F-12 1∶1(1X)培养基、0.25%胰蛋白酶(Hyclone公司,美国);细胞松弛素B(北京索莱宝科技有限公司);4′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole,DAPI)(Sigma公司,美国);53BP1(tumor suppressor p53 binding protein 1)兔抗、免疫荧光抗体594羊抗兔(Abcam公司,美国);人TGF-β1 ELISA Kit(北京欣博盛生物科技有限公司);人NO ELISA Kit和人ROS ELISA Kit(上海西唐生物科技有限公司)。
1.2 细胞培养
BMMSCs用专用培养基培养,A549用DMEM/F-12 1∶1(1X)培养基培养。将细胞置于37℃、5%CO2细胞培养箱中用60 mm的培养皿培养。每2~3 d换液1次,待细胞融合度达到80%~90%后,用0.25%胰蛋白酶消化传代,第5代细胞用于实验。
1.3 细胞辐照和条件培养液的收集
电离辐射(ionizing radiation,IR)由中国科学院近代物理研究所的X射线辐照装置提供,剂量率为0.6 Gy/min(100 KeV,5 mA),辐照总剂量分别为1 Gy、2 Gy、4 Gy。辐照前吸取培养基剩至1 mL。
细胞接种后培养18~24 h,更换新鲜培养基,然后进行辐照处理。继续培养3 h后,收集培养基,10 000 r/min离心5 min,去除细胞碎片,即为条件培养基。
1.4 实验分组
实验分为正常BMMSCs组(Control)、直接照射BMMSCs组(IR)、A549旁效应组(A549-medium)和BMMSCs旁效应组(BMMSCs-medium)。Control组中的BMMSCs不接受任何处理,IR组用0 Gy、1 Gy、2 Gy、4 Gy的X射线辐射正常的BMMSCs,A549-medium 组用 0 Gy、1 Gy、2 Gy、4 Gy 的 X 射线辐照A549后转移其条件培养基作用于正常的BMMSCs,BMMSCs-medium 组用 0 Gy、1 Gy、2 Gy、4 Gy的X射线辐照BMMSCs后转移其条件培养基作用于正常的BMMSCs。
1.5 指标检测
1.5.1 克隆形成实验测定BMMSCs的克隆存活率
取对数生长期BMMSCs制成单细胞悬液,种于60 mm的培养皿中,每皿100个细胞,24 h后Control组更换为新鲜培养液,IR组更换为新鲜培养液后照射,A549-medium组和BMMSCs-medium组分别更换为A549条件培养基和BMMSCs条件培养基,放入细胞培养箱中继续培养。13 d后弃培养液,磷酸缓冲盐溶液(phosphate buffer saline,PBS)快速洗3遍,甲醇固定15 min,亚甲基蓝染色30 min,用清水将培养皿洗净晾干。显微镜下计数含50个细胞以上的细胞集落。细胞克隆存活率按如下公式计算:细胞克隆存活率=处理组克隆形成率/对照组克隆形成率。实验进行3次生物学重复。
1.5.2 细胞松弛素法检测细胞微核形成率
取对数生长期BMMSCs制成单细胞悬液1×104mL-1,接种至24孔板,贴壁后Control组更换为新鲜培养液,IR组更换为新鲜培养液后照射,A549-medium组和BMMSCs-medium组分别更换为A549条件培养基和BMMSCs条件培养基。各组细胞加入1 μL细胞松弛素B(终质量浓度4 μg/mL)培养48 h,随后PBS洗两次,冰乙酸和甲醇(体积比1∶9)固定,通风橱干燥20 min,吖啶橙染料染色。最后,计算细胞微核率[10],即用荧光显微镜观察1 000个双核细胞,计数细胞微核数所占细胞总数的千分率(‰)。实验进行3次生物学重复。
1.5.3 免疫荧光检测53BP1焦点形成水平
取无菌的12孔板,每孔加入20 mm×20 mm已灭菌盖玻片。将BMMSCs制成2×103mL-1单细胞悬液,种入12孔板(每孔2 mL),每组设3次重复。贴壁后Control组更换为新鲜培养液,IR组更换为新鲜培养液后照射,A549-medium组和BMMSCs-medium组分别更换为A549条件培养基和BMMSCs条件培养基。各组细胞分别培养0.5 h后收集样品[11]。冷甲醇中固定20 min后,0.5%Triton-X 100孵育10 min;5%脱脂牛奶封闭1 h后与兔抗53BP1多克隆抗体在室温孵育2 h,用PBST洗涤3遍后再与IgG免疫荧光二抗在室温孵育1 h,用PBST洗涤5遍,细胞核以DAPI进行复染并制片。荧光显微镜观察并拍照,每个样品计数100个细胞并计算平均焦点数目。
1.5.4 ELISA法检测旁效应组培养上清中TGF-β1、ROS和NO的水平
取对数生长期BMMSCs和A549,分别制成1×104mL-1的单细胞悬液,种于35 mm的培养皿中,24 h贴壁后更换新鲜培养基,2 Gy X射线照射,各组细胞分别培养 0.5 h、2 h、6 h、8 h,在对应的不同时间点收集样品[11],按照ELISA试剂盒说明书步骤进行目标因子的检测。
1.5.5 统计学处理
2 实验结果
2.1 不同剂量X射线对直接辐照组和旁效应组细胞克隆存活率的影响
图1和表1表示不同处理组细胞的克隆存活率水平。从结果可知,IR组细胞、旁效应组(A549-medium组和BMMSCs-medium组)细胞的克隆存活率均随着辐照剂量的增加而降低;与0 Gy IR组相比较,1 Gy、2 Gy及4 Gy辐照剂量下各组细胞的克隆存活率均降低,差异有统计学意义(P<0.05)。此外,在同一辐照剂量下,IR组细胞的克隆存活率均显著低于旁效应组(P<0.05);A549-medium组细胞的克隆存活率较BMMSCs-medium组偏低,且辐照剂量在2 Gy和4 Gy时差异具有统计学意义(P<0.05)。

图1 不同处理组细胞的克隆存活率统计分析图*:P<0.05,**:P<0.01 vs.空白对照组(0 Gy IR);▲:P<0.05 vs.IR组(同一辐照剂量);#:P<0.05 vs.A549-medium组(同一辐照剂量)。Fig.1 The cell clone formation rates in different groups treated with various radiation doses*:P<0.05,**:P<0.01,compared with control group(0 Gy IR);▲:P<0.05,compared with IR group(at the same dose);#:P<0.05,compared with A549-medium group(at the same dose).

表1 不同处理组细胞的克隆存活率Table 1 The cell clone formation rates in different treatment groups
2.2 不同剂量X射线对直接辐照组和旁效应组细胞微核形成率的影响
图2、图3分别表示不同处理组细胞微核形成率的显微观察结果和统计分析结果。实验结果显示:各组细胞微核率呈现辐照剂量依赖性增大;与0 Gy IR组相比较,旁效应组(A549-medium组和 BMMSCs-medium 组)在 1 Gy、2 Gy及 4 Gy辐照剂量下的微核数均增多,且在2 Gy和4 Gy时差异有统计学意义(P<0.05);4 Gy直接照射时,细胞微核率最大。此外,在同一辐照剂量下,IR组较旁效应组(A549-medium组和BMMSCs-medium组)的微核率高,并在辐照剂量为2 Gy和4 Gy时差异具有统计学意义(P<0.05);在同一辐照剂量的旁效应组中,A549-medium组的微核率较BMMSCsmedium组高,并在辐照剂量为2 Gy和4 Gy时差异具有统计学意义(P<0.05)。
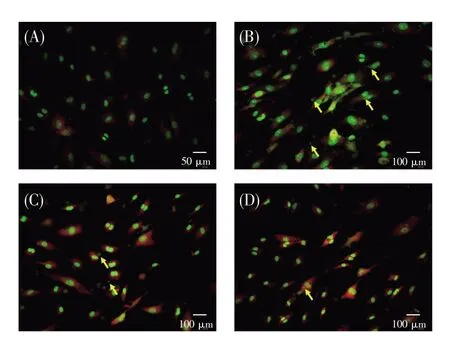
图2 不同处理组在2 Gy辐照剂量时对细胞微核形成影响的显微观察图(40×)经吖啶橙染色的细胞微核结果,黄色箭头指示细胞在进行有丝分裂时形成的微小的核结构样物质。A:Control组;B:IR组;C:A549-medium组;D:BMMSCs-medium组。Fig.2 Micronucleus formation in cells treated with 2 Gy dose in different groups(40×)The cells were stained with acridine orange.The yellow arrows indicate the tiny nuclear structure-like substance formed in cells during mitosis.A:Control group;B:IR group;C:A549-mediumgroup;D:BMMSCs-medium group.
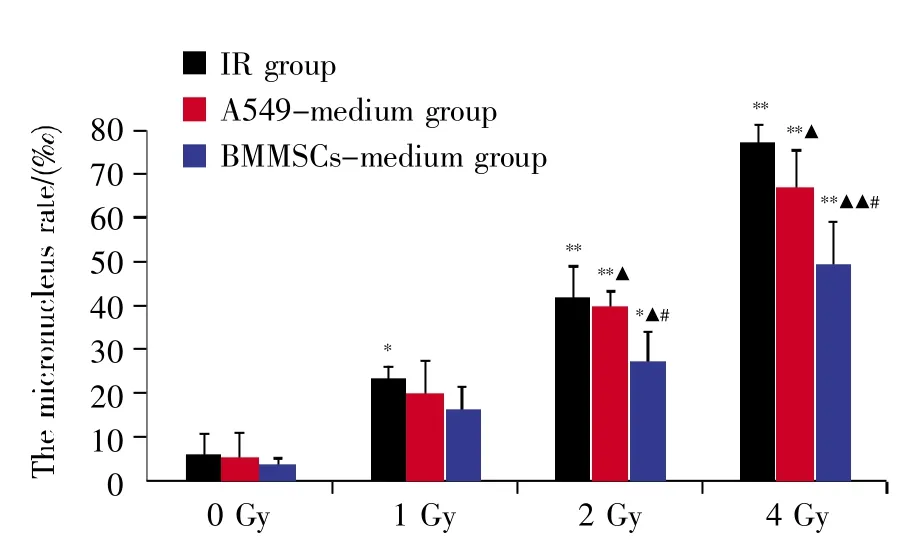
图3 不同处理组细胞微核形成率的统计分析图*:P<0.05,**:P<0.01 vs.空白对照组(0 Gy IR);▲:P<0.05,▲▲:P<0.01 vs.IR组(同一辐照剂量);#:P<0.05 vs.A549-medium组(同一辐照剂量)。Fig.3 The rates of micronucleus formation in cells treated with various radiation doses in different groups*:P<0.05,**:P<0.01,compared with control group(0 Gy IR);▲:P<0.05,▲▲:P<0.01,compared with IR group(at the same dose);#:P<0.05,compared with A549-medium group(at the same dose).
2.3 不同剂量X射线对直接辐照组和旁效应组细胞DSB损伤的影响
图4表示不同剂量、不同处理组细胞53BP1焦点数目的统计分析结果,图5表示2 Gy X射线照射0.5 h后各组细胞53BP1焦点的免疫荧光分析结果。从结果可知,各组细胞的53BP1焦点数呈现辐照剂量依赖性增大;在同一辐照剂量下,IR组比旁效应组(A549-medium组和BMMSCs-medium组)细胞的53BP1焦点数高,差异具有统计学意义(P<0.05);在同一辐照剂量的旁效应组中,A549-medium组的53BP1焦点数较BMMSCs-medium组高,并在辐照剂量为2 Gy和4 Gy时差异具有统计学意义(P<0.05)。
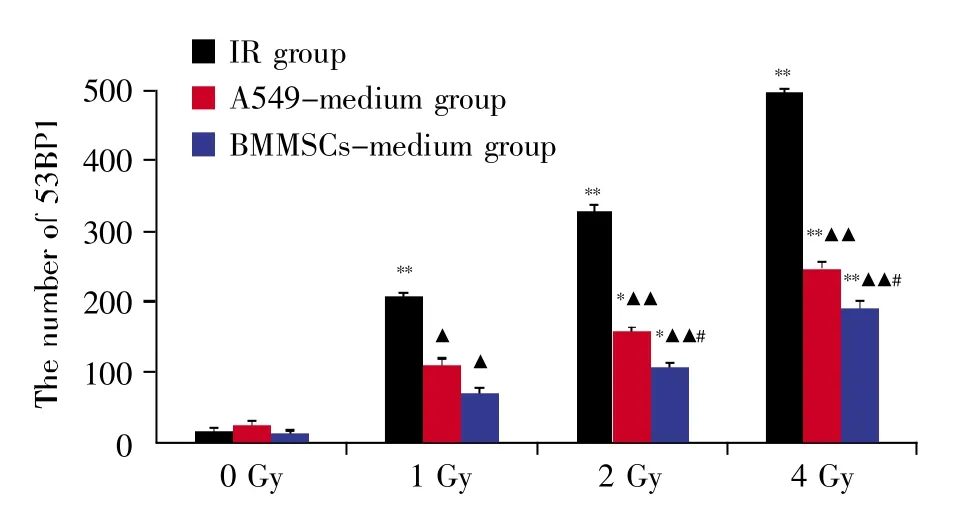
图4 不同处理组细胞的53BP1焦点数目*:P<0.05,**:P<0.01 vs.空白对照组(0 Gy IR);▲:P<0.05,▲▲:P<0.01 vs.IR 组(同一辐照剂量);#:P<0.05 vs.A549-medium组(同一辐照剂量)。Fig.4 53BP1 foci detection in different treatment groups*:P<0.05,**:P<0.01,compared with control group(0 Gy IR);▲:P<0.05,▲▲:P<0.01,compared with IR group(at the same dose);#:P<0.05,compared with A549-medium group(at the same dose).
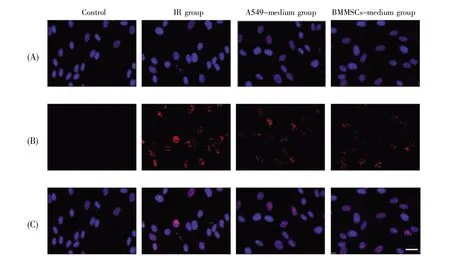
图5 2 Gy辐照0.5 h时不同处理组细胞53BP1焦点水平的免疫荧光图(60×)(A)DAPI染色细胞核(蓝色);(B)免疫荧光染色53BP1(红色);(C)DAPI染色细胞核和免疫荧光染色53BP1的合成图(merger)。标尺:50 μm。Fig.5 53BP1 foci detection by fluorescence microscope after 2 Gy radiation for 0.5 h(60×)(A)Nuclei stained by DAPI(blue);(B)53BP1 stained by immunofluorescence(red);(C)Images merged by corresponding(A)and(B).Scale bar:50 μm.
2.4 旁效应组条件培养液中不同时间点ROS、NO和TGF-β1的表达水平
为探究辐射旁效应中可能发挥作用的物质及分子,本研究进一步用ELISA法检测了2 Gy辐照下A549和BMMSCs条件培养液中ROS、NO和TGF-β1的表达水平。从图6可知,在旁效应组的A549和 BMMSCs条件培养液中,TGF-β1、ROS和NO的相对表达水平均升高,其中,TGF-β1的水平随着培养时间的增加而增加;ROS的水平在2 h达到最高峰,之后迅速降低;NO的水平则在0.5 h达到最高峰,之后随着培养时间的延长缓慢降低。此外,与BMMSCs-medium组相比,A549-medium组条件培养液中TGF-β1和ROS的表达水平在6 h、8 h显著升高(P<0.05),NO的表达水平在2 h、6 h、8 h 时显著升高(P<0.05)。
3 讨论
放疗是肺癌的主要治疗手段之一,尤其是对于早期非小细胞肺癌,放射治疗效果显著。但困扰临床的主要问题之一就是在肺癌放疗过程中所产生的副作用,即肺癌辐照过程会引起非辐照部位的损伤效应,并且临床上的辐射副作用从某种程度上可以用生物医学上的RIBE来解释。RIBE在生物学上主要表现为细胞生长受抑、细胞凋亡、基因突变、基因组不稳定性增加、染色体畸变甚至形成二次癌症等[6,8]。53BP1是DSB中的重要调节蛋白质。在辐射诱发的DSB中,53BP1被迅速招募至DSB处并聚集形成荧光显微镜下清晰可见的焦点,是辐射致DSB损伤的重要标志之一。微核是细胞在进行有丝分裂时所形成的微小的核结构样物质。已有多项研究表明,辐射时细胞微核增多、DSB升高,造成辐射细胞基因组不稳定性增加,并且会诱导细胞生长受抑、克隆水平降低[7,11]。因此,本研究用53BP1所形成的焦点数、细胞微核率和细胞克隆存活水平来评估辐射损伤所致细胞基因组不稳定性的水平。
BMMSCs具有自我更新、多向分化以及免疫调节等功能,是肺癌微环境中重要间质成分之一[12],具有良好的靶向趋向能力。BMMSCs具有向肺损伤、肺癌组织归巢迁移的能力[13],通过定植分化为Ⅰ型和Ⅱ型肺上皮细胞等正常细胞、免疫调节和建立较强的抗氧化防御系统,维持机体内环境的稳定[14]。但由于RIBE的存在,机体在进行肺癌放疗时,旁BMMSCs易受到损伤,出现生长受抑和基因组损伤,甚至分化为肿瘤干细胞,使机体形成二次肿瘤的可能性大大增加。在肺癌放疗过程中,BMMSCs往往会受到比较复杂的照射作用,会接收到直接照射,也会因可溶性因子介导RIBE发生损伤,其中哪一种因素占主导作用仍未可知。为验证肺癌辐射时BMMSCs损伤的权重情况,本研究采用直接照射法、转移A549辐照培养基法、转移BMMSCs辐照培养基法分别作用于BMMSCs,以模拟肺癌放疗过程中BMMSCs可能接受到的复杂情况。结果显示,直接照射BMMSCs时,BMMSCs的生长减慢(图1和表1),微核和53BP1焦点增多(图2~5),说明直接辐射组BMMSCs的增殖和基因组不稳定性均出现异常;同时,旁效应组中也出现了上述表现,但是不同种类的条件培养基作用后损伤程度不同,其中辐照A549所获得的条件培养基对BMMSCs的影响要强于辐照BMMSCs所获得的条件培养基对BMMSCs的影响(图 1~5)。
为进一步探讨其机制,对A549条件培养基和BMMSCs条件培养基中的可溶性分子TGF-β1、ROS以及NO进行了研究。目前,在转移辐射条件培养基模型中,已有多种旁效应信号因子被确认,如白细胞介素-6(interleukin-6,IL-6)、IL-1、肿瘤坏死因子(tumor necrosis factor,TNF)、TGF-β、ROS和NO等[15]。其中,TGF-β作为旁损伤效应的关键因子,能够显著抑制细胞的增殖[15];NO在旁效应中起到了先锋的作用,被称为旁损伤的罪魁祸首[16];ROS也可作为旁损伤的终点指标,并在引起基因组不稳定性方面发挥着重要作用[17]。课题组前期研究也发现ROS、NO和TGF-β1在RIBE中发挥关键作用[7]。本实验中,我们选取ROS、NO和TGF-β1为考察指标,分别检测其在不同时间点条件培养液中的表达水平。结果发现,3种因子在照射后的条件培养液中的表达水平均比非照射条件培养液高,且TGF-β1的水平随着辐照时间的延长不断增加,而ROS和NO的水平分别在2 h和0.5 h达到最高峰;此外,3种因子在A549条件培养液中的水平基本要高于BMMSCs条件培养液中的水平(图6)。有研究表明,辐射后的细胞所分泌的TGF-β1参与旁效应,诱导NADPH氧化酶的活化,导致细胞内ROS含量增加;同时,TGF-β1、IL-8也可以激活丝裂原激活的蛋白激酶(mitogenactivated protein kinase,MAPK)通路,使旁效应细胞产生大量的ROS[18~19]。另外,Shao等[20]的研究证实NO的下游产物是由辐射诱导TGF-β1产生的,且NO与TGF-β1两种信号分子相互依存。当部分靶细胞受到照射时,NO及其下游产物TGF-β1由靶细胞释放,一旦TGF-β1与未照射细胞相互作用,即可通过依赖Ca2+的途径诱导胞内第二旁效应信号NO生成,并进一步诱导邻近细胞微核形成。综上所述,3种细胞因子可能是诱发RIBE的关键因子,且TGF-β作为旁效应最关键的细胞因子之一,其水平的升高可以引起ROS和NO的生成,从而介导RIBE的发生。
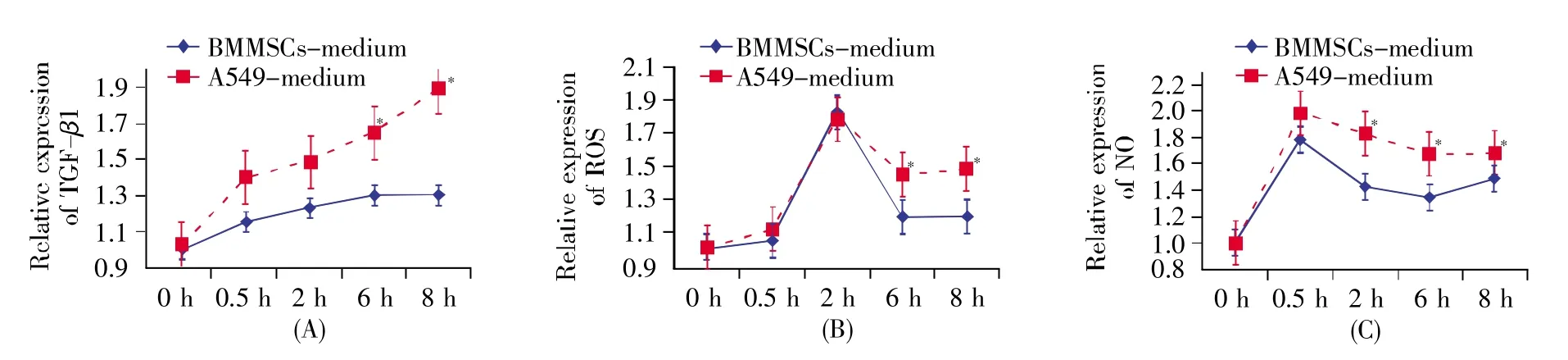
图6 旁效应组条件培养液中不同时间点TGF-β1、ROS和NO的表达水平分析*:P<0.05 vs.BMMSCs-medium 组(2 Gy)。Fig.6 The relative concentrations of TGF-β1,ROS and NO in conditioned mediums at different time points*:P<0.05,compared with BMMSCs-medium group(at 2 Gy dose).
总的来讲,本研究显示辐射可致BMMSCs的增殖和基因组不稳定性均受到影响;这种损伤能够通过条件培养基诱导未照射细胞产生相似的损伤效应,其中辐照A549所获得的条件培养基对BMMSCs的影响要强于辐照BMMSCs所获得的条件培养基对BMMSCs的影响;ROS、TGF-β1和NO等分泌型因子可能是转移辐射损伤、诱导RIBE的关键分子。
