miR-365通过靶向FoxO1抑制胃癌细胞的增殖
2021-06-01张慧敏王志文
陈 路,胡 爽,张慧敏,王 君,黄 凤,王志文*
(1.岳阳职业技术学院慢性病重点实验室,中国湖南岳阳414000;2.湖南师范大学附属岳阳医院/岳阳市二人民医院,中国湖南岳阳414000;3.武汉科技大学生命科学与健康学院,中国湖北武汉430065)
胃癌(gastric cancer,GC)是世界范围内常见的恶性肿瘤,其预后较差,严重威胁人类健康。2018全球癌症统计报告显示,全球胃癌新增病例约103万例,死亡约728 685例,胃癌在恶性肿瘤中的发病率居第5位,死亡率居第3位[1]。我国胃癌患者数量庞大,每年新发病例占全球新发病例的40%以上[2]。目前,单纯原发癌的胃切除仍是胃癌治疗的首选方法,但整体效果仍不理想[3~4],故早期发现和治疗以及阻断或延缓胃癌恶性进展是改善胃癌预后的必要条件[5]。
微RNA(microRNA,miRNA)是一类小的非编码RNA,通过与靶基因mRNA的3′非翻译区(3′-untranslated region,3′-UTR)碱基配对来调控30%以上的哺乳动物基因[6~8]。以往的研究表明,异常的miRNA表达与肿瘤的发生和发展密切相关,特别是在胃癌中[4,9~11]。一些在胃癌中表达发生改变的miRNA已经被证实可以控制胃癌细胞的增殖、凋亡和炎症[12~13]。有报道表明,miR-365在胃癌中可作为抑癌基因参与调控胃癌的发生[14]。我们的研究发现,miR-365在胃癌细胞系(AGS)内的表达水平低于正常胃上皮细胞(GES-1),但其对胃癌细胞的具体调控机制和方式尚未阐明,本文旨在进一步研究miR-365在胃癌细胞中参与调控胃癌发生的机制。
叉头盒蛋白(forkhead box protein)是一类转录因子,主要存在于无脊椎动物和哺乳动物细胞内,拥有一个高度保守的大于100个氨基酸的DNA结合域。该蛋白质的编码基因被分为19小类,分别命名为Fox A~S[15]。叉头转录因子O家族(FoxO)是叉头盒家族中最大的亚家族之一,迄今已在哺乳动物中鉴定出4个FoxO亚型(FoxO1、FoxO3a、FoxO4、FoxO6),它们都有序列相同的线虫同源基因[16]。在这些蛋白质中,FoxO1被广泛研究,是具有复杂活性的超转录因子。FoxO1调节许多靶标,包括凋亡和自噬相关的基因、抗氧化酶、细胞周期阻滞基因以及代谢和免疫调节剂[17~18]。目前普遍认为FoxO1蛋白是一种细胞周期抑制因子。然而,FoxO1蛋白在胃癌发生过程中的作用尚不明确[19]。
本文在分子和细胞水平探究了miR-365在胃癌中对细胞增殖的影响,可为阐明miR-365调控FoxO1的确切分子机制,揭示miR-365调节FoxO1进而调控胃癌细胞增殖的机制研究提供基础理论依据,同时也可为胃癌的治疗及预后干预和新的药物靶点研发提供基础支持。
1 材料与方法
1.1 材料
1.1.1 实验材料
人胃腺癌细胞AGS、MGC80-3和人正常胃上皮细胞GES-1购自美国典型培养物保藏中心(ATCC),分别在加有10%胎牛血清(fetal bovine serum,FBS)、1%青-链霉素的 D-MEM/F-12培养基、RPMI 1640培养基和DMEM培养基(均购自美国Gibco公司)中培养。pmirGLO载体源自美国A-ddgene公司。
1.1.2 主要试剂和仪器
胰蛋白酶、磷酸缓冲盐溶液(phosphate buffer saline,PBS)、ECL发光液、细胞增殖及毒性检测试剂盒(CCK-8)(大连美伦生物技术有限公司);抗cyclinD1、CDK4、CDK6、FoxO1 抗体(CST 公司,美国);anti-GAPDH(Santa Cruz公司,美国);兔/鼠二抗(Thermo公司,美国);荧光素酶报告实验所需试剂盒(Promega公司,美国);miR-365模拟物(miR-365 mimics)、模拟物对照(negative control,NC)、反转录试剂盒(广州市锐博生物科技有限公司);RNA提取试剂盒Ultrapure RNA Kit(康为世纪生物科技有限公司);BCA蛋白质浓度测定试剂盒、RIPA裂解液(强)、脱脂奶粉(碧云天生物技术有限公司);限制性核酸内切酶SalⅠ和XhoⅠ、T4连接酶(NEB公司);突变试剂盒Mut Express MultiS Fast Mutagenesis Kit V2、PCR 扩增酶 2× Rapid Taq Master Mix、转染试剂 ExFect®2000 Transfection Reagent(南京诺唯赞医疗科技有限公司);miRNA提取试剂盒miRNeasy Mini Kit(QIAGEN公司,德国)。多功能酶标仪(Thermo公司,美国);化学发光成像系统(Bio-Rad公司,美国)。
1.2 方法
1.2.1 质粒构建
以人基因组为模板扩增得到FoxO1 3′-UTR序列,将所得片段连接到pmirGLO载体上得到野生型荧光素酶报告质粒WT-pmirGLO-FoxO1。严格按照Mut Express MultiS Fast Mutagenesis Kit V2试剂盒说明书,以WT-pmirGLO-FoxO1质粒为模板构建FoxO1 3′-UTR与miR-365结合位点突变的荧光素酶报告质粒mut-pmirGLO-FoxO1,所需PCR引物(表1)在Primer Premier 5.0软件上设计,所得序列由上海擎科生物科技有限公司合成。
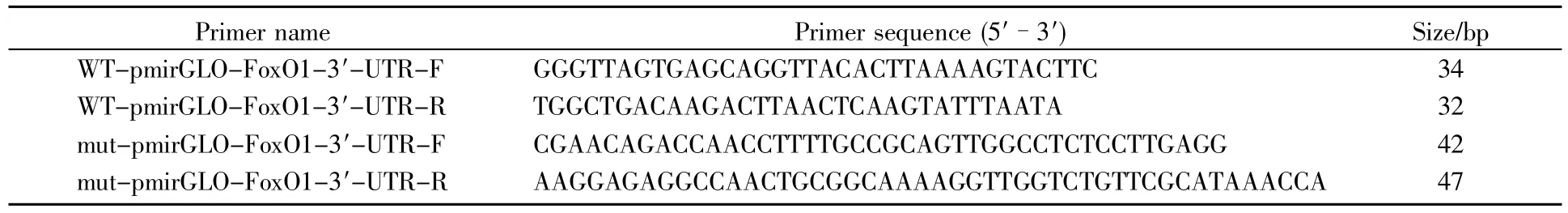
表1 FoxO1 3′-UTR报告质粒构建所需引物Table 1 Primers used for FoxO1 3′-UTR plasmid construction
1.2.2 细胞转染
在两支1.5 mL无菌离心管中各加入25 μL无血清培养基,然后一支添加适量的ExFect 2000转染试剂(1 μg目的质粒对应 2 μL ExFect 2000),一支添加适量的目的质粒,混匀。室温静置5 min后将目的质粒-培养基混合物滴加到ExFect 2000-培养基混合物中,并用移液器轻轻混匀。室温静置10 min后将ExFect 2000/目的质粒复合物滴加至含有AGS和MGC80-3细胞的培养基中,轻轻晃动培养皿使复合物均匀分布。过夜培养24~48 h后收取细胞,进行后续实验。
1.2.3 荧光素酶报告实验
将AGS以每孔2×105个细胞接种于24孔板(每组3个重复),待细胞贴壁后转染,转染24 h后收集细胞。将收集得到的细胞用1×PBS洗涤,然后加入 100 μL 1× passive lysis buffer,冰上裂解30 min后12 000 r/min离心收集上清。取10 μL上清,加入 100 μL luciferase assay buffer混匀后立刻用多功能酶标仪测荧光值并做记录,该过程应避光处理。取相同体积上清液进行蛋白质定量,将所得数据进行统计学分析。
1.2.4 细胞活性实验
AGS和MGC80-3细胞分别转染终浓度为1 μmol/L、5 μmol/L、10 μmol/L、20 μmol/L、40 μmol/L的miR-365 mimics和模拟物对照(NC),转染24 h后制备细胞悬液并对细胞进行计数。按照每孔5×103个细胞将细胞悬液接种于96孔细胞培养板(每组6个重复),最终要求每孔细胞悬液的体积约100 μL,待细胞贴壁后每孔加入10 μL CCK-8增强型溶液,在37℃培养箱内孵育1 h后测定570 nm处的吸光度值(A570nm),所得数据进行统计学分析。
1.2.5 miRNA/mRNA提取及RT-qPCR
细胞和病人组织样本的miRNA提取严格按照miRNeasy Mini Kit试剂盒中的说明书操作,mRNA的提取工作严格按照Ultrapure RNA Kit试剂盒进行。对提取的RNA进行定量,并将其按照反转录试剂盒说明书反转录成cDNA。将得到的cDNA按照Hieff qPCR SYBR Green Master Mix 10 μL、上游引物 0.8 μL、下游引物 0.8 μL、cDNA 2 μL、超纯水 6.4 μL 配成 20 μL PCR 扩增体系。扩增条件如下:95℃预变性10 min;95℃变性2 s、60℃退火20 s、72℃延伸10 s,共40个循环。其中,miRNA的RT-qPCR结果以U6为内参,mRNA的RT-qPCR结果以GAPDH为内参。RT-qPCR所需引物序列如表2所示,均由上海擎科生物科技有限公司合成。
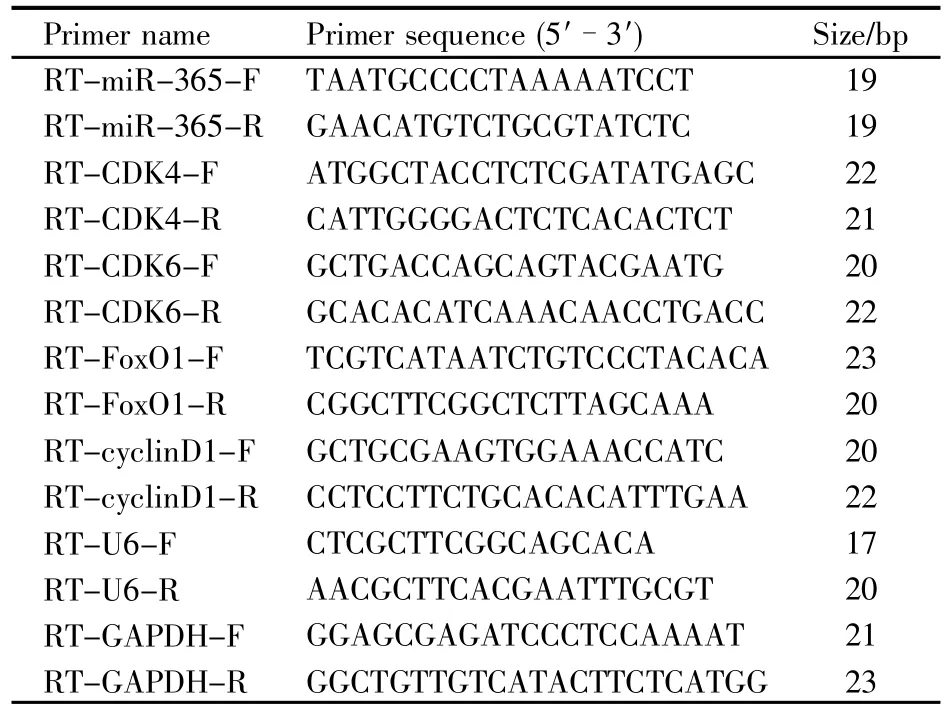
表2 RT-qPCR所需引物Table 2 Primers used for RT-qPCR
1.2.6 Western-blot分析
细胞经RIPA裂解液冰上裂解30 min后在4℃条件下12 000 r/min离心15 min取上清。采用BCA蛋白质定量试剂盒对目标蛋白质进行定量分析。取相同总量的蛋白质进行聚丙烯酰胺凝胶电泳;根据目的蛋白的相对分子质量,按照200 mA恒定电流、1 min/kD将蛋白质转移到PVDF膜上;转膜结束后将其用5%的脱脂牛奶室温封闭1 h。CyclinD1、CDK4、CDK6、FoxO1 一抗按照 1∶1 500稀释使用,4℃孵育过夜;TBST洗涤3次(每次10 min)后按照1∶3 000比例孵育兔/鼠二抗(根据一抗的种属来定),常温孵育1 h;TBST洗涤3次(每次10 min)后在化学发光成像系统中分析实验结果。
1.2.7 数据处理
数据采用SPSS 21.0统计软件进行分析,每个实验结果均进行3次独立重复实验。用t检验比较两组数据之间的差异,P<0.05时有统计学意义。
2 结果
2.1 miR-365可抑制胃癌细胞的活力
为了探讨miR-365在胃癌细胞中的内源性表达水平,我们分别提取了GES-1、MGC80-3和AGS中的总miRNA,检测了3种细胞系中miR-365的相对表达水平,结果如图1A所示。与正常胃上皮细胞GES-1相比,胃癌细胞MGC80-3和AGS中的miR-365水平明显下调。随后,我们在胃癌细胞MGC80-3和AGS中转染不同浓度的miR-365 mimics或NC,结果显示,随着miR-365 mimics浓度的增加,细胞的活力明显下降,在40 μmol/L时AGS和MGC80-3的细胞活力与对照组相比分别下降50%和40%(图1B)。以上结果表明,在胃癌细胞中miR-365的表达量下调且miR-365可降低胃癌细胞的活力水平。
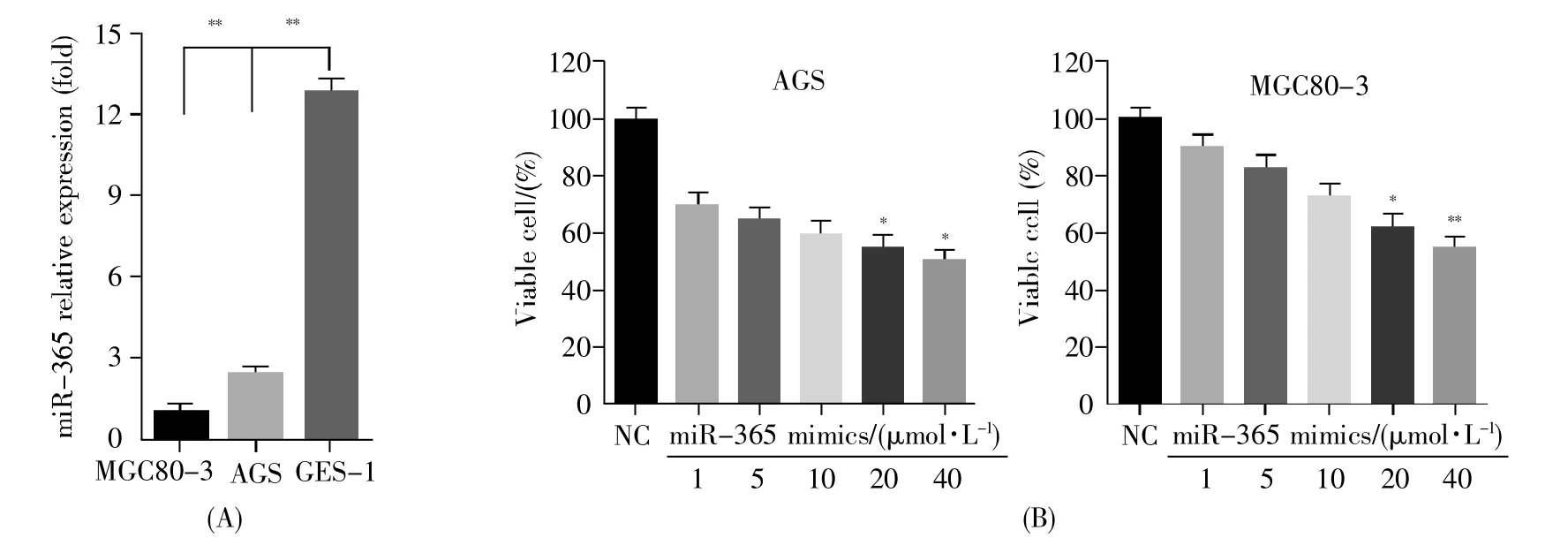
图1 miR-365在胃癌细胞系中的内源性表达及对胃癌细胞活力的影响(A)RT-qPCR检测GES-1、MGC80-3和AGS细胞系中miR-365的内源性表达;(B)胃癌细胞AGS和MGC80-3转染不同量miR-365 mimics后经CCK-8检测细胞的活力。*P<0.05,**P<0.01,图2~4类似。Fig.1 The endogenous expression of miR-365 in gastric cancer cell lines and its effect on the viability of gastric cancer cells(A)RT-qPCR detection of miR-365 endogenous expression in GES-1,MGC80-3 and AGS cell lines;(B)Gastric cancer cells AGS and MGC80-3 were transfected with different amounts of miR-365 mimics and the cell viability was tested by CCK-8.*P<0.05,**P<0.01,these are same in the following figures.
2.2 miR-365通过抑制细胞周期蛋白抑制胃癌细胞增殖
为了探究miR-365是否通过参与调控胃癌细胞周期而影响细胞活力,进而影响胃癌细胞的增殖,我们对转染 miR-365 mimics(20 μmol/L)的AGS细胞进行了细胞周期相关蛋白质的转录和翻译水平检测。RT-qPCR结果表明,AGS细胞过表达miR-365 mimics后与对照组相比细胞周期相关蛋白质CDK4、CDK6、cyclinD1的 mRNA水平明显下调(图2A);Western-blot结果表明,CDK4、CDK6、cyclinD1的蛋白质水平明显低于对照组(图2B)。由此我们得出,miR-365 mimics可以抑制胃癌细胞周期蛋白的表达,抑制胃癌细胞周期的进行,降低胃癌细胞活力,从而抑制胃癌细胞的增殖。
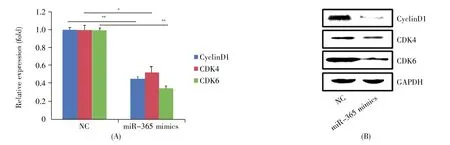
图2 在AGS细胞中miR-365抑制细胞周期蛋白的表达(A)RT-qPCR方法检测miR-365对CDK4、CDK6、cyclinD1 mRNA水平的影响;(B)Western-blot检测CDK4、CDK6、cyclinD1蛋白的表达。Fig.2 Inhibition of cyclin transcription and expression by miR-365 in AGS cells(A)Transfection of miR-365 mimics and control in AGS cells.RT-qPCR method was used to detect the effect of miR-365 on CDK4,CDK6 and cyclinD1 mRNA levels;(B)CDK4,CDK6 and cyclinD1 protein expression changes were detected by Western-blot.
2.3 miR-365通过靶向FoxO1 3′-UTR抑制FoxO1蛋白的表达
为了探讨miR-365抑制胃癌细胞增殖的分子机制,我们在TargetScanHuman 7.2网站(http://www.targetscan.org/cgi-bin/targetscan/vert_72/targetscan.cgi?species=Human&mir_sc=miR-365-3p)分析了miR-365的序列结构(图3A),发现miR-365可以靶向结合到FoxO1的3′-UTR。为了探究miR-365是否确实可以与FoxO1的3′-UTR靶向结合,我们构建了包含FoxO1 3′-UTR序列的野生型及突变型(miR-365与FoxO1 3′-UTR的结合位点突变)荧光素酶报告质粒(图3B,C),并在AGS细胞中将野生型或突变型荧光素酶报告质粒与miR-365 mimics(20 μmol/L)或 NC 共转染,荧光素酶报告实验结果显示,与对照组相比,miR-365能显著抑制野生型荧光素酶报告基因活性,但对突变型荧光素酶报告基因活性无明显影响(图3D)。与该结果类似,在转染miR-365 mimics(20 μmol/L)或NC的AGS细胞中,Western-blot结果表明,miR-365可显著抑制FoxO1蛋白的表达(图3E)。以上结果表明miR-365通过靶向FoxO1的3′-UTR抑制FoxO1蛋白的表达。
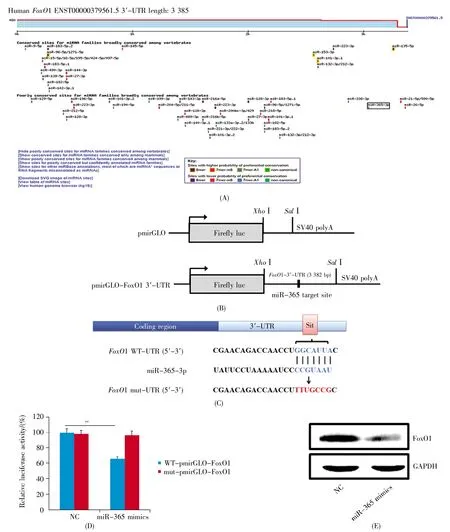
图3 miR-365通过靶向FoxO1的3′-UTR抑制FoxO1蛋白的表达(A)生物信息学分析预测miR-365可靶向结合FoxO1的3′-UTR;(B)荧光素酶报告质粒的结构示意图;(C)突变型FoxO1 3′-UTR荧光素酶报告质粒构建及碱基突变示意图;(D)在AGS细胞中将野生型或突变型荧光素酶报告质粒与miR-365 mimics或NC共转染,采用荧光素酶报告实验检测荧光活性;(E)在AGS细胞中转染miR-365 mimics或NC,采用Westernblot检测FoxO1蛋白表达水平。Fig.3 Inhibition of FoxO1 protein expression by miR-365 targeting FoxO1 3′-UTR(A)Prediction of miR-365 targeting 3′-UTR of FoxO1 by bioinformatics analysis;(B)Schematic diagram of the luciferase reporter plasmid;(C)The construction of mutant FoxO1 3′-UTR luciferase reporter plasmid and schematic diagram of base mutation;(D)Co-transfection of AGS cells by wild-type or mutant luciferase reporter plasmid with miR-365 mimics or NC.The fluorescence activity was detected through luciferase reporter experiment;(E)The cells were transfected with miR-365 mimics or NC,and the expression level of FoxO1 protein was detected by Western-blot in AGS.
2.4 临床样本中miR-365在胃癌组织中下调
为了进一步确认miR-365对胃癌细胞增殖的抑制作用,我们收集了11例临床胃癌样本及其对应的癌旁组织,并用RT-qPCR检测了其miR-365的表达。结果如图4所示,相较于癌旁组织,miR-365在癌组织中的表达明显下调,证实miR-365抑制胃癌细胞增殖。
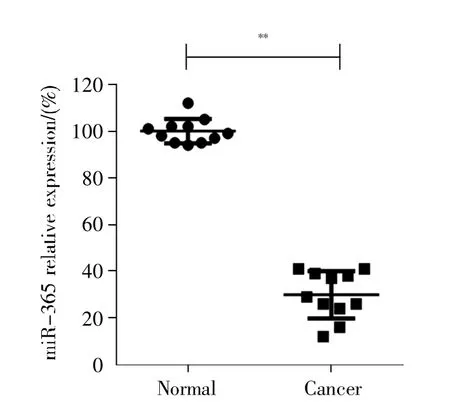
图4 临床样本中miR-365的表达RT-qPCR检测病人癌组织及癌旁组织中miR-365的表达。Fig.4 Expression of miR-365 in clinical samplesRT-qPCR detection of miR-365 expression in cancer and adjacent tissues.
3 讨论
miRNA表达失调已被证明会促进癌症的发展,包括乳腺癌[20]、消化道癌症[21]、黑色素瘤[22]等。miR-365位于染色体16p13.12,其表达模式和生物学作用与癌症类型相关。研究报道,miR-365在皮肤鳞状细胞癌[23~24]中高表达,而在乳腺癌[25]、结肠癌[26]、肺癌[27]和黑色素瘤[28]中下调,提示miR-365可能在特定的癌症类型中发挥促增殖或促凋亡作用。目前,miR-365在胃癌发展中的作用还知之甚少。已有的研究显示,miR-365-3p通过调节CDK4和CDK6抑制皮肤鳞状细胞癌的进展[29],同时,其也可通过靶向NRP(neuropilin)抑制恶性黑色素瘤的生长、增殖和转移[28]。另外,miR-365-3p在乳腺癌中通过靶向FOXK1调节细胞增殖、迁移和侵袭[30]。我们的研究发现,miR-365在胃癌细胞中表达下调,并抑制胃癌细胞的活力。
FoxO 家族蛋白(包括FoxO1、FoxO3a、FoxO4 和FoxO6)已被越来越多的研究认为是重要的蛋白质家族,可调节凋亡、细胞周期、自噬和DNA损伤修复等过程[31~32]。FoxO1是在胰岛素反应性组织(例如肝脏)中表达得最丰富的同工型,可以调节涉及凋亡、细胞周期、代谢、应激反应和分化的基因的表达[31~32]。许多研究关注其对细胞周期的调节作用。例如:PLK1(polo-like kinase 1)与FoxO1相互作用,使其磷酸化,从而消除其对细胞生存的抑制作用,促进G2/M周期进展[33];在增殖细胞中,FoxO1可被CDK1激活,从而影响PLK的表达[34]。根据这些发现,大量的研究提出调控FoxO1可以应用于癌症治疗。敲除FoxO1可抑制三苯氧胺对乳腺癌细胞的敏感性[35]。核激活的FoxO1被报道可以控制骨肉瘤细胞中下游周期阻滞基因的表达,p21和p27作为FoxO1的下游靶点,可引起细胞周期停滞在G1/S边界,从而抑制细胞增殖[36]。先前的研究报道,姜黄素作为FoxO1激活剂,可通过上调p27和p21以及下调cyclinD1来降低肺癌的增殖[37]。此外,哺乳动物雷帕霉素靶蛋白(mTOR)信号转导途径和胰岛素信号转导途径可能参与了FoxO1-p27(kip)信号转导轴,从而诱导细胞周期G0/G1阻滞[38]。我们的研究结果表明,miR-365可通过靶向结合FoxO1的3′-UTR抑制FoxO1的表达,进而影响胃癌细胞的增殖活力。
对于癌症的常规治疗,靶向细胞周期的化学疗法已经发展了数十年。细胞周期失调将导致细胞不受控制的增殖,同时允许细胞不受限制的复制和生长[39~40]。因此,靶向细胞周期并使得细胞复制受抑制可以阻止肿瘤形成[41]。在细胞周期运动中,细胞周期蛋白在触发和促进从G1期到S和G2/M期的细胞周期中起关键作用。据报道,cyclinD1可能参与不同的周期状态[42]。通常,cyclinD1或G1/S特异性cyclinD1通过结合并激活CDK4、CDK6的G1期特征来促进细胞增殖[43]。我们的研究表明,miR-365通过抑制细胞周期蛋白抑制胃癌细胞增殖,推测miR-365可通过靶向结合FoxO1的3′-UTR抑制FoxO1的表达,进而调控胃癌细胞的增殖。
4 结论
本研究表明miR-365在胃癌细胞中表达下调,可视为一种抑癌因子。其通过靶向FoxO1的3′-UTR抑制FoxO1的表达,进而抑制细胞周期相关蛋白质CDK4、CDK6和cyclinD1的表达,抑制胃癌细胞的增殖和活力。这一研究结果进一步证实FoxO1可以参与胃癌细胞周期的进行,并提示cyclinD1可能是一个潜在的抗肿瘤靶点。
