毛花猕猴桃LEAFY基因克隆及表达模式分析
2021-06-01刘现稳刘成龙张立群韦韩忠
刘现稳,朱 舟,刘成龙,张立群,韦韩忠,唐 维
(合肥工业大学 食品与生物工程学院,安徽 合肥 230601)
猕猴桃富含多种氨基酸、矿质元素,营养丰富、风味独特,被誉为“水果之王”[1]。猕猴桃大多属于雌雄异株植物,不同品种猕猴桃的开花时间变异较大。开花时间的差异对猕猴桃生产、猕猴桃属物种分化有着重要的影响。植物开花时期的差异一直是研究的热点。猕猴桃开花时间调控的分子机制依然模糊。因此深入研究猕猴桃开花相关基因的功能以及分子调控机制有重要的生物学意义。
对模式植物拟南芥开花时间的研究表明:春化作用、温度、赤霉素、自主途径、光周期途径相互作用共同控制开花[2]。在植物开花调控网络中,LEAFY(LFY)基因是开花信号途径中的最关键整合子,在花原基起始的早期表达,并激活花分生组织特征基因和花器官形态特征基因APETALA1(AP1)和CAULIFLOWER(CAL)的表达,从而决定了原基的花分生组织属性。LFY基因不仅是植物成花途径中的关键调控基因,而且是激活下游花分生组织属性基因和花器官决定基因的关键调控因子[3]。
LFY基因结构相对简单,在进化过程中比较保守,都含有3个外显子和2个内含子,且内含子的位置极为保守。LFY的同源基因编码的氨基酸序列中一般具有5’端脯氨酸富集区、中央酸性区和亮氨酸拉链结构域。拟南芥中LFY还含有与DNA结合的锌指结构域。这些结构表明LFY基因具有转录因子的特征[4]。在许多有花和无花植物中LFY同源基因已经被分离克隆,功能研究表明其在植物生殖、生长过程中发挥重要作用[5]。但是在猕猴桃中LFY同源基因的研究并不多。
本文以毛花猕猴桃‘华特’为实验材料,从花芽组织中提取总RNA,反转录成cDNA。将拟南芥LFY基因在‘红阳’猕猴桃基因组数据库[6-7](http://bioinfo.bti.cornell.edu/cgi-bin/kiwi/home.cgi)中进行比对,得到了猕猴桃的LFY基因同源序列,并以‘华特’猕猴桃cDNA为模板,用特异性引物扩增出目的基因,命名为AeLFY-like1。测序结果表明AeLFY-like1基因序列全长2 432 bp,有3个外显子与2个内含子,含有1 095 bp的完整的编码框,编码364个氨基酸。3个外显子长度分别为379、353、363 bp,2个内含子长度分别为420、917 bp。毛花猕猴桃LFY-like蛋白与中华猕猴桃LFY-like蛋白有99.73%同源性,仅有部分SNP的差异。其基因结构与许多已克隆的大部分植物的LFY基因结构相似,显示出LFY基因的序列结构在不同物种间进化上的保守性[8]。本研究通过克隆毛花猕猴桃LFY同源基因,为从分子水平上了解猕猴桃成花机理提供了理论基础,同时为猕猴桃的物种分化、进化研究提供序列信息。
1 材料与方法
1.1 实验材料
1.1.1 载体、菌株和植物材料
克隆载体pEASY-Blunt Simple Cloning Vector购于北京全式金生物技术有限公司;植物表达载体pART27-MCS-GFP(带有CaMV35S植物组成型启动子和GFP标签蛋白)由本实验室保存;大肠杆菌(Escherichiacoli)菌株DH5α购于北京全式金生物技术有限公司;根癌农杆菌(Agrobacteriumtumefaciens)菌株GV2260由实验室保存;烟草(Nicotianabenthamiana)、毛花猕猴桃(ActinidiaerianthaBenth.)植株种植于合肥工业大学屯溪路校区人工气候培养室。
1.1.2 实验试剂
Pfu高保真DNA聚合酶购于北京全式金生物技术有限公司;植物RNA提取试剂盒购于北京天根生化科技有限公司;质粒提取试剂盒、DNA产物纯化试剂盒、琼脂糖胶回收试剂盒购于北京全式金生物技术有限公司;反转录试剂盒购于爱必梦生物科技有限公司;实时荧光定量聚合酶链式反应(polymerase chain reaction,PCR)试剂盒购于北京康为世纪生物科技有限公司;限制性内切酶、T4连接酶购于TaKaRa公司;引物设计采用Primmer Premmier5.0软件,由上海英骏生物技术有限公司合成;实验样品送生工生物工程(上海)股份有限公司测序。其余试剂均为进口分装或国产分析纯。
1.2 实验方法
1.2.1 序列分析及氨基酸序列同源性分析
运用 NCBI的BLAST在线软件程序对测序结果进行检索;用NCBI数据库BLASTP在线比对、查找AeLFY蛋白序列的同源蛋白序列,并应用DNAMAN软件进行多序列同源性比对分析。用MEGA7.0软件构建系统进化树。
1.2.2 ‘华特’猕猴桃AeLFY-like1基因克隆
使用植物RNA提取试剂盒从‘华特’猕猴桃花芽材料中提取总RNA,取1 μg总RNA为模板,利用反转录试剂盒反转录获得cDNA。‘华特’AeLFY-like1基因序列特异性引物AeLFY-like1 F/R见表1所列,用于对其编码区进行PCR扩增,并分别引入EcoRⅠ和XhoⅠ酶切位点。
PCR产物经琼脂糖凝胶电泳、纯化,然后与pEASY-Blunt Simple Cloning Vector克隆载体连接,连接产物转化DH5α大肠杆菌感受态细胞。挑取单克隆培养后进行菌落PCR鉴定,将阳性克隆送测序。
1.2.3AeLFY-like1-GFP表达载体的构建
将上述测序阳性克隆提取质粒分别进行双酶切。酶切片断进行胶回收,然后与双酶切回收的pART27-MCS-GFP表达载体片断进行连接、大肠杆菌转化,并进行菌落PCR鉴定,质粒酶切鉴定后进行测序验证。提取质粒转化农杆菌GV2260,获得阳性克隆后,-80 ℃保存备用。
1.2.4 基因烟草瞬时表达与亚细胞定位
本文采用农杆菌介导的瞬时表达方法。将带有构建正确的AeLFY-like1-GFP表达载体的农杆菌在含有利福平(Rif)和壮观霉素(Spec)的LB培养板28 ℃培养2 d,挑取单克隆于2 mL LB/Rif/Spec培养液中,28 ℃,200 r/min过夜培养。吸取300 μL菌液于2.7 mL LB/Rif/Spec培养液中,28 ℃培养5 h。然后将菌液4 000 r/min离心6 min后重悬于3 mL诱导缓冲液Ⅰ(IM培养液、200 mmol/L乙酰丁香酮、25 mg/mL壮观霉素)中,28 ℃培养5~8 h。将菌液4 000 r/min离心6 min收集细胞,以2 mL诱导缓冲液Ⅱ(50 mmol/L 2-吗啉乙磺酸、蒸馏水、200 mmol/L乙酰丁香酮)重悬细胞,测定、调节OD600=0.5,注射于4周左右大小烟草植株的叶片中。36 h后即可撕取注射区域叶片的表皮细胞,经4’,6-二脒基-2-苯基吲哚(DAPI)染料染色后在激光共聚焦显微镜下观察,并确定AeLFY-like1蛋白在细胞中的定位。
1.2.5 实时荧光定量PCR
采集毛华猕猴桃根、茎、叶、成花、花芽材料,分别提取RNA,并反转录为cDNA。以cDNA为模板,猕猴桃肌动蛋白(actin)基因作为内参,进行实时荧光定量PCR分析。该反应在Bio-Rad实时荧光定量PCR仪上进行。实时荧光定量PCR总体系含cDNA 30 ng、SYBR ® Green PCR Master 5.0 μL、定量引物AeLFYqF/R各 0.2 μL,序列信息见表1所列,用 ddH2O补足到 10.0 μL。反应程序为 95 ℃ 10 min,95 ℃15 s,60 ℃ 1 min,39个循环。PCR扩增结束后分析荧光值变化曲线以及溶解曲线。
2 结果与分析
2.1 毛花猕猴桃LFY同源基因的克隆
使用毛花猕猴桃花芽组织材料提取总RNA,使用反转录试剂盒反转录得到cDNA。以cDNA为模板,使用特异性引物扩增得到猕猴桃LFY同源基因如图1所示,扩增条带约1 100 bp,实际测序结果显示AeLFY-like1基因为1 095 bp。电泳结果与目的片段大小一致。图1中,M为DNA Marker;L1为阴性对照;L2为目的片段。
2.2 毛花猕猴桃AeLFY-like1基因结构分析
AeLFY-like1基因序列全长2 432 bp,有3个外显子与2个内含子,含有1 095 bp的完整的编码框,编码364个氨基酸。基因结构如图2所示,3个外显子长度分别为379、353、363 bp,2个内含子长度分别为420、917 bp。
AeLFY-like1基因编码的氨基酸序列也具有5’端脯氨酸富集区、中央酸性区和亮氨酸拉链结构域,这些功能结构域与其转录因子功能相对应。猕猴桃LFY基因结构与大部分植物基因结构一致,显示出其在不同物种进化过程中的保守性。
2.3 AeLFY-like1基因的系统进化树分析
将AeLFY-like1基因编码的氨基酸序列与多种植物的LFY蛋白同源序列进行比对,运用MEGA7.0软件构建系统进化树,进化树信息如图3所示。图3中,Ae为毛花猕猴桃;Ac为中华猕猴桃;Cs为野茶树;Cc为山核桃;Ps为豌豆;Gs为野生大豆;Gm为大豆;Sl为番茄;Nt为烟草;Lc为荔枝;Pc为黄连木;Vv为葡萄;At为拟南芥;Os为水稻;Zm为玉米;分支点的数字为Bootstrap验证中基于1 000次重复该节点可信度的百分比;标尺代表每一位点氨基酸替换率。毛花猕猴桃和中华猕猴桃这2个猕猴桃品种的LFY同源蛋白序列以100%的支持率聚在同一枝上,表明在不同品种猕猴桃中,LFY基因高度保守。
猕猴桃科与茶科都属于五桠果亚纲、杜鹃花目。由图3可知,猕猴桃与茶树同源性为95%,而与单子叶植物植物水稻、玉米亲缘关系较远。该结果与传统分类学结果一致。在该系统进化树中,传统分类学上亲缘关系较近物种都聚集在一起。预测在分类学研究中,LFY蛋白是一个可以利用的分子标记。
2.4 AeLFY-like1基因组织差异性分析
采集毛花猕猴桃的根、茎、叶、成花和花芽组织作为样品材料,提取总RNA,以猕猴桃肌动蛋白(actin)基因作为内参,通过实时荧光定量PCR分析不同组织的AeLFY-like1基因的表达水平,如图4所示。
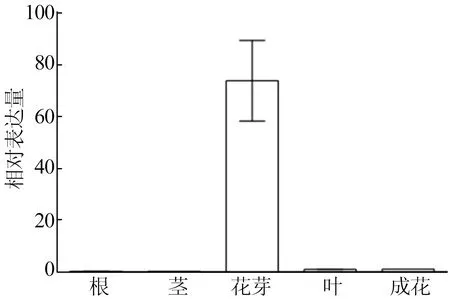
组织图4 AeLFY-like1基因在毛花猕猴桃不同组织和器官中的表达
由图4可知,qRT-PCR结果表明AeLFY-like1基因在毛花猕猴桃不同组织和器官中表达量有明显差异。AeLFY-like1基因主要在早期花芽组织中大量表达,而在成花中表达量很低,其表达量与叶片组织中相近。在根与茎中AeLFY-like1基因基本不表达。推测在花芽发育过程中,AeLFY-like1基因的表达量逐渐减少,在发育到成花阶段时,AeLFY-like1基因表达量已经下降到较低的水平。符合LFY同源基因在花原基起始的早期表达的特征。AeLFY-like1基因在促进猕猴桃由营养生长阶段转向生殖生长阶段、花序分化以及起始花器官发育发挥重要作用。
2.5 AeLFY-like1基因的亚细胞定位
本文将带有AeLFY-like1-GFP表达载体的农杆菌经扩大培养、诱导后注射烟草叶片,36 h后撕取烟草叶片表皮细胞,经DAPI染料染色、制片,在激光共聚焦显微镜下观察,检测GFP与DAPI荧光信号,进行AeLFY-like1基因的亚细胞定位,其结果如图5所示。图5a为明场下观察到的烟草表皮细胞的细胞结构;图5b为488 nm激发波长下GFP发射出的绿色荧光;图5c为358 nm激发波长下DAPI发射出的蓝色荧光;图5d为Merge图像,可以观察到绿色荧光与蓝色荧光的重叠。

图5 AeLFY-like1基因亚细胞定位
从图5可以看出,AeLFY-GFP融合蛋白定位在细胞核中,推测出AeLFY蛋白可作为转录因子在细胞核中调控相关基因的表达进而促进植物开花。
3 结 论
本研究通过同源序列比对分析从毛花猕猴桃‘华特’基因组中克隆出LFY同源基因,命名为AeLFY-like1。基因序列全长为2 432 bp,有3个外显子和2个内含子,含有1 095 bp的完整的编码框,编码364个氨基酸,与中华猕猴桃LFY蛋白同源性达到99.73%。同源性分析表明毛花猕猴桃的AeLFY-like1基因与其他植物LFY基因在核酸和蛋白质水平上十分相似,在N端和C端都含有高度保守的区域。进化树分析发现猕猴桃LFY基因与茶科植物亲缘关系最近,与单子叶植物水稻、玉米等亲缘关系较远。但亲缘关系较远物种间LFY基因编码的蛋白质也具有较高的同源性,表明其在不同物种中具有相似的结构和功能[9]。
亚细胞定位显示AeLFY-like1表达产物定位在细胞核,与LFY基因家族的转录因子功能、亚细胞定位特征相一致。推测其在猕猴桃开花调控中发挥转录因子的功能,调控开花调控网络中相关基因的表达,进而促进猕猴桃植株开花。
组织差异性分析表明AeLFY-like1基因在花芽组织中的表达量最高。LFY基因家族在花原基起始早期表达,是植物开花调控网络中的早期基因。AeLFY-like1基因在促进猕猴桃由营养生长阶段转向生殖生长阶段、花序分化以及起始花器官发育发挥重要作用[10-11]。猕猴桃AeLFY-like1基因诱导植物成花过程以及调控植物开花时间的分子机理还需要进一步的实验。
本研究通过克隆毛花猕猴桃的LFY同源基因,分析了基因特征与同源性关系,初步鉴定了基因的功能,为猕猴桃的系统进化研究、发育分析提供了一定的理论依据。
