乳铁蛋白对去卵巢大鼠骨组织中IGF-Ⅰ、IGFBP-3、IGFBP-5表达的影响
2021-05-31巫晓强林庆明侯建明
陈 壹, 巫晓强, 林庆明, 侯建明
骨质疏松是一种因骨吸收和骨形成解耦连,出现骨密度降低、骨微结构破坏的全身代谢性骨病。 绝经后妇女因雌激素水平下降,破骨细胞的活性明显高于成骨细胞,逐渐出现骨质疏松。雌二醇或二磷酸盐的替代疗法可使因绝经导致骨质疏松患者的骨量增加,但这些药物存在增加妇科恶性肿瘤概率等副作用。乳铁蛋白(lactoferrin,LF)是一种由上皮细胞及外分泌腺分泌、相对分子质量为80 kDa的铁结合糖蛋白,不仅具有潜在的免疫调节功能,还能通过抑制破骨细胞形成,促进成骨细胞增殖、分化而增加骨量[1]。但LF通过何种分子机制促进骨形成值得探究。胰岛素样生长因子Ⅰ(insulin-like growth factor-Ⅰ,IGF-Ⅰ)是一种能够促进骨组织代谢及生长的细胞因子[2],同时,IGFBPs (insulin-like growth factor binding proteins)可以通过阻止或易化IGF-Ⅰ与目标细胞表面IGF-Ⅰ受体(insulin-like growth factor-I receptor,IGF-ⅠR)的结合而影响骨形成[3]。体外研究表明,LF不仅促进IGF-Ⅰ/IGF-ⅠR mRNA的表达[4],还可通过促IGF-Ⅰ mRNA的表达阻止原代成骨细胞凋亡[5]。本研究拟探讨口服LF 6个月后对去卵巢大鼠骨量及骨组织中IGF-Ⅰ、IGFBP-3、IGFBP-5 mRNA表达的影响。
1 材料与方法
1.1材料
1.1.1动物 70只6个月龄健康雌性SD(Sprague-Dawley)大鼠,体质量(250±20) g [福建医科大学实验动物中心,动物批号:SCXK(闽)2012-0001]。
1.1.2主要试剂 97% LF(批号:BN002865,产于新西兰,南京天淳公司);牛血清白蛋白(美国Sigma公司);苯甲酸雌二醇(杭州动物制药厂);TRIzol RNA 提取试剂盒(美国 Invitrogen 公司);SYBR Premix Ex TaqTMⅡ试剂盒(日本 TaKaRa 公司);DEPC水(美国 Biosharp 公司)。
1.2方法
1.2.1建模和分组 SD大鼠在室温(20±3)℃、相对湿度为40%~60%的环境中分笼饲养,自由饮水,喂以经高压处理的普通饲料。适应性喂养 1 周后,随机分为 7 组:假手术组和去卵巢模型及其干预组 6 组,每亚组 10 只。所有大鼠均予腹腔注射10%水合氯醛0.3 mL/100 g,假手术组仅切除卵巢附近与之等质量的脂肪组织;干预组作背部脊柱两侧切口,摘除双侧卵巢。术后1周依不同干预措施分组:
1.2.1.1骨质疏松模型组(Con组) 2 mL蒸馏水每天灌胃1次。
1.2.1.2假手术组(Sham组) 2 mL蒸馏水每天灌胃1次。
1.2.1.3骨质疏松模型雌激素干预组(E2组) 苯甲酸雌二醇0.1 mg/kg每周肌内注射1次。
1.2.1.4骨质疏松模型牛血清白蛋白组(bovine serum albumin,BSA组) 将100 mg/kg的BSA溶解于2 mL蒸馏水,每天灌胃1次。
1.2.1.5不同剂量的骨质疏松模型LF1~LF3组 分别将100,1 000,2 000 mg/kg的LF溶解于2 mL蒸馏水,每天灌胃1次。
每周称体质量1次,根据体质量变化调整药品用量,每千克体质量药量浓度不变。持续称量6个月。
1.2.2标本采集与脱钙 干预 6个月后处死动物,分离大鼠的股骨和胫骨。收集各组大鼠的右侧股骨,-80 ℃冷冻。将左侧胫骨置于4%多聚甲醛中,24 h 后放入10%EDTA脱钙液中,根据脱钙程度置换脱钙液直至脱钙终点。切取干骺端的骨组织。
1.2.3苏木精-伊红(H-E)染色及图像分析 将脱钙后的骨组织用不同浓度的乙醇脱水,再用二甲苯作透明处理,石蜡包埋。将蜡块固定在切片机上,截取距胫骨骺线约 0.2 mm位置干骺端的薄片,厚度 5~8 μm。切片脱蜡、水合,经H-E染色后,光学显微镜下拍摄截面图。采用Image-Pro Plus 6.0软件计算骨小梁平均面积所占骨髓腔比例(比值)。
1.2.4实时荧光定量聚合酶链式反应(Real-time PCR,RT-PCR) 采用TRIzol试剂分离股骨近端骨组织总RNA。检测该样品在波长260和280 nm处的OD值(ND-1000紫外分光光度计,OD比1.8~2.0),计算骨组织RNA的浓度。再用逆转录试剂盒将 5 mg 总RNA逆转录成cDNA。实时荧光定量PCR反应(96孔板,反应体系25 μL),其中包括SYBR Premix Ex TaqTMⅡ试剂盒、cDNA及目标基因引物(引物序列见表1)。在Thermal Cycler DiceTMReal Time系统中行RT-PCR检测。所有反应重复3次,β-actin作为内参,设定正常对照组目的基因mRNA相对表达量为1,应用2-△△Ct法计算:

表1 qRT-PCR引物序列Tab.1 The primer sequences for quantitative real-time PCR
(1)△Ct对照样品=目的基因(meanCt)-管家基因(meanCt)
△Ct待测样品=目的基因(meanCt)-管家基因(meanCt)
(2)对照样品及待测样品的归一列式:
△△Ct=△Ct待测样品—△Ct对照样品均值
(3)mRNA表达相对量=2-△△Ct

2 结 果
2.1体质量比较 干预前各组体质量比较,差别无统计学意义(均P>0.05,表2)。干预结束后,除Sham和E2组外,其他组的大鼠体质量均明显增加,其中Con组较Sham组和E2组显著增加(均P<0.01)。BSA和LF1~LF3组的体质量均低于Con组,差别无统计学意义(均P>0.05,表2)。在雌激素的作用下,E2组未出现因切除卵巢引起的体质量增加。

表2 干预 6个月前后各组体质量变化Tab.2 The body weights among the seven groups before and after 6 months of treatment
2.2骨组织H-E染色病理切片及图像分析 E2和Sham组的骨小梁密度较其他各组致密;Con组和BSA组不如LF1~LF3组致密。同时,肉眼无法分辨LF1~LF3组间的骨小梁密度差别(图1)。Image-Pro Plus 6.0分析数据表明,E2和Sham组的比值显著高于Con、BSA及LF1~LF3组(均P<0.01,图2)。与LF1~LF3组比较,Con和BSA组的比值明显降低(均P<0.01,图2)。Sham与E2组、Con与BSA组、LF1~LF3组各组间比值比较,差别均无统计学意义(P>0.05,图2)。
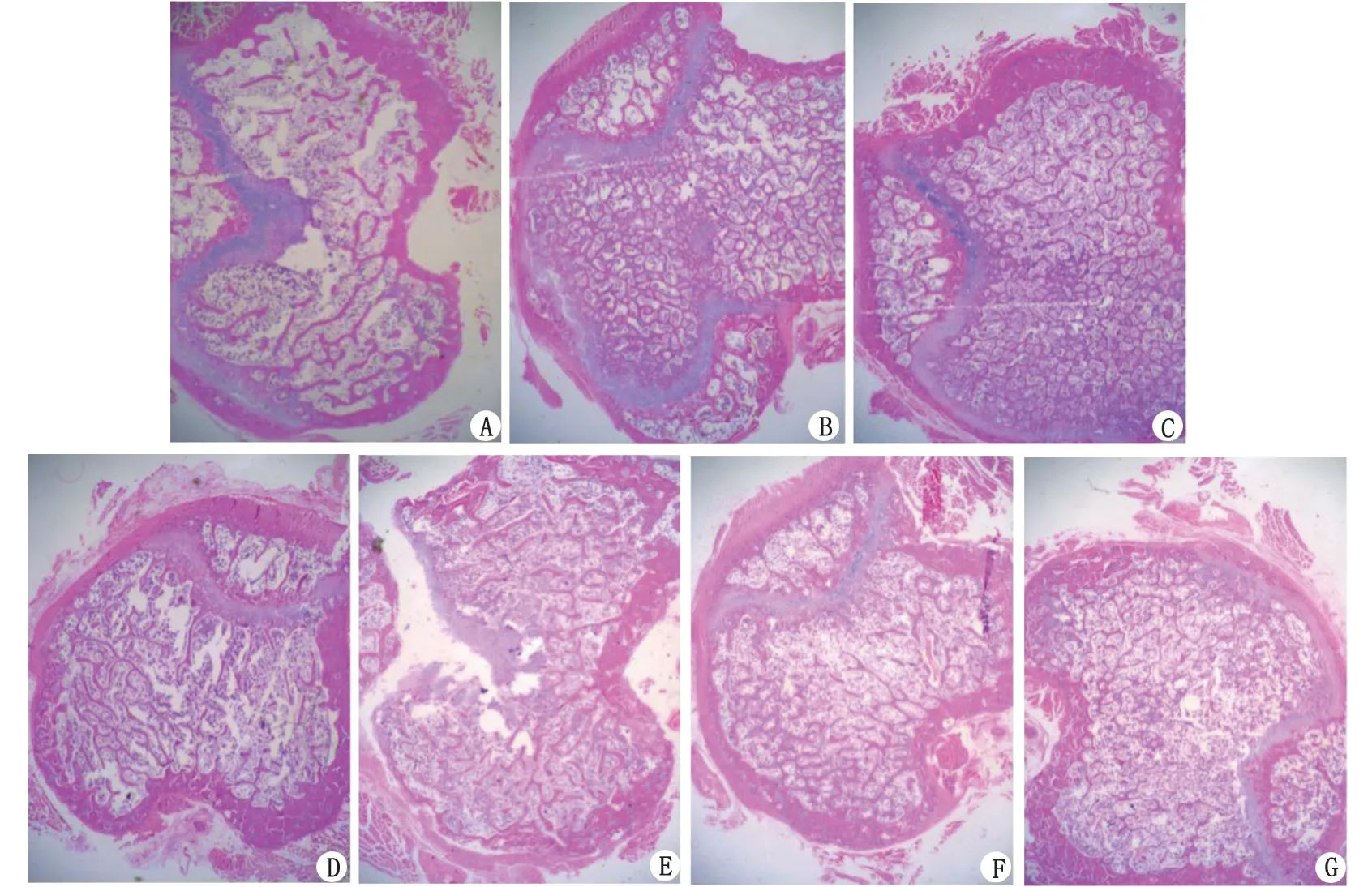
LF:乳铁蛋白。A:Con 模型组;B:Sham 假手术组;C:E2 雌激素组;D:牛血清白蛋白100 mg/(kg·d)组;E~G:LF 100, 1 000, 2 000 mg/(kg·d)组。图1 胫骨干骺端病理组织切片(H-E染色 ×40)Fig.1 Hematoxylin and eosin-stained section of metaphysis under the tibia(H-E ×40)

表中数据为模型组;Sham:假手术组;E2:雌激素组;BSA:牛血清白蛋白100 mg/(kg·d);LF1:乳铁蛋白100 mg/(kg·d);LF2:乳铁蛋白1 000 mg/(kg·d);LF3:乳铁蛋白2 000 mg/(kg·d);与Con组比较,●:P<0.01;与Sham组比较,△:P<0.01。图2 干预6个月后各组骨小梁平均面积所占骨髓腔比例Fig.2 The area ratio of trabecular area by marrow cavity
2.3股骨IGF-Ⅰ、IGFBP-3和IGFBP-5 mRNA的表达情况 干预 6个月后,Sham、E2、LF1~LF3组中的IGF-Ⅰ mRNA水平较Con组明显升高(均P<0.01,图3A)。与E2和Sham组比较,Con组的IGFBP-3 mRNA表达水平显著降低(P<0.01,图3B),而LF1~LF3组中IGFBP-3 mRNA水平均明显低于Con组(均P<0.01,图3B)。此外,E2和Sham组的IGFBP-5 mRNA水平显著升高(均P<0.01,图3C)。虽然不同LF组的IGFBP-5 mRNA水平均高于Con组,但仅LF2~LF3组的IGFBP-5 mRNA水平升高有统计学意义(P<0.05和P<0.01,图3C)。
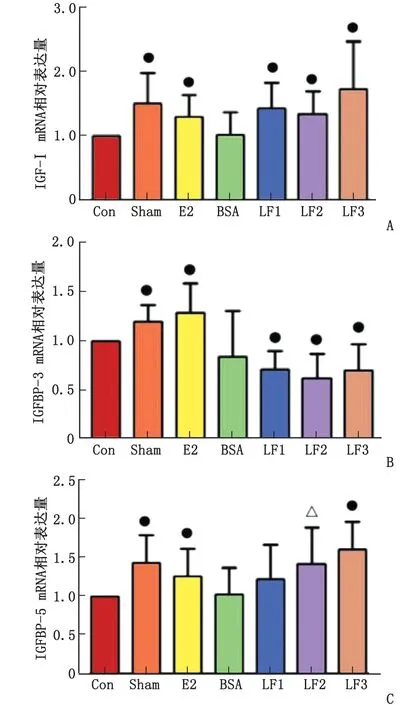
表中数据为胰岛素样生长因子;IGFBP:胰岛素样生长因子结合蛋白。Con:模型组;Sham:假手术组;E2:雌激素组;BSA:牛血清白蛋白100 mg/(kg·d);LF1:乳铁蛋白100 mg/(kg·d);LF2:乳铁蛋白1 000 mg/(kg·d);LF3:乳铁蛋白2 000 mg/(kg·d)。A:IGF-Ⅰ mRNA; B:IGFBP-3 mRNA; C:IGFBP-5 mRNA。与Con组比较,●:P<0.01,△:P<0.05。图3 干预6个月后各组IGF-Ⅰ, IGFBP-3及IGFBP-5 mRNA相对表达量Fig.3 The local expression of IGF-Ⅰ, IGFBP-3 and IGFBP-5 mRNA after 6 months of treatment
3 讨 论
骨质疏松是以骨吸收大于骨形成而出现骨密度降低、骨微结构破坏的慢性全身代谢性骨病。研究表明,LF可通过抑制骨吸收,促进骨形成而减少骨丢失[4]。本研究使用不同剂量的LF干预去卵巢后骨质疏松模型大鼠,观察其对骨量变化的影响及其可能的分子生物学机制。
LF在体外能够刺激成骨细胞的增殖和分化,8.5和85.0 mg/kg浓度的干预条件下,LF可增加骨的机械强度和骨密度[6]。有研究表明,口服LF促骨形成作用是通过调整骨微结构而实现[7]。与对照组比较,LF干预组的骨小梁数目增多,腰椎和股骨的骨体积增大,骨小梁厚度增加,骨密度增高。LF浓度为1 000和2 000 mg/(kg·d)条件下,骨质疏松模型大鼠骨密度显著增加。Cheng等[8]发现,LF可以通过刺激成骨细胞增殖而增加骨量,却对破骨细胞活性无明显影响,即该作用并非通过抑制骨吸收而实现。本研究在光镜下观察胫骨干骺端横截面发现,LF1~LF3组骨小梁密度较Con组致密,但不如E2组和Sham组显著。采用Image-Pro Plus 6.0分析各组骨小梁面积占骨髓腔比例可见,E2、Sham和LF1~LF3组的比值均显著高于Con组,但LF1~LF3组均不及Sham组和E2组明显,推测LF增加骨量的作用虽不如雌激素明显,但也可在一定程度上抑制骨吸收、促进骨形成。
IGF系统包括IGFs (IGF-Ⅰ和IGF-Ⅱ)、IGFs受体和IGFBPs。Cornish等[9]的研究发现,IGF-Ⅰ是保持骨骼稳态至关重要的细胞因子,它可通过与成骨细胞的IGF-ⅠR结合,从而激活p42/44 MAPK和PI3K介导的信号通路,最终促进成骨细胞的增殖和分化。有研究表明,口服LF对骨吸收标志物的抑制作用可能通过上调IGF-Ⅰ mRNA实现,减少因去卵巢引起的骨量丢失[4]。体外实验中,LF可通过IGF-Ⅰ/IGF-ⅠR通路刺激成骨细胞增殖及骨形成;同时,LF可通过上调IGF-Ⅰ的表达发挥抑制成骨细胞凋亡的作用[4-5]。在以老年骨质疏松模型(SAMP6小鼠)和衰老成骨细胞为对象的研究中,LF可促进碱性磷酸酶、IGF-Ⅰ等成骨细胞标志物表达而促进成骨细胞增殖,并通过降低p16和p21延缓衰老,起到抗氧化应激作用[10]。
本研究中,与Con组比较,LF1~LF3组IGF-Ⅰ mRNA的表达显著升高。Sjogren等[11]发现,由肝脏分泌的IGF-Ⅰ减少导致的骨量损失非常小,而循环中的IGF-Ⅰ水平降低导致的骨量减少所占比例却高达75%。Gao等[12]发现,局部应用LF可促进大鼠颅骨缺损模型的骨再生。Govoni[13]选择性基因敲除小鼠目标组织周围IGF-Ⅰ,使其表达量降低而导致骨量下降。在该研究中,骨组织和肝脏组织周围IGF-Ⅰ减少均可出现骨密度和骨小梁体积下降,前者较后者更为明显。而Zhao等[14]发现,过表达IGF-Ⅰ在不改变成骨细胞数量的情况下可增加松质骨量。以上研究均表明,循环或骨组织周围IGF-Ⅰ的增加导致促骨形成,较其他组织释放过多的IGF-Ⅰ促骨形成作用更为明显。
不论在细胞培养液中还是在体内,IGFs都结合其调节蛋白并以无活性的复合物形式存在。目前已发现6种IGFBP(IGFBP-1,IGFBP-2,IGFBP-3,IGFBP-4,IGFBP-5,IGFBP-6)。IGFBP-1,IGFBP-2,IGFBP-4及IGFBP-6通过与IGF结合形成具有抑制作用的二级复合物(IGFs-IGFBPs),该复合物能够穿过血管内皮细胞,并能被特定的蛋白酶水解,最终在循环中更容易被降解;而IGFBP-3和IGFBP-5主要通过与IGF-Ⅰ形成三级复合体而发挥作用。因此,复合体难以通过血管内皮细胞而聚集在组织周围。此时,IGFBP-5或IGFBP-3通过与细胞表面和细胞外基质结合而降低与IGF的亲和力,从而使IGF受体附近IGF的局部浓度增加[6]。IGFBP-3和IGFBP-5也具有独立于IGFs的作用:IGFBP-5可通过与细胞核或细胞膜表面IGFBP-5特异性受体结合而独立于IGF-Ⅰ发挥促进骨形成作用,这种现象并非需要通过增加血清IGF-Ⅰ水平而实现[15]。在体外实验中,IGFBP-5是唯一一种可持续刺激成骨细胞增殖的IGF结合蛋白[16]。本研究中,虽然不同LF组的IGFBP-5 mRNA水平均高于Con组,但这些升高仅在LF2~LF3组有统计学意义(P<0.05和P<0.01),提示LF可能通过促进IGFBP-5 mRNA表达而增加骨量。与E2组和Sham组比较,Con组的IGFBP-3 mRNA水平显著降低(P<0.01),而LF1~LF3组中IGFBP-3 mRNA表达水平更低(P<0.01)。Silha等[17]的研究提示,过表达IGFBP-3可增加破骨细胞的数量而促进骨吸收、抑制骨形成。Baumrucker等[18]的研究表明,在细胞外的LF可使IGFs与IGFBP-3的结合解离,并与IGF-Ⅱ竞争性地结合IGFBP-3,而不结合IGFBP-5。这也许能解释在LF干预后IGFBP-3 mRNA表达下调的原因,并提示LF增加骨量的作用可能是通过抑制IGFBP-3 mRNA表达水平而实现。
雌激素可通过影响体内的某些激素水平和进食量来控制体质量,并增加脂肪中瘦素的表达而抑制脂肪细胞的形成[19]。本研究中,E2及Sham组体质量的增量远小于其他组,说明雌激素可控制因去卵巢所致的体质量增加。雌激素作为防治绝经后骨质疏松的药物已应用于临床多年。虽然LF能增加骨组织IGF-Ⅰ mRNA的表达,并可能减少因长期使用雌激素而出现的副作用,却无法控制大鼠去卵巢后体质量的增加。
综上所述,LF可在一定程度减少去卵巢大鼠骨丢失,促进股骨IGF-Ⅰ和IGFBP-5 mRNA的表达,抑制IGFBP-3 mRNA的表达,这也许能作为LF治疗骨质疏松的一个重要因素。如果能进一步研究在LF干预下IGF-Ⅰ、IGFBP-3和IGFBP-5调控骨量的下游信号通路之间的关系,将给临床提供更多治疗骨质疏松的思路。
