乙型肝炎病毒通过抑制AGE-Rs表达促进AGEs诱导的肝癌细胞增殖
2021-05-31王标,陈艳
王 标, 陈 艳
肝细胞癌(hepatocellular carcinoma, HCC)是人类最常见的恶性肿瘤之一,死亡率位列癌症的第2位[1]。目前,乙型肝炎病毒(hepatitis B virus, HBV)慢性感染是HCC最主要的危险因素,占病例总数的50%以上[2]。晚期糖基化终产物(advanced glycation end products,AGEs)是蛋白质、脂肪和核酸与还原糖发生非酶促糖基化反应(Maillard反应)形成的不可逆的终产物[3]。糖尿病患者体内血糖水平高,AGEs病理性增加,从而参与了多种糖尿病并发症的发生发展过程,例如糖尿病肾病、冠状动脉粥样硬化性心脏病(冠心病)、高血压病、阿尔茨海默症等[4]。由于肝脏是代谢、降解、清除AGEs的重要器官[5],越来越多的研究关注AGEs与HCC之间的联系[6-8]。AGEs主要通过与相应的受体(AGE-Rs)结合发挥其生物学功能。目前已发现的AGE-Rs包括AGE受体(receptor for advanced glycation end products,RAGE)、低聚糖转移酶-48(OST-48, AGE-R1)、80K-H磷酸蛋白(AGE-R2)、β-半乳糖凝集素-3(galectin-3, AGE-R3)以及清道夫受体B类Ⅰ型(MSR-BI, CD36)和A类Ⅱ型(MSR-AⅡ)等[9],其中AGEs与RAGE结合诱导胞内活性氧压力升高,导致炎症反应、血管新生和细胞增殖等;与AGE-R1、AGE-R2或AGE-R3结合形成复合物,负责AGEs的脱毒和清除[10]。研究发现,AGE-Rs具有拮抗AGEs-RAGE的作用[9,11-14]。本研究旨在探讨HBV对AGE-Rs表达及AGEs诱导的HCC细胞增殖的影响,为探讨HBV通过影响AGEs的作用从而促进HCC的可能性提供线索,以期进一步拓展HBV感染引发HCC的致病机制。
1 材料与方法
1.1材料
1.1.1质粒和细胞株 重组质粒pRep-1.2HBV为将1.2倍B基因型HBV的基因组克隆于表达载体pRep10(美国Invitrogen公司)上所得,其对照质粒pRepSal为表达载体pRep10去除表达盒后改造而成[15];HCC细胞株HepG2和HepG2.2.15由本实验室保存,HepG2.2.15 为携带有HBV基因组的肝癌细胞株。
1.1.2主要试剂 DMEM高糖培养基、胰酶、抗生素G418和Puromycin(美国Gibco公司);胎牛血清(德国PAN公司);转染试剂Lipofectamine 3000(美国Thermo Fisher公司);TRIzol(美国Invitrogen公司);逆转录试剂盒PrimeScriptTMRT reagent Kit、TB Green®Premix Ex TaqTM试剂和高保真PrimeSTAR®HS DNA Polymerase(日本TaKaRa公司);引物(福州铂尚生物技术有限公司);质粒抽提试剂盒(德国Qiagen公司);anti-AGE-R1抗体和anti-AGE-R3抗体(武汉三鹰生物技术有限公司);anti-β-actin抗体和兔二抗(美国Cell Signaling公司);Western及IP细胞裂解液和BCA蛋白浓度测定试剂盒(中国碧云天生物技术公司);CCK-8检测试剂(日本同仁化学研究所)。
1.2方法
1.2.1细胞培养和细胞转染 HCC细胞株HepG2和HepG2.2.15用DMEM高糖培养液(含10%胎牛血清)培养于37 ℃的CO2细胞培养箱。HepG2.2.15的培养液中需添加抗生素G418(380 μg/mL)。HepG2和HepG2.2.15细胞以每孔2.5×106个细胞数接种于6 cm的细胞培养皿,24 h后收获细胞。细胞转染的前1天,HepG2细胞以每孔6×105个细胞数接种于35 mm的6孔细胞培养皿中,20 h后用转染试剂Lipofectamine 3000进行转染,pRepSal、pRep-1.2HBV转染量为每孔3 μg,转染后48 h收获细胞。
1.2.2实时荧光定量PCR 使用TRIzol试剂提取RNA,随后使用逆转录试剂盒PrimeScriptTMRT reagent Kit获取cDNA,具体步骤参照试剂盒说明书。利用获得的cDNA和TB Green®Premix Ex TaqTM试剂进行实时荧光定量PCR,每个样本每种基因做3个复孔,引物序列见表1。
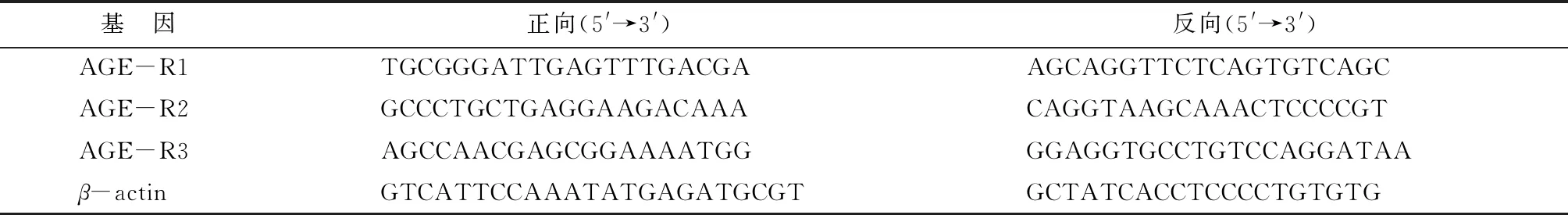
表1 实时荧光定量PCR引物序列Tab.1 Primer sequences for Real-time PCR
1.2.3蛋白质免疫印迹法(Western-blot) 采用Western及IP细胞裂解液提取细胞总蛋白,采用BCA法测定总蛋白浓度后进行Western-blot实验,以anti-AGE-R1、anti-AGE-R3和anti-β-actin抗体检测目标蛋白表达。扫描蛋白条带的灰度值,以β-actin为内参进行标准化,实验重复3次,取平均值作图进行分析。
1.2.4CCK-8法检测细胞增殖 HepG2和HepG2.2.15细胞以每孔5×103个细胞数接种于96孔板,以含AGEs(100 μg/mL)和葡萄糖(5.6 mmol/L)的DMEM培养液培养细胞,每组设置5个复孔,连续检测7 d。检测时,去除原培养液,每孔加入90 μL无血清DMEM培养液和10 μL CCK-8孵育1 h,在酶标仪上以450 nm波长测定每孔光密度(OD)值。将第1天的OD值定为1,以天数为横坐标绘制增殖曲线。

2 结 果
2.1HepG2和HepG2.2.15细胞中AGE-Rs的mRNA表达水平 实时荧光定量PCR结果显示,与HepG2细胞比较,HepG2.2.15细胞中AGE-R1和AGE-R3的mRNA表达水平均显著下降(P<0.05),而AGE-R2的mRNA表达水平则无明显变化(图1)。

AGE:晚期糖基化终产物。与对照组比较,△:P<0.05。图1 实时荧光定量PCR检测HepG2和HepG2.2.15细胞中AGE-Rs mRNA表达Fig.1 The mRNA expression levels of AGEs-Rs in HepG2 and HepG2.2.15 detected by Real-time PCR
2.2过表达1.2 HBV对AGE-Rs mRNA表达水平的影响 HepG2细胞瞬时转染重组质粒pRep-1.2HBV及其对照质粒pPepSal后,进行实时荧光定量PCR实验,结果显示,与pRepSal转染组比较,转染pRep-1.2 HBV的HepG2细胞中AGE-R1和AGE-R3的mRNA表达水平均降低(P<0.05),而AGE-R2的mRNA表达水平则无明显变化(图2)。
2.3HepG2和HepG2.2.15细胞中AGE-Rs蛋白表达水平 提取HepG2和HepG2.2.15细胞的总蛋白进行Western-blot实验,结果显示,与HepG2细胞比较,HepG2.2.15细胞中AGE-R1和AGE-R3的蛋白表达水平均明显下降,差别具有统计学意义(P<0.05,图3)。

AGE:晚期糖基化终产物。与对照组比较,△:P<0.05。图3 Western-blot检测HepG2和HepG2.2.15细胞中AGE-R1和AGE-R3蛋白表达Fig.3 The protein expression levels of AGEs-R1 and AGE-R3 in HepG2 and HepG2.2.15 detected by Western-blot
2.4过表达1.2 HBV对AGE-Rs蛋白表达水平的影响 HepG2细胞瞬时转染重组质粒pRep-1.2HBV及其对照质粒pRepSal,48 h后提取总蛋白进行Western-blot检测,结果显示,与对照组比较,转染1.2倍HBV基因组的细胞中,AGE-R1 和AGE-R3的蛋白表达水平均显著下降,差别具有统计学意义(P<0.05,图4)。
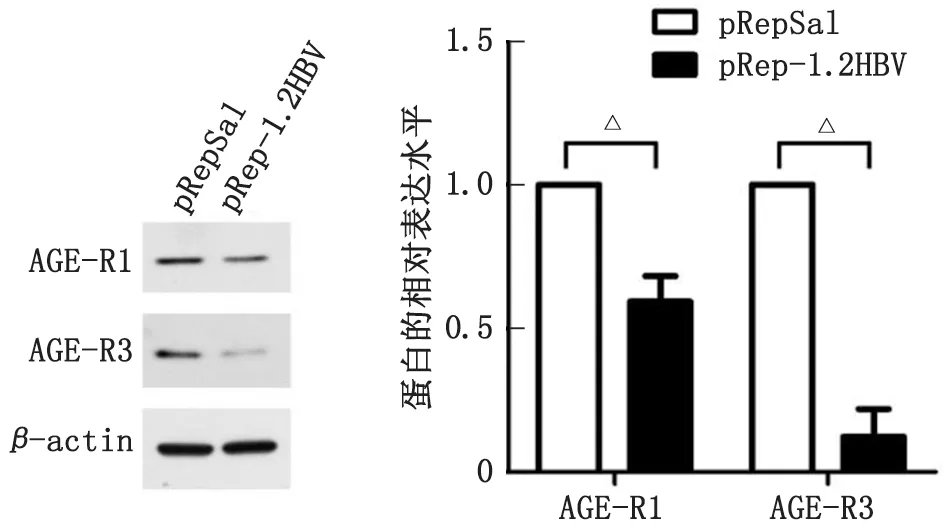
AGE:晚期糖基化终产物。与对照转染组比较,△:P<0.05。图4 瞬时转染HBV对AGE-R1和AGE-R3蛋白表达的影响Fig.4 The influence of transient transfection of HBV on protein expression of AGEs-R1 and AGE-R3
2.5HBV促进AGEs诱导的HCC细胞增殖 为验证HBV是否通过抑制AGE-R1和AGE-R3表达促进AGEs诱导的HCC细胞HepG2增殖,以100 μg/mL的AGEs诱导HCC细胞HepG2和HepG2.2.15,并采用CCK-8法检测细胞的增殖情况。结果显示,从第4天起,在AGEs诱导下,HepG2.2.15细胞的增殖明显高于HepG2细胞,差别具有统计学意义(P<0.05,图5),说明HBV可促进AGEs诱导的HCC细胞增殖。

AGE:晚期糖基化终产物。与HepG2 AGEs对照组比较,△:P<0.05。图5 HBV对AGEs诱导肝癌细胞增殖的影响Fig.5 The influence of HBV on the proliferation of hepatoma cells induced by AGEs
3 讨 论
HBV感染是严重威胁人们健康的公共卫生问题。全球近30%人口曾感染过HBV,目前慢性乙肝患者已超过3.5亿人,且每年约有78万人死于HBV相关性疾病[16]。在慢性乙肝患者中,25%的患者将逐渐发展为肝纤维化、肝硬化及HCC而危及生命[17]。HBV感染是HCC的关键致病因素,因此,深入研究HBV的致癌机制,可为HCC的预防和治疗提供有力的理论依据。
AGEs的形成是一个缓慢的过程。最初大分子物质的氨基与糖分子的醛基发生反应,形成可逆的Schiff碱,随后Schiff碱经过一系列分子重排形成酮氨类化合物,再进一步脱水和凝聚,最终形成不可逆的终产物[18]。AGEs包括外源性和内源性2种。外源性AGEs主要从外界摄入,包括吸烟或进食某些食物;内源性AGEs主要由机体自身合成,在正常个体中,内源性AGEs会随年龄的增长缓慢形成,而高血糖则大大加快这一过程,因此,糖尿病患者体内AGEs含量较正常人群显著增高。AGEs含量增多是糖尿病患者的重要病理特征,是多种糖尿病并发症发生的关键致病因子。肝脏是代谢和清除AGEs的重要器官,AGEs可作用于肝脏引发各种肝脏疾病,包括HCC、非酒精性脂肪性肝病和肝硬化[5]。Chen等[6-7]的研究发现,AGEs通过诱导ROS增高,促进碳水化合物反应元件结合蛋白(carbohydrate response element binding protein, ChREBP)的表达和HCC细胞的增殖。Takino等[8]指出,AGEs可提高血管内皮生长因子(vascular endothelial growth factor,VEGF)的表达,增强HCC细胞血管新生的能力。Sato等[19]给大鼠口服AGEs含量较高的饮料,发现大鼠肝脏中AGEs富集并诱导肝细胞VEGF表达,提示食源性的AGEs可能具有致HCC的作用。由此可见,AGEs是糖尿病患者HCC患病率高的一个重要因素。
AGEs的致病作用主要由其受体RAGE介导,AGEs-RAGE可激活胞内多条信号通路,例如NF-κB,MAPK,JAK-STAT及PI3K信号通路,诱导ROS上升,导致炎症、细胞增殖、血管新生等[20]。除了RAGE之外,AGEs还可与AGE-Rs结合。与RAGE不同的是,AGE-Rs发挥着降解、清除AGEs的作用。AGE-R1和AGE-R3与AGEs具有较高的亲和力,而AGE-R2无法直接与AGEs结合,需与AGE-R1以及AGE-R3形成复合物后发挥作用。研究发现,AGE-R1可加速AGEs的清除,抑制RAGE信号通路,从而降低ROS和促炎细胞因子的产生[3]。AGE-R3可干扰RAGE通路,对AGEs诱导的组织损伤发挥保护作用[13]。提示任何引起AGE-Rs表达改变的因素,均可能影响AGEs-RAGE信号通路的致病作用。
本研究关注了HBV对AGE-Rs表达的影响,发现HBV可抑制AGE-R1和AGE-R3的mRNA和蛋白的表达水平,但并不影响AGE-R2的表达,提示HBV可能会抑制肝脏对AGEs的清除,造成AGEs累积,从而增强AGEs-RAGE信号通路,促进HCC的发生。研究发现,AGEs可促进HepG2细胞增殖,而本研究利用CCK-8实验证实了HBV会促进AGEs作用下的HCC细胞增殖,进一步说明HBV通过抑制AGE-R1和AGE-R3的表达来促进AGEs诱导的HCC细胞增殖。
大量流行病学证据指出,糖尿病可提高HCC的患病风险,使用治疗糖尿病的药物二甲双胍可以降低HCC的发病率[21-25]。可见,糖尿病也是HCC发生的重要独立危险因素。Tan等[26]的一项系统性回顾和荟萃分析发现,糖尿病可提高乙肝患者HCC的发生率,这意味着乙肝合并糖尿病将大大提高HCC的发病率。然而,HBV与糖尿病之间是否存在相互影响进而促进HCC的发生发展,目前尚不清楚。本研究发现,HBV可通过抑制AGE-R1和AGE-R3的mRNA和蛋白的表达水平,促进AGEs诱导下HCC细胞的增殖。由于AGEs是糖尿病患者HCC高发的重要致病因素,因此这一结果不仅丰富了HBV的信号调控网络,也为进一步探讨HBV与糖尿病的共同致癌机制奠定了基础。然而,HBV如何影响AGE-Rs表达,下游哪些信号通路受到影响仍不清楚,目前相关研究仍在进行中。
