细胞外囊泡调控哺乳动物胚胎附植研究进展
2021-05-28杨海丽杨永恒程文强赵永聚
张 蓉,赵 乐,杨海丽,杨永恒,程文强,赵永聚
(西南大学动物科学技术学院 草食动物科学重庆市重点实验室 重庆市草食动物资源保护与利用工程技术研究中心,重庆 400715)
胚胎附植是指哺乳动物受精卵发育成囊胚定位于子宫,结束游离状态,与母体子宫建立初步联系的过程,又称胚胎着床。它是妊娠建立的关键步骤,也是早期胚胎生长发育的重要环节。胚胎附植包括定位、黏附和并置等过程,一旦附植成功,胚胎和子宫内膜会随着生理状态的变化而发生形态和结构上的改变,例如:子宫内膜发生增殖、分化,滋养层细胞发生迁移、侵袭,胎盘逐渐发育形成,从而保证母胎之间信息的交流和物质的交换。研究发现,哺乳动物早期胚胎丢失占妊娠失败的1/3,其中约有75%的胚胎在着床前后发生丢失[1-2]。因此,研究胚胎附植的调控机制对保证哺乳动物成功妊娠和提高哺乳动物繁殖率具有重要意义。
细胞外囊泡(extracellular vesicles,EVs)是由真核细胞和原核细胞分泌的膜性囊泡的异质群体[3],包括外泌体、微囊泡、凋亡小体等[4]。研究发现,细胞外囊泡作为细胞间通讯,广泛参与机体生理和病理状态过程,其在配子发生、受精、胚胎附植、胚胎发育及胎盘形成等生殖过程中发挥重要作用。有研究表明,哺乳动物子宫内膜、胚胎、子宫液及胚胎培养基中均存在细胞外囊泡,且自身和携带的内容物能够影响胚胎的生存力和子宫环境[5]。本文主要阐述了细胞外囊泡在哺乳动物胚胎附植中的调控作用,以期为研究细胞外囊泡在哺乳动物胚胎附植中的调控作用提供理论参考。
1 细胞外囊泡及其生物学功能
1.1 细胞外囊泡的形成及组分
细胞外囊泡是一种由内体或质膜脱落而成的膜结合的纳米囊泡,其内容物包含蛋白质、DNA、mRNA/miRNA、脂质等,在机体体液,包括血液、尿液、乳汁、子宫液、羊水等[6-9]中广泛分布,其也可以由细胞分泌产生,如滋养层细胞、子宫内膜上皮细胞、肿瘤细胞、胚胎等[10-13]。由于不同细胞来源分泌的细胞外囊泡形态和组成存在差异,因此,目前对细胞外囊泡并没有确切的命名。根据细胞来源、大小、形态和内容物含量将细胞外囊泡主要分为两大类:外泌体(exosomes)和微囊泡(microvesicles,MVs)(表1)。

表1 细胞外囊泡的类型及特征Table 1 Types and characteristics of extracellular vesicles
外泌体作为细胞外囊泡的亚型,它以腔内囊泡(ILV)的形式在内体系统内生成,并在多囊泡体(multivesicular body,MVB)与细胞表面融合的过程中被分泌[14],蛋白则是细胞外囊泡形成的第一调节器。外泌体膜蛋白从高尔基体到达内体或从质膜内化,然后在内体成熟过程中被分类为ILVs,而这一过程涉及特定的分选机制。这些分选机制中内体分选复合物(ESCRT)机制作为膜成形和剥离的驱动器,揭示MVB和ILV形成机制[15]。它以逐步方式运行,其中ESCRT-0和ESCRT-Ⅰ亚基聚集泛素化跨膜蛋白位于MVB限性膜的微区,并通过ESCRT-Ⅱ吸收能够萌发和分裂该微区的ESCRT- Ⅲ亚复合物。也有研究表明,可以不依赖于ESCRT机制仍形成以载有CD63的ILV为特征的MVB[16],这需要神经酰胺、四跨膜蛋白等的参与[17-21]。
微囊泡,起初被发现是来自于正常血浆和血清中血小板的亚细胞物质,称作“血小板灰尘”[22]。后来发现,受刺激的中性粒细胞经胞吐作用释放出质膜囊泡[23]。最近有研究发现,它们在不同细胞类型中的细胞间通讯发挥作用,包括癌细胞[24],通常称为“脂质体”。它由质膜向外出芽和裂变,随后释放到细胞外空间,其具体生物发生机制尚不明确。相关研究发现,它的形成需要质膜内的几种分子重排,包括脂质成分和蛋白质组成的变化以及Ca2+水平的改变,还需细胞骨架成分及其调节剂[25-27]。它的释放需要从质膜裂变,这一机制依赖于肌动蛋白和肌球蛋白与ATP依赖性收缩的相互作用[21,28]。
1.2 细胞外囊泡的生物学功能
细胞外囊泡参与机体的多种生理/病理过程:1)参与细胞间通讯:细胞外囊泡携带遗传物质运送到受体细胞影响细胞功能,能够作为细胞间信息交流和物质交换的载体;2)参与免疫应答:细胞外囊泡被证实能调节细胞免疫[29];细胞外囊泡含有免疫抑制HLA-G,可调节母体免疫耐受来促进胚胎发育[30];3)作 为生理/病理标志物:细胞外囊泡包裹的RNA在本质上是其来源细胞的内容物和状态的写照,且能够免于miRNA降解,因此能够作为生理/病理标志物;4)作为药物载体:细胞外囊泡可保证治疗剂的用量和生物活性,且具有较低免疫抗原性和毒性等特点,可以作为药物运载工具[31]。
2 细胞外囊泡调控哺乳动物胚胎附植
胚胎附植是一个复杂且动态化的生理过程,涉及到母体子宫与胚泡之间的密切交流和沟通。只有胚泡和子宫经历同步发育和双向串扰,建立结构联系从而保证胚胎成功植入。胚泡由两种不同类型的细胞组成:形成胚胎的内细胞团(inner cell mass,ICM)和围绕ICM并最终形成胎盘的滋养外胚层细胞[32-33],后者负责将胚泡附植于子宫内膜上皮,并进行迁移和侵袭进而植入胚胎。这一过程受到可溶性生长因子、激素、黏附分子和细胞外基质(ECM) 等多种因素的调节,这些因素可以通过自分泌、旁分泌和内分泌方式参与胚胎附植的调控[34]。早期细胞外囊泡被当作是细胞向外界排泄“废物”的一种途径,而近年来发现,它能够介导细胞间信息交流和物质交换。由胚胎干细胞产生的细胞外囊泡能将内含物转移到滋养层细胞并被其吸收,从而促进胚胎的植入[13]。这进一步说明,细胞外囊泡可将miRNA、蛋白质等物质运输至相应的受体细胞,从而影响受体细胞的生理功能。
2.1 细胞外囊泡miRNA与胚胎附植
miRNA是长度为19~22 nt的小型非编码RNA,它最主要靶向mRNA从而引起mRNA的降解或转录抑制,调节基因转录后表达水平[35-36]。它能参与多种生物学过程,例如配子发生、受精、胚胎发育、着床及胎盘形成[37-38]。有研究表明,miRNA作为细胞外囊泡的主要组成成分,不同细胞来源的细胞外囊泡miRNA不仅可以调控囊胚的分化、生长、发育及炎症反应,还可以调控子宫内膜细胞的增殖、凋亡、迁移和侵袭等过程[39](表2)。

表2 参与哺乳动物胚胎附植的细胞外囊泡miRNAsTable 2 miRNAs in extracellular vesicles involved in mammalian embryo implantation
胚胎附植是胚胎与子宫内膜相互接触,建立直接联系的生物学过程。这一过程会涉及多种分子的参与,从而形成特殊的子宫腔微环境,促使子宫内膜达到最佳容受状态,来接受活化的囊胚。研究者们检测了人[40]、猪[41]和绵羊[42]的子宫液发现,细胞外囊泡中包裹着miRNA。Krawczynski等[41]发现,猪子宫腔液中细胞外囊泡携带的miR-125b可能通过抑制LIF、LIFR和IL-6R基因的表达,进而介导子宫容受性、免疫、胚胎/滋养细胞发育和着床。然后对植入不同阶段小鼠子宫内膜释放的细胞外囊泡进行miRNA序列分析发现,miR-34c-5p、miR-210、miR-369-5p、miR-30b和miR-582-5p在植入窗口期(WOI)富集,还发现 miR-34c-5p可以通过靶向子宫内膜的生长停滞特异性1(GAS1),调节子宫内膜容受性,参与胚胎植入过程[43]。Burns等[42]对空怀14 d母羊和妊娠14 d母羊子宫液细胞外囊泡进行高通量测序分析,结果共检测到53种miRNAs,而仅miR-423在妊娠母羊子宫腔液中被检测到,生物信息学分析显示,它广泛参与细胞代谢、细胞周期和细胞凋亡等生理过程。母体免疫系统也会参与调节母胎免疫的微环境,保证妊娠正常进行,而细胞外囊泡携带的miRNA会参与其中并发挥重要作用。研究者将利用附植分离得到的子宫液细胞外囊泡处理牛子宫内膜细胞发现,其携带miR-98参与母体免疫功能的调节,促使胚胎成功附植于子宫内膜上皮细胞[44]。
胚胎成功附植,除了需要具有良好容受性的子宫内膜,还需要活化的优质胚胎。在胚胎发育过程中,胚胎的生存环境会影响胚胎的发育,其状态会影响细胞外囊泡miRNA的释放。Kropp等[45]检测了发育成熟的和退化的牛胚胎培养基中的5种miRNAs的表达,发现在退化胚胎中miR-181a、miR-196a2、miR-302c和miR-25的表达水平相对较高。Rosenbluth等[46]发现,胚胎培养液中的miRNA 会根据受精率、染色体状况和妊娠结局出现差异表达,如miRNA-191在非整倍体胚胎的培养基中浓度较高,miR-191、miR-372和miR-645在IVF/ICSI中高表达。研究者将妊娠阶段的小鼠子宫液外泌体与胚泡进行共培养后,提高了囊胚形成率,并且在植入后,miR-21的表达随着外泌体浓度而上调[47-48]。将来源于卵巢液、羊膜的细胞外囊泡添加到胚胎培养基中发现,其能够提高胚胎孵化率和植入率,诱导DNA甲基化调控表观遗传,参与早期胚胎发育过程,还能够上调相关miRNAs的表达,如miR-130a、miR-181b和miR-631[49-50]。这些都表明,特异性miRNA的分泌可能与胚胎发育有关,因此,可以通过检测特异性miRNA来选择最优质的胚胎,以保证成功妊娠。
在哺乳动物胚胎附植过程中,还涉及到了母胎之间的相互干扰。体外试验对子宫内膜上皮细胞ECC及其分泌的细胞外囊泡进行miRNA测序分析,其结果显示,差异表达的227个miRNAs中仅 13种miRNAs存在于细胞外囊泡中,如miR-451、miR-122、miR-124等,并对其靶基因进行生物信息学分析,显示这些细胞外囊泡miRNA与附植相关的信号通路相互作用,如黏附连接、VEGF信号通路、Jak-STAT通路和toll样受体信号通路[51]。Vilella等[52]证明,人子宫内膜细胞释放的外泌体包裹的has-miR-30 d能够被滋养层细胞摄取并整合到RISC复合体中,参与胚胎附植前转录组修饰和胚胎黏附表型,而miR-30 d敲除小鼠显示,母体和/或胚胎miR-30 d缺乏会在体内损害子宫内膜的接受能力和胚胎植入率[53],进一步研究发现,异质核糖核蛋白C1(hnRNPC1)可以影响子宫内膜细胞释放外泌体中的miR-30 d的含量,影响胚胎植入[54]。对11种猪输卵管上皮细胞来源的细胞外囊泡候选miRNAs进行鉴定,发现仅6种miRNAs(miR-19b,miR-19a,miR-203,let-7a,miR-126和miR-103) 表达,这些miRNAs能够协助胚胎经过输卵管进入子宫内膜进行附植[55]。研究者还发现,体外培养的猪滋养外胚层细胞分泌的细胞外囊泡可以携带miRNAs(miR-16、miR-17-5p、miR-20a)并能刺激内皮细胞的增殖,参与胎盘血管生成[56]。综上,细胞外囊泡在妊娠早期母胎之间的相互串扰中发挥着重要的生物学作用。
2.2 细胞外囊泡中其他生物活性物质与胚胎附植
细胞外囊泡中除了携带多种miRNAs参与哺乳动物胚胎附植过程,同时还有蛋白质参与其中(表3)。干扰素τ(IFNτ)是反刍动物胚胎及其滋养层细胞分泌的一种细胞因子,它通过旁分泌的方式减少雌激素和催产素受体在子宫内膜的表达,从而维持黄体活化和孕激素的产生[57]。研究者发现,子宫腔液外泌体携带的母体释放的内源性逆转录病毒(endogenous jaagsiekte retroviruses,enJSRV)通过诱导TLR信号通路刺激滋养层细胞增殖并释放IFNτ,参与胚胎附植和免疫应答[58]。
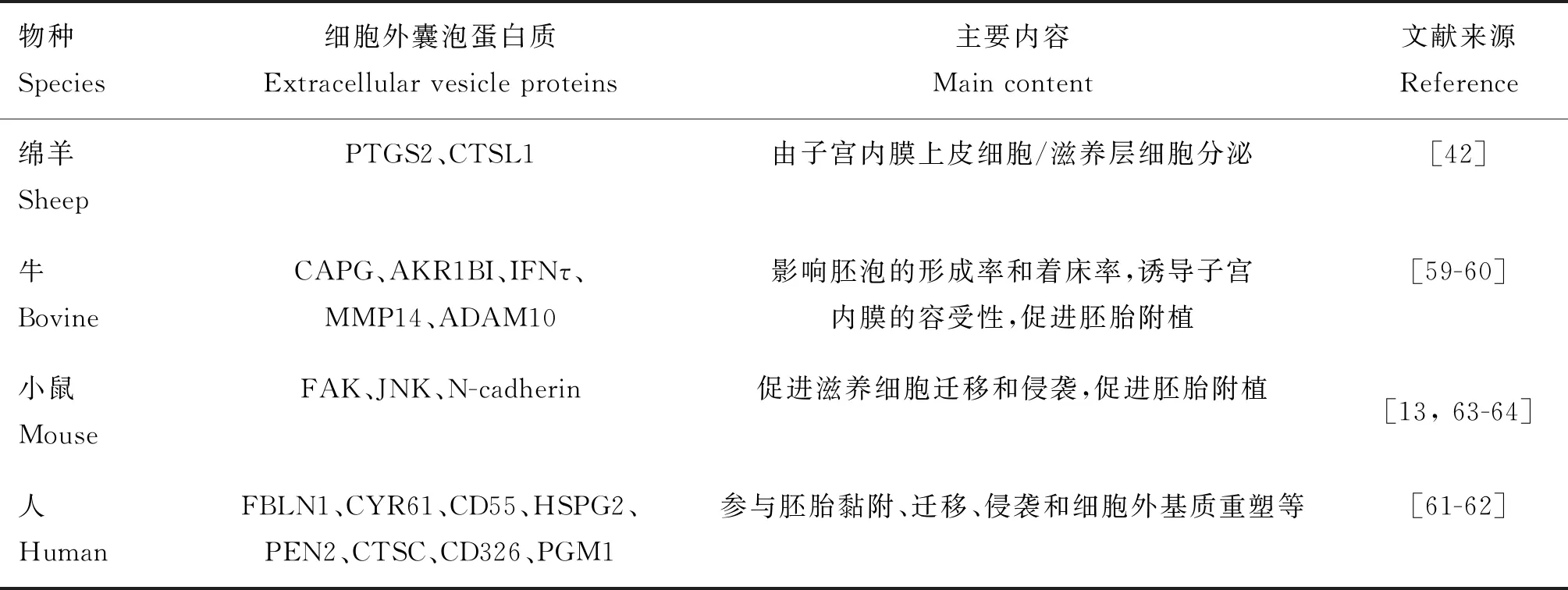
表3 参与哺乳动物胚胎附植的细胞外囊泡蛋白质Table 3 Proteins in extracellular vesicles involved in mammalian embryo implantation
不同生理阶段的细胞外囊泡所携带的蛋白质存在差异,且这些蛋白质可以影响受体细胞的生物学功能。研究者对不同生理阶段绵羊子宫腔液中的细胞外囊泡进行质谱分析,鉴定出195种蛋白质,其中40种和76种分别特异性表达于非妊娠和妊娠母羊子宫液细胞外囊泡,究其来源,发现其中部分蛋白是由子宫内膜上皮细胞/滋养层细胞分泌[42]。Nakamura等[59]对妊娠第15、17天和空怀第15、17天的牛子宫液外泌体进行蛋白组学分析发现,CAPG、AKR1BI和IFNτ仅在妊娠阶段表达,推测它们可能是由胚胎分泌到子宫腔液后经外泌体运送到子宫组织参与胚胎附植的调控因子。此外,有研究者将妊娠第17、20和22天的牛子宫腔液外泌体与滋养层TC-1细胞和子宫内膜上皮细胞共培养,结果发现,凋亡及黏附相关基因表达水平显著升高[60]。
Greening等[61]发现,特定激素治疗后,子宫内膜癌细胞(ECC1)衍生的外泌体能增强滋养层细胞的黏附能力,相关蛋白表达显著增加,这些蛋白参与胚胎黏附、迁移、侵袭和细胞外基质重塑等植入的基本过程[61-62]。Desrochers等[13]以小鼠模型为研究对象,发现来源胚胎干细胞的微囊泡诱导FAK和JNK磷酸化,刺激滋养细胞迁移,促进胚胎植入。人蜕膜基质细胞来源的细胞外囊泡能够介导SMAD2和SMAD2上调 N-钙调蛋白的表达,促进滋养层侵入[63]。综上,子宫内膜细胞或胚胎可以选择性地将蛋白包装到细胞外囊泡,然后运输到相应的靶细胞引发靶细胞形态和功能上的改变,从而促进胚胎附植。研究还发现,外泌体中存在大量的金属蛋白酶(如MMP-14、ADAM10等)[64],而这些蛋白被报道广泛参与ECM的重塑和细胞表面结合因子、受体及细胞因子的释放[65-67],能够影响胚泡的形成率和着床率,诱导子宫内膜的容受性,促进胚胎附植[11]。
除了miRNA和蛋白质以外,外界刺激(光照、氧浓度)也会影响细胞外囊泡的释放,调控胚胎附植。Bognar等[68]将不同光处理后的胚胎移植到假孕雌鼠子宫,第8.5天处死并检测含核酸的细胞外囊泡数量和细胞凋亡情况,发现,细胞外囊泡数量和细胞凋亡数增加,对胚胎发育潜能无影响而植入能力下降。有研究者用不同氧气处理体外牛子宫内膜间质细胞后,发现,低氧条件下外泌体含量增加,蛋白质组学分析发现,VNN1仅存在于富氧环境,它可以调节子宫的容受性,而ADAM10只在低氧条件下表达,参与细胞迁移和黏附[69]。
3 展 望
繁殖性能是影响畜牧产业发展的重要因素之一,胚胎附植作为哺乳动物妊娠过程的关键环节,探究胚胎附植的调控机制对提高畜牧产业效益显得尤为重要。细胞外囊泡作为一种细胞间交流媒介,在介导细胞间通讯、参与免疫反应、当作药物载体以及疾病标志物等方面越来越受科研工作者的青睐,最近研究表明,其在胚胎与母体的信息交流中发挥重要作用。目前,细胞外囊泡对胚胎附植的调控主要集中于其所包裹的miRNA和蛋白质靶向受体细胞,影响其生理功能和表型变化,但对在这一过程中离子通道的调控研究较少,进一步研究其在胚胎附植过程中的作用,有望揭开复杂的胚胎附植过程。
