猪肠道细菌培养组学研究进展
2021-05-28周梦情陈从英
周梦情,陈从英
(江西农业大学 猪遗传改良与养殖技术国家重点实验室,南昌 330045)
养猪业在我国国民经济中占有非常重要的地位,为人们提供了主要的肉食种类。同时,猪也是研究人类生理功能和疾病的重要模型动物[1],与人体健康联系较紧密。猪的重要经济性状受到其肠道微生物组成、结构和功能的影响。因此,猪肠道菌群是近年来的研究热点领域之一。猪肠道细菌培养组学的研究也越来越重要,主要原因是:1)细菌16S rRNA基因测序技术能以极低的成本对猪肠道菌群进行分析,但只能精确到细菌属及属以上分类水平,对于种或种以下水平的分类难以确认[2]。对于微生物群落的研究,只分类到属是远不够的。2)1998年 开始的宏基因组分析包含了可培养与未培养的微生物。宏基因组研究揭示了肠道菌群的多样性,但其难以区分丰度较低的菌株[3]。通过宏基因组可发现人体肠道中大量未培养菌株信息(约70%)[4]。宏基因组物种鉴定依赖已知数据库信息,但还有大量物种无法鉴定;许多样品中的优势物种目前并不存在已培养的参考菌株,再加上技术方面的问题,这些都在影响着宏基因组的发展。3)通过分离培养出优势物种的代表菌株,可通过测序得到其基因组信息,研究该菌株的功能以及用无菌小鼠进行功能验证,可扩大对人类或其他哺乳动物肠道微生物组成和多样性的认识,证实肠道菌群与宿主表型性状的因果关系,研究其作用机制等[5]。
使用培养组学对猪肠道菌群进行研究,将对猪肠道菌群组成及功能有更全面的了解,可为研究菌群与宿主基因互作提供生物材料。本文主要从猪肠道菌群组成结构、培养组学发展、猪肠道细菌培养组学的研究现状等方面进行综述。
1 猪肠道菌群的组成和结构
猪肠道菌群是指所有定殖在猪肠道里的大量细菌、病毒、真菌和古菌等构成的集合。而细菌占绝大部分比例,是目前研究重点之一。仔猪是否在出生前就存在肠道菌群有一定争议,对于出生前母猪子宫中是否有菌也还不确定[6],一般认为仔猪是出生后通过与外界环境、母体产道和乳汁以及粪便的接触从而获得菌群并开始在肠道定殖[7]。猪肠道菌群从需氧菌、兼性厌氧菌再到厌氧菌进行定殖[8]。猪肠道菌群组成受多种因素影响,如宿主遗传[9]、性别[10]、年龄以及日粮[8]等。成年猪肠道总表面积约在1 000 m2,肠道内大约有30个属的400~600种细菌,数量达1014个,是体细胞数的10倍[11],分布于肠道的各个部位。健康哺乳动物体内存在着500~1 000 余种细菌和其他微生物种类[12],与营养物质代谢[13]、宿主免疫[14]和代谢综合征[15]等都紧密相关。其能消化分解碳水化合物[16]、合成B族维生素[17-19]、产生短链脂肪酸[20]等物质。在健康状态下,小肠(十二指肠、空肠和回肠)内只含有少量细菌,盲肠和结肠中细菌数量最多[11]。
猪肠道菌群主要由厌氧菌、兼性厌氧菌和需氧菌组成,其中,以厌氧菌为主,约占99%;少部分为兼性厌氧菌或需氧菌[21]。从分类水平上看,猪肠道菌群的组成和结构可通过门、纲、目、科、属、种分类水平上菌群的种类和丰度反映。总体来看,猪肠道菌群主要是由厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、变形菌门(Proteobacteria)、放线菌门(Actinobacteria)和螺旋菌门(Spirochaetes)五个门的细菌组成[22]。其中,厚壁菌门和拟杆菌门是最具优势的两大门。与之前报道的人类肠道菌群组成类似[12]。Patil等[23]研究发现,不同肠道部位的菌群组成有很大差异,十二指肠主要由厚壁菌门(90%)主导;空肠和回肠主要是厚壁菌门和变形菌门主导;盲肠中厚壁菌门(>75%)占主导地位;结肠中的菌群多样性最高,包括厚壁菌门、拟杆菌门、变形菌门和螺旋菌门。Han等[24]分析了不同日龄猪肠道菌群组成情况,发现其组成差异显著。综合以上研究结果可知,猪肠道菌群组成在水平结构和垂直结构上都存在显著差异。
Ramayo-Caldas等[25]研究发现,猪肠道菌群组成的肠型分类与其体重和平均日增重显著相关。Hu等[5]采用FMT(粪菌移植)发现,仔猪断奶后腹泻与肠道菌群相关。猪的肠道菌群是高度复杂但相对稳定的,在某些情况下,这种稳定被打破,可引起菌群紊乱,导致疾病发生和猪生产性状等的改变。
2 培养组学发展
微生物学发展已进入第三个黄金时期。第一个黄金时期主要是传统微生物分离培养,揭示了大量微生物以及发现了益生菌;第二个黄金时期主要是揭示细菌遗传基础;第三个黄金时期主要是揭示人体微生物组与健康的密切联系。组学技术的出现,如16S rRNA 基因测序、宏基因组、宏转录组和宏蛋白质组等组学分析技术提供了间接了解微生物组的手段。微生物学研究中,培养技术显得十分重要。传统分离培养,受技术和条件限制,大多数的微生物仍未培养成功。但研究微生物与疾病或者与宿主表型的关系时,还需微生物活体,于是培养组学技术得到了快速发展。
近年来,肠道菌群研究大都围绕细菌展开。相对于细菌,真菌、病毒和古菌等微生物研究略少。培养法是分离细菌所用的最古老的技术。2012年,培养组学由Lagier等[26]提出,是一种通过改善培养条件培养细菌的方法。该方法除了通过改善培养条件尽可能模拟细菌原始生存环境外,还通过结合基质辅助激光解析串联飞行时间质谱 (MALDI-TOF MS)和16S rRNA基因测序等技术对分离得到的菌株进行鉴定。培养组学技术是了解特定菌或菌群在宿主中作用的关键,获得的菌株可从机制上深入研究肠道菌群塑造、功能、新陈代谢和炎症等。
2.1 培养组学中的细菌分离、鉴定和培养技术
2.1.1 细菌分离技术 目前,改良培养基组分、培养条件优化、共培养和微流控液滴培养等是肠道菌群的主要分离技术。相对于传统分离技术,这些技术可扩大肠道可培养细菌的范围。
改良培养基组分和培养条件优化可以大幅度改善肠道菌群的培养情况,改良培养基组分即添加短肽类物质、微量元素和信号分子等,培养条件优化则是改变培养温度、pH及时间等,均可提高未培养细菌的可培养性。研究表明,YCFA培养基能提供70%人类肠道微生物生长所需的营养物质,因此,将YCFA培养基与选择性培养技术结合起来可以进行靶向细菌分离[27]。Li等[28]通过在厌氧培养基中添加十八碳烯酸(TVA)发现,培养的菌群大部分属于未培养的瘤胃菌群。Zou等[29]基于肠道细菌的特性筛选出11种培养基,并涂布0.1%半胱氨酸,增加了肠道细菌的可培养性。在肠道菌群中,微生物间的互作对于菌群生存相当重要。共培养是一种培养兼性和互养微生物的有效方法[30]。来自同一肠道环境的微生物往往具有协同作用,Nichols等[31]发现,辅助菌株MSC105可对未培养细菌MSC33的生长起诱导作用。微流控液滴培养是在微观条件下对流体进行精确控制,利用微流控可以模拟肠道中存在的微结构,充分挖掘菌群的功能。Jalili-Firoozinezhad等[32]通过构建双通道微流控装置,制备出一种厌氧肠道芯片,将从人类粪便中分离出的复杂肠道微生物样本培养数天,可培养出200多种不同的细菌,其丰度和比例与在人类粪便中观察到的相似。
改良培养基组分、培养条件优化、共培养和微流控液滴培养等具有代表性的细菌分离技术在近几年得到了快速发展。每种技术都有其优势,必要时可进行多种分离技术联用,多角度对未培养细菌进行分离。
2.1.2 鉴定技术 传统的菌株鉴定方法操作繁琐且较为耗时,准确性较差。目前,基于基质辅助激光解析串联飞行时间质谱(MALDI-TOF MS)和16S rRNA基因测序是培养组学菌株鉴定中最常用的技术。MALDI-TOF MS是一种基于细菌表面蛋白分子量的快速菌株鉴定技术。通过测定细菌特异性的蛋白质组成,采用质谱技术将测定得到的蛋白质和多肽按分子量大小排列,形成蛋白质组指纹图,通过特征模式峰进行菌株鉴定[33]。与传统菌株鉴定方法相比,MALDI-TOF MS检测速度快,灵敏度高,准确率较高。Seng等[34]分析其11年临床微生物鉴定经验发现,MALDI-TOF MS同时具备时效性高与成本低的特点。得益于现有菌株数据库的相对完善,现阶段,MALDI-TOF MS已经能够鉴定出大部分菌株[35],包括临床常见厌氧菌,即使一些生化反应相似、不易区分的厌氧菌也可进行区分。MALDI-TOF MS 技术操作简单,鉴定准确、快速且可高通量进行菌株鉴定,可作为猪肠道菌株鉴定及筛选的重要辅助工具。
16S rRNA基因测序是一种通用的利用细菌16S rRNA序列测序进行细菌物种鉴定方法。16S rRNA是核糖体RNA的一个亚基,16S rRNA基因为编码该亚基的基因,长度约1 542 bp。16S rRNA基因序列包括9个可变区和10个保守区,保守区序列是所有细菌共有,可反映物种间的亲缘关系,而可变区序列则能体现物种间的差异。不同细菌之间16S rRNA基因的可变区显著不同,对菌株进行全长16S rRNA基因测序可对所有可变区进行比较。由于Illumina测序(二代测序)所产生的单条read长度在75~300 bp间,目前,16S rRNA基因全长序列是通过sanger测序(一代测序)获得。Johnson等[36]对16S rRNA基因进行PacBio CCS测序(三代测序)发现,三代测序16S rRNA基因全长在种属鉴定上的多样性比二代测序更丰富,提高了种属鉴定的分辨率和准确度。
目前,MALDI-TOF MS和16S rRNA基因测序这两种鉴定技术已获得普遍认可。但由于16S rRNA基因测序成本高和耗时长等原因,大部分研究都会优先选择MALDI-TOF MS这种经济有效且快速的菌株鉴定方法。
2.1.3 培养技术 微生物培养技术包括需氧培养、二氧化碳培养、微需氧培养和厌氧培养。根据不同的样品及不同的培养目的,可选用不同的培养技术。
需氧培养是将分离出的少量细菌转移到培养基中,置于适宜温度的培养箱中,无特殊要求的细菌均可生长。Sangwan等[37]从环境中分离出一种细菌ChthoniobacterflavusEllin428,该菌株为好氧异养,在多种生物培养基上都生长良好。二氧化碳培养是某些细菌嗜二氧化碳,只在高浓度的二氧化碳环境中生长或生长得更好。James-Holmquest等[38]研究表明,Neisseriagonorrhoeae菌株需在二氧化碳环境中生长,且浓度越高越适宜。微需氧培养是在含有5%~6%氧气、5%~10%二氧化碳和85%氮气的气体环境中,将微需氧菌接种到培养基上,35 ℃进行培养。微需氧菌如弯曲菌属等在大气和绝对无氧环境中不能存活。Hansen等[39]对100名儿童的结肠活检组织进行微需氧培养,得到129株革兰阴性微需氧菌,大多为弯曲菌属和螺杆菌属。厌氧培养是厌氧菌对氧敏感,培养过程中需无氧环境的一种培养技术,适用于专性厌氧菌与兼性厌氧菌。Browne等[40]使用厌氧培养从健康人肠道中分离出137种菌,这些菌都属于新的菌种,该研究表明,相当大比例的肠道细菌是可培养的。
哺乳动物肠道中蕴藏着巨量的微生物。肠道菌群细胞总量约1014个,其中99%是厌氧细菌,绝大部分需进行厌氧培养。目前,在公共数据库中具有完整基因组序列信息的细菌和古菌已超过20万个,相当高比例的细菌还未被分离培养[41]。KOMODO数据库的出现为解决该问题提供了重要工具,这个数据库有来自18 049种不同微生物和3 335个培养基配方的信息,能基于细菌或古菌16S rRNA基因序列来预测其菌生长所需的合适培养基配方[42],该数据库对猪肠道细菌培养组学具有十分重要的意义。对于培养组学,除了分离和培养条件的多样化,还使用各种高通量测序技术鉴定(图1),即培养组学是一种高通量的培养方法。
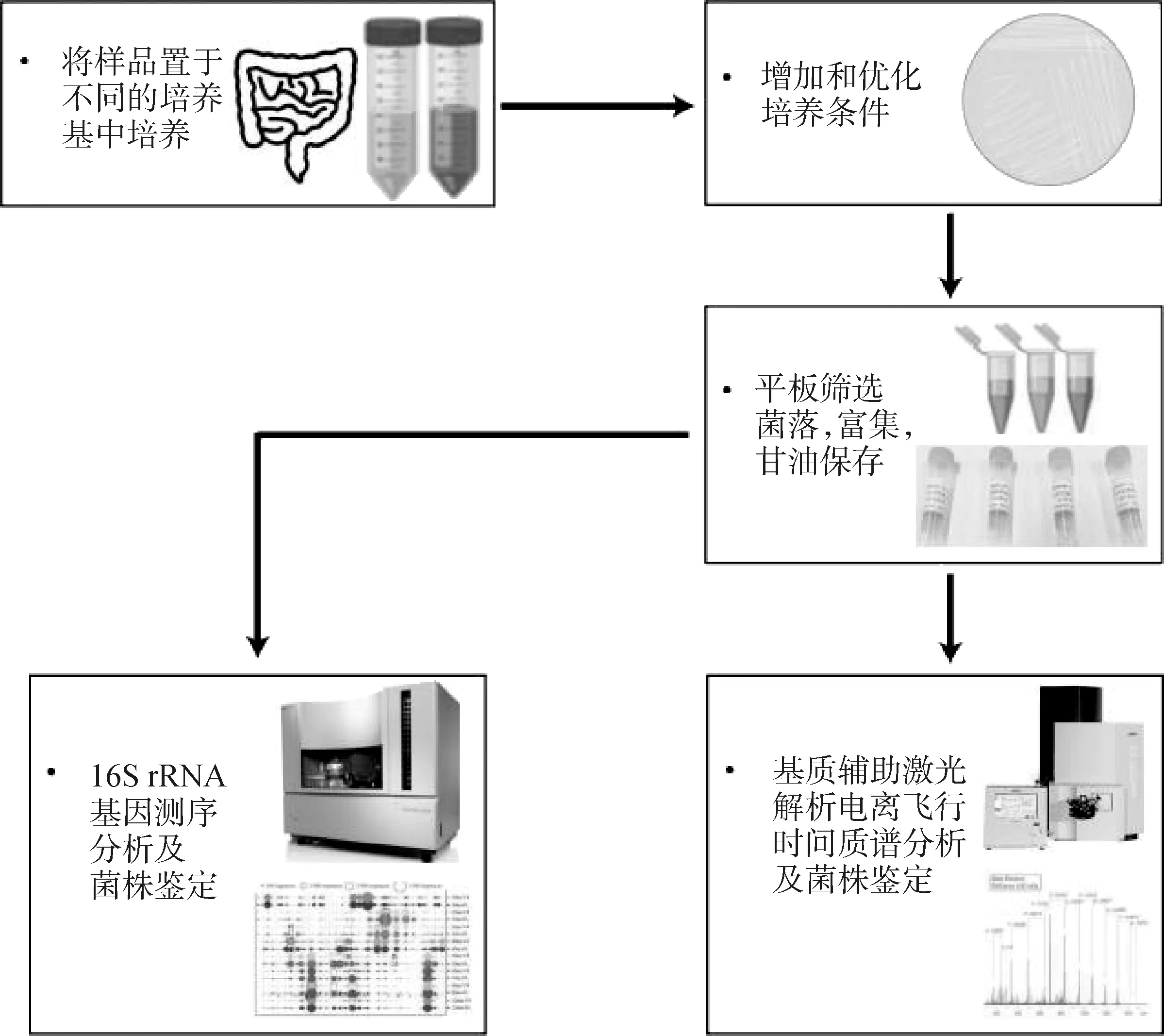
图1 培养组学工作流程Fig.1 The workflow of culturomics
2.2 细菌培养组学技术进展
目前,培养组学已获得广泛关注并取得显著成就,但其研究主要集中于人体肠道菌群的培养。在培养组学之前,已培养的14 300种原核生物中有2 172种 (15%)是从人体中分离,另外12 128种(85%)则是从环境中分离得到[43]。自培养组学发展至今,与人体相关且已分离培养的微生物数量增加到了2 671种[44]。
已有研究表明,使用培养组学得到的人体肠道微生物的多样性高于根据基因组分析预测的多样性[43,45]。Lagier等[46]对粪便样本开展培养组学研究时,将212种培养条件总结优化为18种最佳培养条件,可把肠道中70%的微生物分离培养,共鉴定出1 057种微生物种类,其中,531种属于人体肠道菌群,丰富了人类肠道菌群中可培养细菌的种类。Pfleiderer等[47]首次在神经性厌食症患者粪便样本中开展培养组学研究,共使用88种培养条件,得到12 700个 不同菌落,鉴定到4个门中133种细菌。并且存在之前从未从人类肠道中分离出的19种细菌,有11种经基因组测序鉴定为新的细菌种类。肠道中厌氧微生物占比极高,由于需要创建、维持厌氧环境以及厌氧菌生长较缓慢等诸多原因,厌氧微生物培养非常耗时[48]。在培养基中添加抗氧化剂可使严格厌氧微生物在有氧环境下成功培养[49]。Park和Yu[50]将半胱氨酸、谷胱甘肽、抗坏血酸、尿酸和α-酮戊二酸一起添加到培养基中时,可使620种(共测试623个菌株)菌株生长,包括兼性厌氧细菌(154种)、严格厌氧菌(82种)以及真菌和产甲烷菌。培养组学为细菌的分离鉴定提供了较全面的培养条件,Lagier等[51]通过对培养条件分析表明,在血培养瓶中进行预培养,分离得到的菌株中56%为新物种;在培养液中添加经过过滤灭菌的瘤胃液,可以得到40%的新物种;添加5%的绵羊血,分离得到的菌株中25%为新物种。
16S rRNA基因测序或宏基因组测序,都极大丰富了肠道微生物组数据库。测序技术与培养组学之间是互补的,Hamad等[52]利用培养组学方法,从14份粪便样本中分离出17 800个真菌菌落,经ITS1与ITS2扩增子测序得到的肠道真菌群落信息与培养组学存在较大差异,两者对粪便真菌多样性的分析形成了互补。此互补不仅存在于肠道真菌研究中,也存在于肠道细菌研究中。Zou等[29]利用11种培养基大规模分离培养155个健康人粪便样本,共获得6 487个 菌落,经测序得到1 520个高质量的人体微生物细菌基因组,定义为可培养参考基因组(culturable genome reference,CGR)。与之前报道的1 000种人体胃肠道细菌的测序结果相比,超过80种细菌是新发现的。1 520个基因组覆盖人体内所有主要细菌门和属,其中,264个基因组在现有的参考基因组中未发现。细菌参考基因组数量的增加可提高宏基因组测序数据的利用率(从50%提高到70%),使人类微生物群的分辨率更高。
Gouba等[53]从健康人粪便样品中分离出肠球菌科的一个新种Enterococcus burkinafasonensis sp.nov.中的菌株Marseille-Q0835T,并对其表型特征进行描述,更新了人类菌株库。Amadou等[54]从一名肥胖患者粪便样品中分离出新的细菌Lachnoclostridiumbouchesdurhonense,该菌可在含有5%绵羊血的哥伦比亚琼脂上进行培养。随着培养组学技术的不断优化,越来越多的细菌可从肠道中分离出,将此前在肠道中从未分离的菌种成功培养。虽存在工作量大、菌株测序步骤较为繁琐和培养条件苛刻等不足,但技术与方法的不断创新有助于培养组学的发展。实体菌株的获得为人体微生物组相关研究如株水平的研究,细菌、病毒和真菌的培养,生物信息分析技术优化等奠定了基础。也是微生物产物转化如活菌药物库、精准医疗的物质基础。
3 培养组学在猪肠道菌群研究中的利用现状
猪肠道细菌的培养是猪肠道菌群研究的重要内容之一,利用培养组学分离鉴定猪肠道菌群中未分离的菌株,通过MALDI-TOF MS或16S rRNA基因测序分析、全基因组测序和注释以及主要表型特征描述等方法,可鉴定新物种及其基因组,并对其在猪肠道菌群中的作用进行深入研究[55]。但目前,由于猪培养组学数据相对不足,了解相关微生物物种间的相互作用局限性较大[56]。为充分了解猪肠道微生态系统是如何工作的,以及研究肠道菌群与宿主相互作用关系,肠道中未分离菌株的分离培养十分重要,培养组学也已成为猪肠道微生态研究中的重要支撑技术之一。
目前,培养组学研究大多集中在人体肠道细菌培养[46],而对猪肠道培养组学的研究较少。肠道培养组学可将此前从未在猪肠道中被分离培养的菌株成功培养。猪肠道中的某些菌(如产甲烷菌)使用传统方法难以分离和培养;使用培养组学方法可从猪粪便样本中分离出甲型甲烷弧菌[57]。Stanley等[58]应用分离培养的方法,从猪结肠黏膜中分离出一种梭状芽胞杆菌和两种拟杆菌菌株,并表明,这3株细菌显著水解黏蛋白。Li等[59]应用培养组学方法从野猪肠道中分离培养得到156株乳酸菌,且其中5株乳酸菌菌株具有益生菌性质,可作为候选益生菌或是饲料添加剂。同样,Betancur 等[60]从哥伦比亚克里奥尔猪粪便中分离出3株植物乳杆菌菌株,并确定其具有抗菌活性,可抑制潜在的致病微生物。张锦华等[61]从猪肠道各个区段中共分离出2 317株肠道细菌,通过鉴定其中两株菌为枯草芽孢杆菌,为产蛋白或是多肽类抗生素的活性菌株。Xu等[62]从健康母猪的新鲜粪便分离出LactobacillusreuteriYSJL-12,对其进行了全基因组测序,饲料中添加LactobacillusreuteriYSJL-12喂养断奶仔猪和育肥猪,可预防猪的腹泻,提高饲料转化率,增强仔猪抗病能力,促进仔猪生长。也有研究报道,使用培养组学从猪粪便样本中获得的寇氏普氏菌(Prevotellacopri),可影响猪肌肉生长及脂肪沉积等性状,这为进一步研究猪肠道菌群与重要经济性状关系提供了参考[63]。
随着培养组学的继续发展,猪肠道中的微生物会被逐渐分离,直接引起宿主表型变化和疾病发生的因果菌株也会被鉴别。
4 展 望
4.1 肠道部位多样性有助于培养组学发展
目前为止,猪肠道菌群的复杂性和多样性尚未得到深入探索,培养组学的出现可为菌群研究提供新思路。在人体肠道菌群培养组学研究中,仅粪便样本中就可发现较多新菌种。但采用粪便菌群代表肠道菌群是存在一定偏离的,理想情况应是进行全肠道菌群检测。对于猪肠道菌群,不同肠道部位(如盲肠、结肠)样本可分离培养出更多新菌种。猪作为大动物的一种,相对于人来说,易进行单一因素研究。因此,猪肠道菌群培养组学研究潜力巨大。
4.2 细菌基因组信息有助于培养组学发展
微生物组学研究中,已有参考基因组的微生物数量远低于自然界存在的微生物数量。可用三代测序结合二代测序对样品进行单菌基因组组装,二代测序数据可对三代测序数据结果进行校正;同时,三代测序数据可以进行参考基因组优化,获得完整的细菌基因组信息。现阶段已分离的细菌约为15 000种,绝大多数微生物还未进行分离培养,原因之一是不了解不同微生物培养条件(尤其是培养基配方)。KOMODO数据库可利用菌株的基因组信息来提示培养基的选择或培养基中营养物质的添加,实现目标菌株的分离培养。
4.3 培养组学不足与应用前景
目前,培养组学为新型菌群研究技术,但限制因素依然存在。
4.3.1 菌株鉴定效率低 培养组学技术可以得到大量不可能培养或难于培养的菌株,但存在某些高通量测序技术难以鉴定的菌株。菌株鉴定效率低且成本高是限制因素之一。但随着MALDI-TOF MS 技术和高通量测序技术的不断发展,该限制因素正在不断解决中。
4.3.2 培养基成分和生长条件不全面 大多数肠道中的细菌不会在标准培养基中生长,且任何细菌的生长都需要营养和适宜的大气环境。不同培养条件下,细菌生长会有明显差异。目前,已出现可控制pH、培养温度和氧气浓度的培养箱,但某些细菌需要的特殊营养物质需要不断进行摸索。简化培养步骤,发展新的培养技术是改善培养组学的一个新方向。
4.3.3 培养组学应用前景 培养组学研究获得的实体菌株,在机制研究和精准医疗方面应用前景广阔。但培养组学相对来说是一个较新的研究技术,培养基的设计以及培养条件的多样化都需要重视。目前,对于猪肠道菌群的认识还处于初级阶段,宏基因组学、转录组学、蛋白质组学、代谢组学和免疫组学等单个组学可获得肠道菌群的局部信息。但随着培养组学技术、高通量测序技术及多组学的发展,猪肠道菌群领域的神秘将逐渐被揭示,对于肠道菌群结构和功能的理解也将更加深入。
致谢
感谢黄路生院士对本论文的精心指导!
