swnR基因在金龟子绿僵菌合成苦马豆素中的作用
2021-05-28宋润杰王敬龙莫重辉赵宝玉
孙 璐,宋润杰,路 浩*,王敬龙,莫重辉,赵宝玉
(1.西北农林科技大学动物医学院,杨凌 712100;2.西藏自治区农牧科学院草业科学研究所,拉萨 850002;3.青海大学农牧学院,西宁 810016)
1979年,Colegate等首次从灰苦马豆(Swainsonacanescens)中分离出一种吲哚哩嗞啶生物碱,因是从灰苦马豆中分离获得而命名为苦马豆素(swainsonine,SW)[1],随后,国内外学者相继从疯草类有毒植物中分离出苦马豆素[2-3],并证明SW是疯草类有毒植物的主要毒性成分,是动物采食这些植物引起神经系统慢性功能障碍为特征症状的唯一毒素[4-5]。后续研究发现,该毒素可由棘豆链格孢菌(Alternariaoxytropis)[6-8]、绿僵菌(Metarhiziumspp.)[9-10]、豆类丝核菌(Slafractonialeguminicola)[11-12]等多种真菌产生,而有关真菌的苦马豆素生物合成通路及其调控合成的催化酶基因尚不完全清楚。
有研究向培养基中加入不同的前体物质,观察SW产量,结果发现,L-哌可酸能够显著提高SW的产量[13],确定其为SW生物合成重要的前体物质。Lu等[14]通过对A.oxytropis进行全基因组测序,并预测到P2C(δ1-piperideine-2-carboxylic acid)和P6C(δ1-piperideine-6-carboxylic acid)两条将L-赖氨酸合成L-哌可酸的生物合成通路中的相关基因酵母氨酸脱氢酶(SDH)、酵母氨酸氧化酶(FAD2)和吡咯啉-5-羧酸还原酶(P5CR)等。有学者对A.oxytropis中SW生物合成相关基因SDH[15-16]进行研究,发现该基因对SW的生物合成和前体物质L-哌可酸的积累都有影响。2017年,Cook等[17]通过对产苦马豆素的几种真菌的基因组进行测序,并将它们的产SW相关基因与其他产SW内生真菌的基因进行比较,发现所有这些基因都属于一个名为“SWN”的基因簇,其中包括swnH1、swnH2、swnK、swnN、swnR、swnA和swnT,而同种不产SW的内生真菌则没有SWN基因簇。这些基因参与编码真菌L-哌可酸到SW生物合成的催化酶,在此基础上,他们成功构建了罗伯茨绿僵菌(M.robertsii)swnK基因敲除载体,并通过同源重组获得了swnK缺失突变型菌株,采用LC-MS检测法证明swnK突变菌株不再产SW,而将swnK基因回补后SW的产量又恢复到正常水平,说明swnK基因在SW生物合成通路中具有重要调控作用。且Alhawatema等[18]通过对S.leguminicola的swnK同源基因pks进行RNAi研究,同样发现该基因对SW生物合成有重要作用。随后,2020年Luo等[19]通过对M.robertsii的SWN基因簇其他基因的研究发现,SW的生物合成是多分支合成通路,并不是一个线性生物合成通路。
目前,尚未有金龟子绿僵菌(M.anisopliae)中关于SWN基因簇中的其他基因作用的研究。金龟子绿僵菌是一种广谱的昆虫病理性真菌,且可产生SW[20-22],本实验室前期通过对M.anisopliae不同时期发酵液SW含量及SW生物合成通路相关基因表达水平的检测,发现swnR基因表达量的变化趋势与苦马豆素产量的变化趋势一致,因此,推测swnR基因在M.anisopliae苦马豆素生物合成通路中具有重要作用。本研究采用同源重组技术敲除M.anisopliae的swnR基因,研究swnR基因的缺失对M.anisopliae中SW生物合成及M.anisopliae表型的影响。
1 材料与方法
1.1 材料与试剂
金龟子绿僵菌(BNCC114445)由中国林业科学研究院森林生态环境与保护研究所提供,苦马豆素标品(Sigma-Aldrich),神奇滤布Miracloth(EMD Millipore Corp,Billerica,MA,USA),E.coliDH5α感受态细胞、pUC19质粒、高保真酶、DNA marker、6×loading Buffer、无缝克隆试剂盒均购自TaKaRa公司;质粒pBAR-BenA由西北农林科技大学外科实验室保存;质粒pBAR来自西北农林科技大学植物保护学院;限制性内切酶购自NEB公司;苯菌灵、溶壁酶、草铵膦、氨苄青霉素购自Sigma公司;PCR引物合成及测序由北京奥科公司完成;其他国产化学试剂均购自杨凌三力公司。
其他培养基和试剂均按照文献配制:SDA培养基(Sabouraud medium)[23]、Luria-Bertani培养基[24]、STC buffer和PTC Buffer[25]、TB3Buffer和再生培养基[26]。
1.2 金龟子绿僵菌原生质体的制备
将金龟子绿僵菌接种于SDA培养基,28 ℃避光培养7 d后,采用“菌饼法”将其接种于SDA液体培养基中,28 ℃ 180 r·min-1避光培养2 d后,采用灭菌后的三层神奇滤布过滤菌丝,用1.2 mol·L-1KCl将菌丝充分洗涤,加入1%蜗牛酶+1%纤维素酶+1%溶壁酶组合酶解液,30 ℃ 100 r·min-1酶解3 h,采用灭菌后的一层神奇滤布将酶消化混合物中的原生质体过滤到50 mL无菌离心管中,用1.2 mol·L-1KCl将原生质体充分洗涤,最后用STC缓冲液将原生质体重悬定容至1 mL,保存备用。
1.3 金龟子绿僵菌swnR基因的鉴定
采用Sigma-Aldrich公司的真菌DNA提取试剂盒提取M.anisopliae的DNA,以该DNA为模板,利用Primer Premier 6.0软件设计金龟子绿僵菌swnR基因引物(表1)对swnR基因进行高保真扩增,而后采用DNA回收试剂盒对扩增后的DNA片段进行回收,并将回收产物进行测序以确定swnR基因。

表1 本试验所用到的引物Table 1 Primers used in this study
1.4 swnR基因敲除及回补载体的构建
采用引物L2/R2和L4/R4扩增获得swnR基因的上、下游目的片段;用L3/R3引物扩增获得苯菌灵(杀菌剂)抗性基因(ben);采用限制性内切酶EcoRⅠ/BamHⅠ对pUC19质粒进行双酶切,然后用无缝克隆试剂盒连接swnR-I、ben、swnR-II和pUC19线性片段,重组质粒pUC/SwnR∷Ben如图1所示。
将重组质粒pUC/SwnR∷Ben转化至StellarTMCompetent Cells中,用含有100 mg·mL-1氨苄青霉素的LB培养基挑选阳性克隆,并对含有目的基因片段的pUC19质粒进行检测。
采用限制性内切酶EcoRⅠ/BamHⅠ双酶切pBAR质粒,用L1/R1引物 扩增获得swnR基因片段,然后无缝克隆连接swnR基因和pBAR线性片段,采用上述转化方法,挑选阳性克隆。
1.5 swnR基因的敲除及鉴定
用STC缓冲液将原生质体重悬至2×107~5×107个·mL-1,取200 μL,加入5 μg目的片段,采用PEG介导的方法将目的基因导入到原生质体中[26],将原生质体添加到含有100 μg·mL-1苯菌灵的再生下层培养基中,28 ℃孵育10 h后,在培养皿上层倒入含有300 μg·mL-1苯菌灵的再生上层培养基,28 ℃继续避光培养,1周左右长出单菌落的转化子,挑取单菌落转化子至含有苯菌灵的培养基中,进行连续培养至稳定,并与野生型M.anisopliae进行比较。
提取稳定传代的swnR基因缺失菌株的基因组DNA,用引物L1/R2扩增相应片段,用以鉴定swnR基因是否敲除。
将回补重组pBAR质粒按照上述方法导入到突变菌株中,并采用重组质粒本身具有的草铵膦抗性基因,将转化子接种于含有2 mg·mL-1草铵膦的选择培养基中筛选回补菌株,并与野生型、突变型菌株进行比较。
1.6 swnR基因缺失菌株苦马豆素产量的检测
将野生型、稳定传代的突变型和回补型菌株接种于SDA培养基上,28 ℃避光培养7 d后采用“菌饼法”将6个菌饼(d=1 cm)接种于300 mL SDA液体培养基中,28 ℃ 180 r·min-1避光培养7 d后收集发酵液,用甲醇(发酵液∶甲醇=1∶1)除去发酵液中的糖分,分别收集等量的发酵液挥干得其浸膏,称取一定量的浸膏,加入800 mL甲醇及400 μL DMSO 溶解样本,将溶解好的样本用甲醇稀释10倍,后用0.22 μm的滤膜过滤其上清液,使用Q Exactive质谱仪(Thermo Fisher)分析提取物中的SW含量。
1.7 数据分析
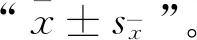
2 结 果
2.1 金龟子绿僵菌swnR基因突变和回补菌株的获得
将在含有300 μg·mL-1苯菌灵的再生上层培养基上生长的转化株接种于含有相同浓度苯菌灵的选择培养基上进行纯化培养,然后在有苯菌灵抗性的培养基上连续传代至获得稳定的突变菌株(图2)。然后采用真菌DNA提取试剂盒提取突变型菌株的DNA,以L1/R1为引物扩增相应的重组片段,并将回收的基因片段进行测序(图2E)。
2.2 金龟子绿僵菌swnR基因野生型、突变型和回补型菌株表型的观察及其苦马豆素产量的检测
将野生型(WT)和稳定传代的突变型(MT)、回补型(CT)菌株接种于SDA培养基上,28 ℃避光培养3、5、7和10 d,分别测量直径并拍照,结果显示,swnR基因的缺失并不影响菌株表型(图3A、B)。使用Q Exactive质谱仪检测野生型(WT)、突变型(MT)和回补型(CT)菌株发酵液中的苦马豆素含量,分别为(82.91±15.92)、(5.71±2.23)、(56.42±10.82) μg·mg-1,结果显示,swnR基因的缺失导致苦马豆产量显著下降,并且将swnR基因回补后,苦马豆素产量回升。
3 讨 论
研究显示,影响原生质体制备质量和丝状真菌再生的因素包括真菌的培养时间、培养基成分、酶解酶的选择、酶解的时间和温度等[20,27]。本研究在试验过程中发现,M.anisopliae在SDA培养基培养2 d后酶解产生的原生质体最多。据报道,M.anisopliae的细胞壁组成成分相当复杂[28],这意味着复合酶更有利于其原生质体的释放。而研究发现,M.anisopliae在使用1%蜗牛酶、1%纤维素和1%溶壁酶消化3 h后释放的原生质体数量达到最高这一事实也证明了这个理论。

原生质体制备及PEG介导swnR转化的最佳条件筛选(A~D)。A.原生质体(10×40);B.野生型菌株制备的原生质体在普通培养基上的形态;C.导入swnR缺失载体的原生质体在筛选培养基(添加300 μg·mL-1苯菌灵)上的状态;D.野生型菌株制备的原生质体在筛选培养基(添加300 μg·mL-1苯菌灵)上的状态;E.采用L1/R1引物扩增野生型(WT)、回补型(CT)和突变型(MT)基因的产物Screening for optimal conditions for protoplast preparation and PEG mediated swnR transformation (A-D).A.Protoplast of M.anisopliae;B.Protoplasts prepared from wild-type strains grown on common medium;C.Protoplasts with the vector of knocking out swnR gene grown on screening medium (added 300 μg·mL-1 benomyl);D.Protoplasts prepared from wild-type strains grown on screening medium (added 300 μg·mL-1 benomyl);E.PCR products using primers L1/R1 from WT,MT,and CT图2 swnR基因突变菌株的筛选Fig.2 Screening for the mutant strain of knocking out swnR gene

野生型、突变型和回补型菌株的生长形态(A)、速率比较(B)和相应发酵液中的SW含量(C)。数据表示为 **.P<0.01Phenotypic observation (A),growth rate determination (B) and Spectrometer detection of SW in fermentation broth (C) of MT,CT and WT.Data represented as n=3,**.P<0.01图3 野生型、回补型、突变型菌株菌株表型的观察及其SW产量的检测Fig.3 The phenotypic observation and the content of SW in fermentation broth of MT,CT and WT
Cook等[17]和Alhawatema等[18]分别证明了swnK基因及其同源基因pks是M.robertsii和S.leguminicola中SW生物合成通路中必需的,但是目前尚无M.anisopliae中SW生物合成相关基因的研究,本实验室前期研究发现,M.anisopliae的swnR基因在其SW生物合成通路中可能扮演着重要的角色[29]。为了进一步验证swnR基因在M.anisopliae的SW生物合成途径中的作用,构建以苯菌灵抗性基因为筛选标记的同源重组敲除载体,成功获得swnR基因缺失菌株,且其发酵液中SW含量显著降低,而Cook等[17]获得的swnK基因缺失的M.robertsii发酵液中未检测到SW,本研究中swnR基因缺失后,突变菌株SW产量显著降低,但未完全消失,其原因可能是M.anisopliae体内存在与swnR基因具有相同功能的催化酶基因。而SWN基因簇中的swnN基因和swnR基因可以编码同一种还原酶,且它们都存在于可产SW的真菌中,因此,swnN有可以提供与swnR基因类似活性的可能,从而使得swnR基因缺失时SW生物合成途径能够低效运转。这一试验结果进一步验证了Luo等[19]真菌中SW生物合成为多分支合成的结论。
为了证明突变菌株发酵液中SW含量的降低是由swnR基因的缺失造成的,本研究将野生型swnR基因回补到突变菌株中,发现回补菌株发酵液的SW含量有所恢复,但并未达到正常水平,Cook等[17]将野生型swnK基因回补到突变菌株后SW产量返高,这可能是由于swnK基因在回补菌株中的高表达所致。而本研究中回补菌株swnR基因条带较弱,说明导入突变菌株的回补质粒拷贝数较低,从而可能导致回补菌株苦马豆素产量无法恢复到野生菌株的水平,这一可能性在本研究回补菌株苦马豆素含量检测的结果中也被证实。
本研究还比较了稳定遗传的swnR基因突变型菌株与野生型菌株在表型上的区别,发现它们之间无显著差异,由此可见,swnR基因的缺失仅引起SW产量的显著下降,但不影响其正常生长。目前尚不清楚swnR基因的缺失是否会引起其他变化。
4 结 论
通过同源重组的方法获得swnR基因缺失的M.anisopliae菌株,并就突变菌株的SW产量及其表型变化进行研究,发现突变菌株的SW产量显著下降,而将swnR基因回补回突变菌株后,SW产量恢复显著,这表明swnR基因在M.anisopliae的SW生物合成途径中起重要作用,该研究为进一步探讨疯草内生真菌——棘豆链格孢菌的SW生物合成通路及相关的催化酶基因提供了重要的研究基础。
