外源性硫化氢的毒性机制及在动物体内代谢的研究进展
2021-05-28谢彦娇苗启翔张宏福唐湘方
谢彦娇,刘 真,陈 磊,苗启翔,张宏福,唐湘方
(中国农业科学院北京畜牧兽医研究所 动物营养学国家重点实验室,北京 100193)
硫化氢是一种无色、易燃、有臭鸡蛋气味,且具腐蚀性的剧毒气体[1]。自然界中,硫化氢主要来源于天然气、硫磺矿床、化工副产品、沼气和动物养殖场等[2-5]。它是畜禽养殖场恶臭气体的重要组成成分之一。由于硫化氢的比重比空气大,易溶于水,可在地沟或通风不畅的畜禽舍内蓄积[6]。研究表明,通常情况下猪舍内硫化氢浓度在7.5 mg·m-3以下[7]。但在清除粪便或搅拌粪坑时,可能会出现硫化氢的意外爆炸性释放的现象,硫化氢的浓度会急剧增加[8]。目前,关于硫化氢的研究主要集中在毒性及其作为气体信号分子对人体生理系统调节机制、内源性硫化氢的合成代谢过程与人类重大疾病的关系研究方面。硫化氢被认为是引发人吸入性死亡的第二大气体,仅次于一氧化碳[9]。浓度为45 mg·m-3的硫化氢会导致嗅觉疲劳和鼻腔功能障碍。浓度高于150 mg·m-3的硫化氢会导致头痛、头晕和呼吸衰竭,甚至会引发呼吸瘫痪、癫痫发作和意识丧失[10]。短暂接触高于750 mg·m-3浓度的硫化氢可能会立即致命[11]。但关于外源性硫化氢暴露对动物的影响机制及其在动物体内代谢规律的研究相对较少。因此,本文主要从外源性硫化氢的性质及毒性机制、外源性硫化氢对动物机体的危害、外源性硫化氢进入动物体内的途径和分布状况及新陈代谢等4个方面进行综述,以期为外源性硫化氢对畜禽健康影响机制研究提供参考,为动物健康养殖提供理论依据。
1 硫化氢性质及其毒性机制
硫化氢由两个氢原子和一个硫原子组成,化学分子式为H2S,其相对分子量为34.08,密度较空气大。硫化氢微溶于水,同时也具有脂溶性[12]。在37 ℃条件下,硫化氢易溶于溶解度约为80 mmol·L-1的水中[13]。溶于水后,能迅速达到H2S/HS-/S2-的平衡。研究发现,在生理pH为7.4和37 ℃时,19%的硫化物是H2S,近81%的硫化物是HS-[14],硫化氢气体和硫化氢阴离子这两种形式可以在血液和组织之间扩散[15]。
H2S被描述为有毒分子已有300多年的历史,但迄今仍缺乏有效预防和治疗硫化氢中毒的方法,因此,研究硫化氢毒性机制,对进一步阐明其损伤机制、毒理作用,提高预防和治疗水平具有十分重要的意义。研究表明,硫化氢可与组织中的碱性物质结合形成硫化钠,硫化钠具有腐蚀性,会对眼和呼吸道造成损伤,进入血液后释放硫化氢,继而引发急性肺炎或者肺水肿[16]。研究发现,硫化氢亦可使脑和肝中三磷酸腺苷酶活性降低,与体内谷胱甘肽(GSH)中的巯基结合,使谷胱甘肽失活,影响了体内生物氧化过程,加重了组织缺氧。肝细胞暴露于高浓度的NaHS(0.5 mmol·L-1)会导致细胞中的谷胱甘肽耗竭和迅速坏死[17]。同时,也有研究发现,当外界硫化氢的浓度过高,体内的游离硫化氢和硫化物来不及氧化时,硫化氢主要与呼吸链中细胞色素氧化酶中二硫键或Fe3+结合,使之失去传递电子的能力,造成组织细胞内窒息,尤以神经系统敏感,因此,硫化氢和一氧化碳、氰化物和叠氮化合物被归类为细胞窒息剂[18]。细胞色素氧化酶是氧化的末端酶,在调节细胞能量产生中起重要作用,抑制这些酶将导致氧化磷酸化的终止,而氧化磷酸化是三磷酸腺苷(ATP)合成的主要来源。因此,硫化氢导致氧化代谢的紊乱,继而会影响到对氧气需求较高的靶器官[19],细胞色素氧化酶活性的抑制被认为是硫化氢暴露的一个敏感的生物标志物[20]。综合上述研究发现,硫化氢吸收后主要与呼吸链中细胞色素氧化酶结合,影响细胞氧化过程,造成组织缺氧;与谷胱甘肽结合,促使脑和肝中的三磷酸腺苷酶活性降低,但具体的硫化氢对生物机体的损害作用及其作用机理尚不完全清楚,硫化氢具有较强的毒性作用,尤其是在猪等畜禽体内的毒物代谢动力学还有待进一步研究。
2 硫化氢对动物机体的危害
硫化氢中毒时会对机体造成危害,主要以神经系统和呼吸系统为主,也伴有心等多脏器的损伤。硫化氢通过呼吸系统进入肺泡,随后进入肺泡毛细血管,再由血液循环到达各种组织和器官[21]。需氧量高或黏膜暴露的组织,如呼吸、神经和心血管组织等,最容易受到低浓度硫化氢的影响,被认为是主要的靶器官[22]。气管组织形态学观察发现,肉仔鸡暴露在18 mg·m-3浓度的硫化氢下,气管黏膜变薄,纤毛长度变短脱落,黏液分泌增多[23]。肉鸡暴露在20 mg·m-3硫化氢浓度下,气管细胞凋亡[24]。Sprague-Dawley大鼠暴露在300 mg·m-3硫化氢浓度下,鼻腔呼吸道上皮损伤,鼻背内侧鼻腔嗅上皮神经元和支撑细胞呈对称急性阶段性坏死[25]。硫化氢吸入能激发炎症反应,引发呼吸爆发,释放大量的炎症介质和氧自由基,促发机体氧化应激反应,导致中毒性肺水肿。研究发现,肉鸡暴露在20 mg·m-3硫化氢浓度下,可触发NF-κB 途径诱导Th1/Th2失衡,抑制PPAR-γ/HO-1的抗炎作用,从而加重LPS诱导的肺炎[26]。断奶仔猪暴露在30 mg·m-3硫化氢浓度下,通过IL-17信号通路、铁质化和坏死等途径诱发肺部损伤[27]。在神经系统研究中发现,C57BL/6 J小鼠暴露在975~1 125 mg·m-3硫化氢浓度下,磁共振成像(magnetic resonance imaging,MRI)中发现下丘脑产生神经变性,小胶质细胞和星形胶质细胞会释放IL-1β和IL-18[28]。心是硫化氢中毒作用的重要靶器官之一,硫化氢中毒可导致横纹肌溶解和心肌损伤[29]。研究表明,肉鸡暴露在46 mg·m-3硫化氢浓度下,体内产生氧化应激,能量代谢紊乱,导致细胞凋亡,进而损伤心肌[30]。研究发现,硫化氢暴露亦会诱导鸡肝、空肠和法氏囊细胞凋亡[31-33]。综上,硫化氢会导致气管、肺、下丘脑和心等多脏器损害,打破氧化应激平衡状态,促进细胞凋亡,引发炎症,导致病理损伤甚至死亡。目前,硫化氢在畜禽上的研究多以肉鸡为模型,在猪上面的研究很少,而猪的呼吸系统与人的最为相似[34],因此,接下来应开展以猪为模式动物的研究,为人类吸入硫化氢的病理研究提供理论依据。
3 硫化氢的吸收及体内的分布规律
硫化氢是一种气态物质,吸入是其进入动物体内的主要方式[35]。硫化氢在吸入后经血液分布到全身,肺部是主要的吸收部位。早期的一项研究表明,暴露于硫化氢中的鱼类,其鳃中的硫化物浓度超过了大脑中的硫化物浓度,而且呼吸暂停先于心功能的丧失[36]。研究发现,雄性Wistar大鼠暴露于110 mg·m-3硫化氢浓度后,血液中硫化氮浓度为10 μg·mL-1,心中为37 μg·g-1,肾中为30 μg·g-1,脑中为25 μg·g-1,脾中为25 μg·g-1,肺中为20 μg·g-1,肝中为20 μg·g-1;且无论持续时间长短,其硫化氢分布比例基本不变[37]。Dorman等[38]将雄性CD大鼠暴露在浓度为14、42、112、280和560 mg·m-3的硫化氢环境中,检测其肝、肺、后脑、呼吸道上皮和嗅觉上皮硫化物的浓度,发现当硫化氢浓度低于112 mg·m-3时,仅在肝和肺检测到硫化物;当暴露于硫化氢浓度为280和560 mg·m-3时,均可检测到硫化物。从目前的研究可见,硫化氢在体内各个组织器官的分布无明显的规律特征,且相关研究较少,在畜禽体内的研究亦未见报道。因此,尚需建立健全统一规范的血液、组织或器官中硫化氢微痕量检测方法,对不同暴露浓度、不同暴露时间,对不同畜禽、不同部位的硫化氢开展系统研究,阐明硫化氢在畜禽体内的吸收、代谢和分布规律,为硫化氢暴露安全阈值的设定提供理论基础。
4 硫化氢在动物体内的分解代谢途径
硫化氢的代谢在毒理学和法医学研究方面具有非常重要的意义,较高浓度的硫化氢具有潜在毒性,可通过抑制细胞色素氧化酶破坏细胞呼吸作用。为防止毒性损害,根据特定的生理需求,机体不同的组织和器官会对硫化氢进行不同的调节。目前,硫化氢的分解代谢途径主要有以下几种方式(图1)。
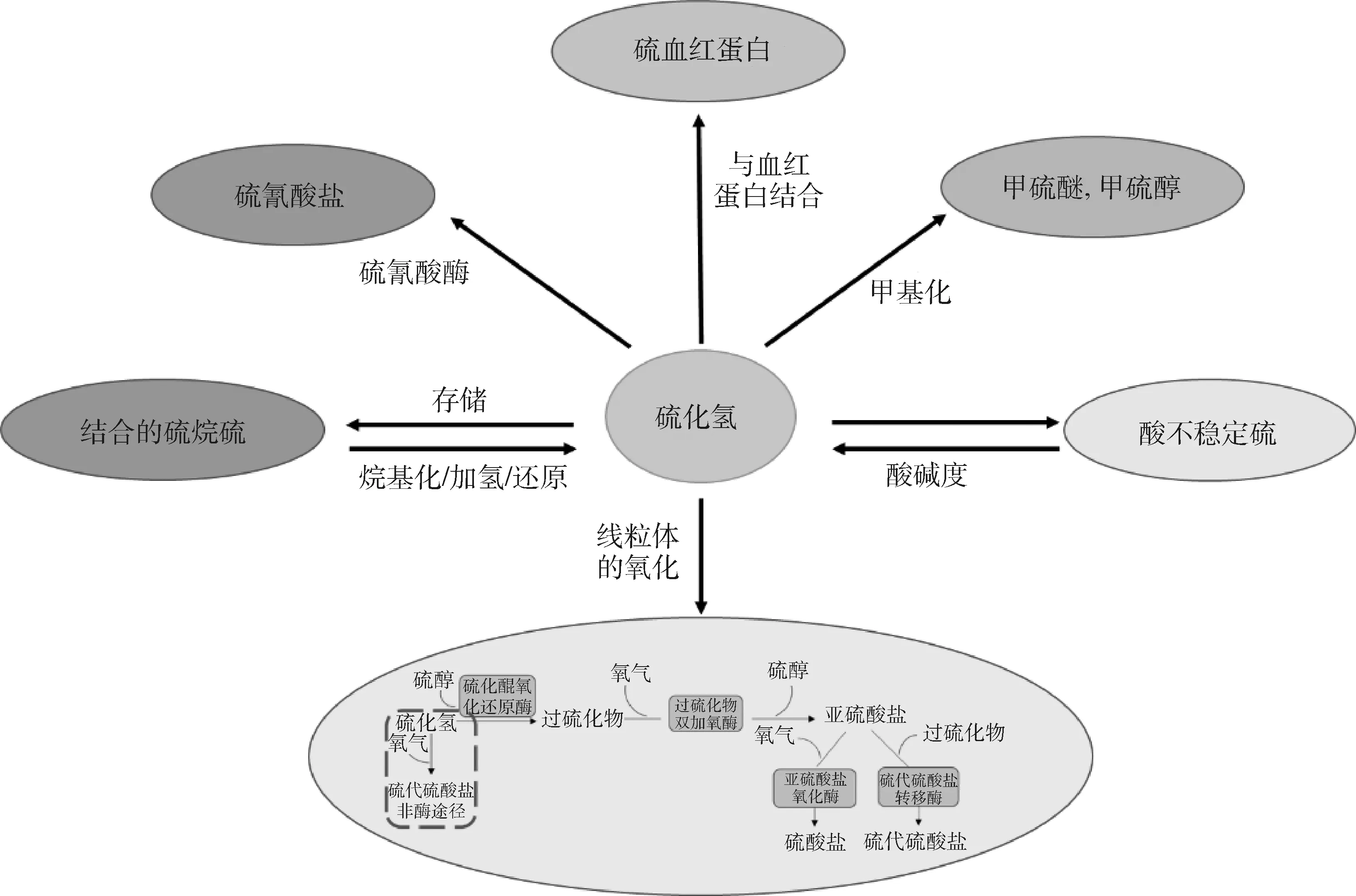
图1 硫化氢分解代谢的途径[39]Fig.1 Metabolic pathways of hydrogen sulfide[39]
4.1 氧化
肝、血液、肾和肠黏膜等组织器官中均会发生硫化氢氧化[40]。代谢标记法证明了硫化氢氧化为硫代硫酸盐和硫酸盐的能力[41]。硫化氢的氧化过程包括非酶促途径和酶促途径。在硫酸盐形成过程中,氧化的硫化氢与另一分子硫化氢结合,在线粒体中形成一分子硫代硫酸盐。这一步骤不需要任何酶,且已在分离的大鼠肾和肝中得到证实[42]。在线粒体中硫化氢氧化主要通过酶促反应进行,这一途径包括4种不同的、但功能相关的酶,它们共同协作催化硫化氢分解为硫代硫酸盐和硫酸盐。在硫化醌氧化还原酶(sulfide quinone oxidoreductase,SQR)的作用下将硫原子转移到硫醇(sulfur alcohol,RSH)上,这是催化线粒体氧化的第一步。然后,在过硫化物双加氧酶(persulfide dioxygenase,PDO)的作用下进一步氧化为亚硫酸盐(sulfite,SO32-)。亚硫酸盐可以被亚硫酸盐氧化酶(sulfite oxidase,SOX)氧化成硫酸盐(sulfate,SO42-),也可以被硫代硫酸盐硫转移酶(thiosulfate sulfur transferase,TST)还原成硫代硫酸盐(thiosulfate,S2O32-)[43]。在不同的组织中,线粒体氧化硫化氢为硫代硫酸盐和硫酸盐的速率有所不同[44]。线粒体氧化硫化氢的速率是由氧含量决定的。组织中硫化氢的稳态水平是通过有效的氧化来维持在较低的水平。然而,在氧气供应减少的情况下,硫化氢代谢被破坏,其浓度增加,因此其成为各种组织中重要的氧传感器。
4.2 与血红蛋白的相互作用
硫化氢与血红蛋白相互作用,生成硫血红蛋白[45]。研究发现,血液中高铁血红蛋白(methemoglobin,MetHb)和心中高铁肌红蛋白(metmyoglobin,MetMb)都能与硫化氢发生反应。因此,MetHb和MetMb可以作为硫化物清除剂,帮助清除有毒的硫化物,而不会干扰血红蛋白和肌红蛋白分别作为血液和心中氧气载体的功能[46-47](图2)。对在硫化氢暴露的环境(0~0.14 mg·m-3)中工作的人群进行研究时发现,硫化氢组的高铁血红蛋白浓度(3.07%)显著高于对照组(0.92%)[48]。成年Sprague-Dawley大鼠注射硫氢化钠(NaHS),血液中外源性硫化氢的减少或氧化是高铁血红蛋白在体内的主要作用[49]。综上,高铁血红蛋白与硫化氢的相互作用是一种可能的解毒途径[50]。
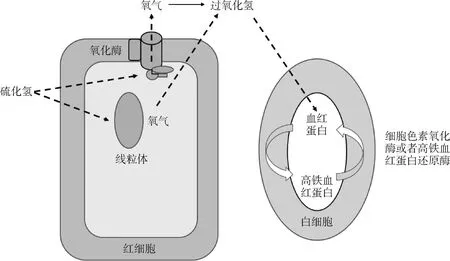
图2 硫化氢与蛋白质的相互作用[48]Fig.2 The interaction of hydrogen sulfide and protein[48]
4.3 甲基化
甲基化是硫化氢代谢和清除的二级机制。甲基化主要发生在细胞质中。硫化氢甲基化代谢的证据主要来自体外Sprague-Dawley大鼠肠黏膜的试验。硫醇-S-甲基转移酶催化硫化氢甲基化成为甲硫醇,甲硫醇又可以作为底物被硫醇-S-甲基转移酶催化为甲基硫醚[51]。硫醇-S-甲基转移酶分布较广,在盲肠、结肠黏膜、肝、肺以及肾中活性最高,在肠胃的其他部分、脾、心和骨骼肌中活性较低,粪便中无活性[52]。与硫化物氧化相比,硫化物甲基化缓慢。研究中发现,结肠黏膜中硫化氢甲基化的速度比硫化氢的氧化速度慢1万倍[53]。
4.4 排泄
硫化氢可以通过尿液或者呼气的方式排出体外。研究发现,家兔暴露在139~278 mg·m-3硫化氢浓度下,24 h后,尿液中检测到硫代硫酸盐[54]。对8名职业环境暴露于硫化氢的志愿者尿液进行检测发现,暴露前尿中硫代硫酸盐平均浓度为4.6 μmol·L-1,暴露后尿中硫代硫酸盐浓度上升至11.5 μmol·L-1,8名志愿者中有6名暴露于硫化氢后尿中硫代硫酸盐含量增加[55]。研究表明,静脉注射硫化钠后,呼出的气体中检测出大量硫化氢[56]。呼气可能为硫化氢的处理提供了路径。在感染性休克、失血性休克和慢性阻塞性肺病等病理条件下可在呼气中检测到硫化氢[57-59]。在健康人体内,肺泡中只含有0.038~0.076 mg·m-3的硫化氢[60]。然而,由于没有足够的数据支撑,目前尚不清楚在生理和病理情况下,有多少硫化氢通过尿液和呼气的方式流失。
综上所述,硫化氢在动物体内的分解代谢途径主要是通过线粒体的氧化作用。目前,对线粒体硫化物氧化途径的看法存在争议。线粒体硫化物氧化途径在介导硫化物、O2和其他气体递质之间复杂的相互作用中起着关键作用[61],这一途径的生理功能很可能远远超出了对硫化氢的清除。这一途径在特定生理或病理条件下对细胞生物能量学的影响,以及它产生生物活性硫代谢物(如硫代硫酸盐)的能力需要被更好地确定。对硫化氢分解代谢的了解,特别是对其在生理学和病理生理学中意义的了解,仍需更加系统和深入的研究。
5 展 望
目前研究认为,硫化氢在体内的积累可能会导致器官毒性,从而影响动物的健康水平。硫化氢在动物体内的代谢研究虽然已有相关报道,但仍有很多问题尚待深入研究,如外源性硫化氢在不同畜禽体内的吸收分布及代谢规律;低浓度(生理浓度)硫化氢对畜禽的生理调控机制;非生理浓度下硫化氢长期暴露对畜禽的影响机制及安全阈值;硫化氢急性暴露中毒及解毒机制;快速高效检测畜禽体内靶器官、组织中硫化物的方法等。
随着畜牧业的飞速发展,硫化氢作为畜禽舍中的主要废气,影响着农牧业生产活动、畜禽生长性能以及相关工作人员的健康。而目前关于畜禽舍内硫化氢的减排方面,较多研究集中在硫化氢的监测技术,今后的研究方向可从源头减排、养殖过程控制以及粪污终端处理等方面降低硫化氢的排放,有效避免硫化氢对动物机体的损害。
