瑞舒伐他汀联合重组人尿激酶原对急性心肌梗死的免疫改善及血清miR-133a、miR-208b表达的影响
2021-05-28赵晓宁刘志远南阳市中心医院心血管内科南阳473000
赵晓宁 刘志远 (南阳市中心医院心血管内科,南阳473000)
急性心肌梗死(acute myocardium infarction,AMI)具有发病急骤、病情进展迅速、预后差等特点,随病情进一步发展会诱发心律失常、心力衰竭或休克等并发症甚至死亡[1]。现阶段治疗AMI的关键在于尽快使冠状动脉复通,恢复心肌血流灌注,从而最大限度减轻心肌缺氧、缺血状态,避免心室功能损伤[2-3]。静脉溶栓是目前临床针对AMI患者首选治疗方案,而重组人尿激酶原作为尿激酶前体,具有溶栓起效迅速、冠状动脉再通率高、出血少等优势。近年来,随着炎症假说、免疫假说研究不断深入,发现炎症激活、免疫功能异常、不稳定斑块破裂在AMI发生、发展过程中起关键作用[4]。既往文献报道,他汀类药物在减轻炎症反应、抑制动脉粥样硬化进程、改善心室功能等方面具有良好作用[5]。然而关于瑞舒伐他汀联合重组人尿激酶原对AMI患者免疫功能、炎症反应的影响鲜有报道。基于此,本研究首次采用瑞舒伐他汀联合重组人尿激酶原,探讨其对AMI患者免疫功能及血清微小核糖核酸-133a(miR-133a)、miR-208b表达的影响。
1 资料与方法
1.1 资料
1.1.1 仪器与试剂 流式细胞仪购自中国科学院生物物理研究所;超声仪(型号:Philips Sonos 7500型)购自荷兰飞利浦公司;细胞间黏附分子-1(sI‐CAM-1)、IL-6试剂盒、酶联免疫吸附试验试剂盒购自上海信裕生物技术有限公司;三酰甘油(TG)、总胆固醇(TC)试剂盒购自上海语燕生物科技有限公司;高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)试剂盒购自深圳市雷诺华科技实业有限公司;血清超敏-C反应蛋白(hs-CRP)试剂盒购自上海研生实业有限公司;阿托伐他汀钙片(国药准字H20093819)购自北京嘉林药业股份有限公司;瑞舒伐他汀(国药准字H20143339)购自浙江海正药业股份有限公司;重组人尿激酶原(国药准字S20110003)购自天士力生物医药股份有限公司。
1.1.2 病例资料 应用前瞻性随机对照研究方法选取2017年6月至2019年11月我院AMI患者116例(表1),按随机数字表将患者分为观察组(n=58)、对照组(n=58)。两组基本资料[年龄、发病至入院时间、体质量指数(BMI)、性别、Killip分级、梗死部位、合并症]均衡可比(P>0.05)。

表1 两组一般资料比较Tab.1 Comparison of two groups of general information
1.1.3 纳入标准 ①符合《2016 NHFA/CSANZ临床指南:急性冠脉综合征的管理》[6]中AMI相关标准;②心电图至少两个相邻胸前导联ST段抬高≥0.2 mV或两个相邻肢体导联ST段抬高≥0.1 mV;③缺血性胸痛持续时间≥30 min,经硝酸甘油含服无效;④均为静脉溶栓治疗有效者;⑤患者及家属均签署知情同意书。
1.1.4 排除标准 ①既往有瑞舒伐他汀、重组人尿激酶原等药物过敏史者;②近期有冠状动脉介入及抗凝治疗者;③凝血功能紊乱或活动性出血者;④近14 d内有出血性脑卒中史或6个月内有出血性疾病者;⑤合并严重心肌病、心力衰竭或心律失常等心脏疾病者;⑥精神行为异常者。
1.2 方法
1.2.1 分组治疗 两组均接受吸氧、抑制血小板聚集、缓解血管痉挛等常规治疗。①对照组:予以阿托伐他汀钙片联合重组人尿激酶原治疗。静脉滴注注射用重组人尿激酶原,50 mg/次,先将20 mg加入至10 ml生理盐水内,并在3 min内静脉推注完毕,后将30 mg加入至90 ml生理盐水内,并于30 min内静脉滴注完毕。同时,AMI发病24 h内开始口服阿托伐他汀钙片,20 mg/次,qd。②观察组:予以瑞舒伐他汀联合重组人尿激酶原治疗。AMI发病24 h内开始口服瑞舒伐他汀,20 mg/次,qd,重组人尿激酶原方法参照对照组,连续治疗12周。
1.2.2 检测方法 空腹取6 ml静脉血:①采用流式细胞仪检测血浆CD8+、CD4+、CD4/+CD8+T水平;②3 000/rmin离心12 min,分离取血清,采用酶联免疫吸附试验检测血清可溶性细胞间黏附分子-1(sICAM-1)、白细胞介素-6(IL-6)水平;采用超敏乳胶增强免疫比浊法检测血清超敏-C反应蛋白(hs-CRP)水平;采用酶法检测甘油三酯(TG)、总胆固醇(TC)水平;采用直接测定法检测高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)水平;采用实时荧光定量聚合酶链反应(RT-qPCR)检测血清miR-133a、miR-208b水平,应用公式2-Δct计算miR-133a、miR-208b相对表达量。上述均严格按照仪器、试剂盒说明书操作。
1.2.3 疗效判定标准[7]经治疗,临床症状基本或完全消失,120 min内心电图抬高段下降>1/2,胸痛在120 min内缓解为显效;临床症状有所控制,胸痛明显缓解,120 min内心电图抬高段下降>1/2为有效;未达到显效、有效标准为无效。总有效率=显效率+有效率。
1.2.4 观察指标 ①疗效;②采用超声心动图检测对比两组治疗前、治疗12周后心功能[左室收缩末期内径(LVESD)、左室舒张末期内径(LVE DD)、左室射血分数(LVEF)];③对比两组治疗前、治疗12周后血清sICAM-1、IL-6、hs-CRP水平;④对比两组治疗前、治疗12周后血浆CD8+、CD4+、CD4/+CD8+水平;⑤对比两组治疗前、治疗12周后HDL-C、LDL-C、TG、TC水平;⑥对比两组治疗前、治疗12周后血清miR-133a、miR-208b水平。
1.3 统计学方法 采用SPSS22.0统计学软件处理数据,计量资料(心功能、sICAM-1、IL-6、hs-CRP、HDL-C、LDL-C、TG、TC、血 浆CD8+、CD4+、CD4/+CD8+T)以±s表示,进行t检验;计数资料(疗效)用n(%)表示,进行χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 疗效 经治疗,观察组总有效率93.10%略高于对照组81.03%,但组间比较,差异无统计学意义(P>0.05)。见表2。
2.2 心功能 两组治疗前LVESD、LVEDD、LVEF水平差异无统计学意义(P>0.05);两组治疗12周后LVESD、LVEDD水平较治疗前下降,且观察组低于对照组,LVEF水平较治疗前提高,且观察组高于对照组(P<0.05)。见表3。
2.3 血清炎症因子 两组治疗前血清sICAM-1、IL-6、hs-CRP水平差异无统计学意义(P>0.05);两组治疗12周后血清sICAM-1、IL-6、hs-CRP水平较治疗前下降,且观察组低于对照组(P<0.05)。见表4。
2.4 免疫功能 两组治疗前血浆CD8+、CD4+、CD4/+CD8+T水平差异无统计学意义(P>0.05);两组治疗12周后血浆CD8+T淋巴细胞水平较治疗前下降,且观察组低于对照组,血浆CD4+、CD4/+CD8+水平较治疗前增高,且观察组高于对照组(P<0.05)。见表5。

表2 两组疗效比较[例(%)]Tab.2 Comparison of efficacy between two groups[n(%)]
2.5 血脂 两组治疗前HDL-C、LDL-C、TG、TC水平差异无统计学意义(P>0.05);两组治疗12周后HDL-C水平较治疗前增高,且观察组高于对照组,LDL-C、TG、TC水平较治疗前降低,且观察组低于对照组(P<0.05)。见表6。
2.6 血清miR-133a、miR-208b 两组治疗前血清miR-133a、miR-208b水平差异无统计学意义(P>0.05);两组治疗12周后血清miR-133a、miR-208b水平较治疗前降低,且观察组低于对照组(P<0.05)。见表7。
表3 两组心功能比较(±s)Tab.3 Comparison of cardiac function between two groups(±s)

表3 两组心功能比较(±s)Tab.3 Comparison of cardiac function between two groups(±s)
Note:Compared with thisgroup beforetreatment,1)P<0.05.
TimeGroupsnLVESD(mm)LVEDD(mm)LVEF(%)Observation group5844.17±5.8458.49±8.6342.31±6.58 Control group5845.03±6.2559.24±9.1741.72±6.29 Beforetreatmentt0.7660.4540.494 P 0.4450.6510.623 Observation group5835.26±4.421)46.68±6.021)52.29±8.141)Control group5838.74±5.091)49.07±6.751)48.43±7.521)After 12 weeks of treatmentt3.9312.0132.653 P<0.0010.0470.009
表4 两组血清炎症因子比较(±s)Tab.4 Comparison of serum inflammatory factors between two groups(±s)

表4 两组血清炎症因子比较(±s)Tab.4 Comparison of serum inflammatory factors between two groups(±s)
Note:Compared with thisgroup beforetreatment,1)P<0.05.
TimeGroupsnsICAM-1(μg/L)IL-6(ng/L)hs-CRP(mg/L)Observation group58579.06±47.7442.97±5.169.68±1.45 Before treatmentControl group58586.98±51.8243.42±6.059.49±1.62 t 0.8610.4310.666 P 0.3910.6670.507 Observation group58382.79±36.121)29.64±4.221)5.38±0.731)Control group58409.56±42.431)35.01±4.761)6.12±0.811)After 12 weeksof treatmentt3.6596.4295.168 P<0.001<.001<0.001
表5 两组免疫功能比较(±s)Tab.5 Comparison of immune function between two groups(±s)
Note:Compared with thisgroup beforetreatment,1)P<0.05.
TimeGroupsnCD8(+%)CD4(+%)CD4/+CD8+Observation group5829.74±3.6833.25±4.421.12±0.35 Control group5830.63±3.4532.61±4.801.06±0.32 Beforetreatmentt1.3440.7470.964 P 0.1820.4570.337 Observation group5823.26±3.041)38.94±6.151)1.67±0.471)Control group5825.92±3.191)36.23±5.361)1.40±0.411)After 12 weeks of treatmentt4.5972.5303.297 P<0.0010.0130.001
表6 两组血脂比较(±s,mmol/L)Tab.6 Comparison of blood lipids between two groups(±s,mmol/L)
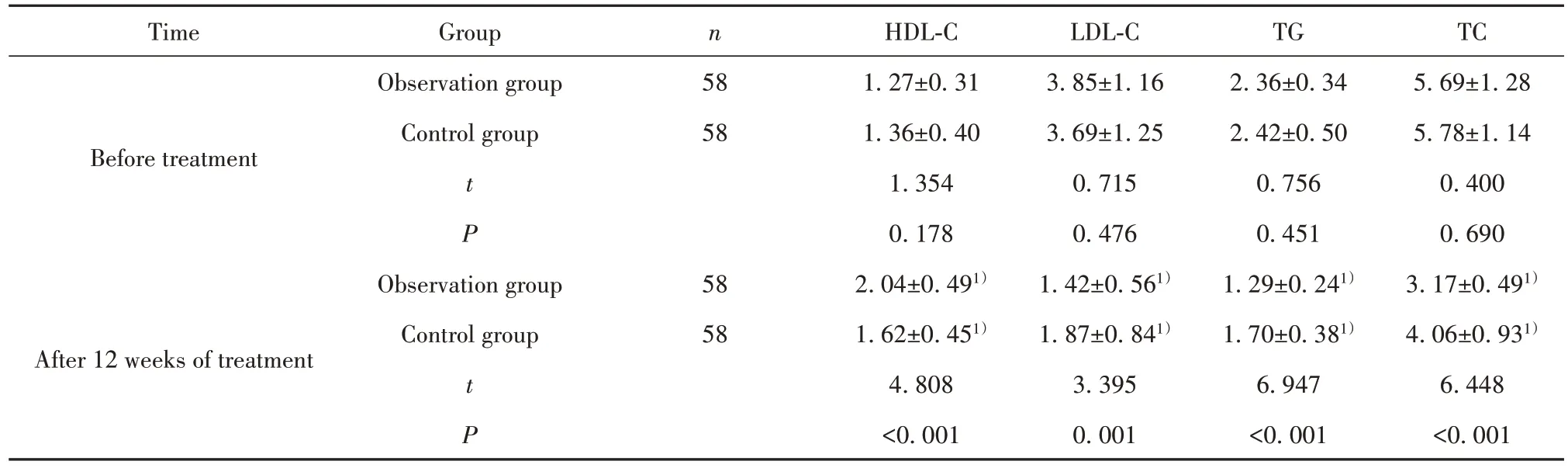
表6 两组血脂比较(±s,mmol/L)Tab.6 Comparison of blood lipids between two groups(±s,mmol/L)
Note:Compared with thisgroup beforetreatment,1)P<0.05.
TimeGroupnHDL-CLDL-CTGTC Observation group581.27±0.313.85±1.162.36±0.345.69±1.28 BeforetreatmentControl group581.36±0.403.69±1.252.42±0.505.78±1.14 t 1.3540.7150.7560.400 P 0.1780.4760.4510.690 Observation group582.04±0.491)1.42±0.561)1.29±0.241)3.17±0.491)Control group581.62±0.451)1.87±0.841)1.70±0.381)4.06±0.931)After 12 weeks of treatmentt4.8083.3956.9476.448 P<0.0010.001<0.001<0.001
表7 两组血清miR-133a、miR-208b比较(±s)Tab.7 Comparison of serum miR-133a and miR-208b between two groups(±s)
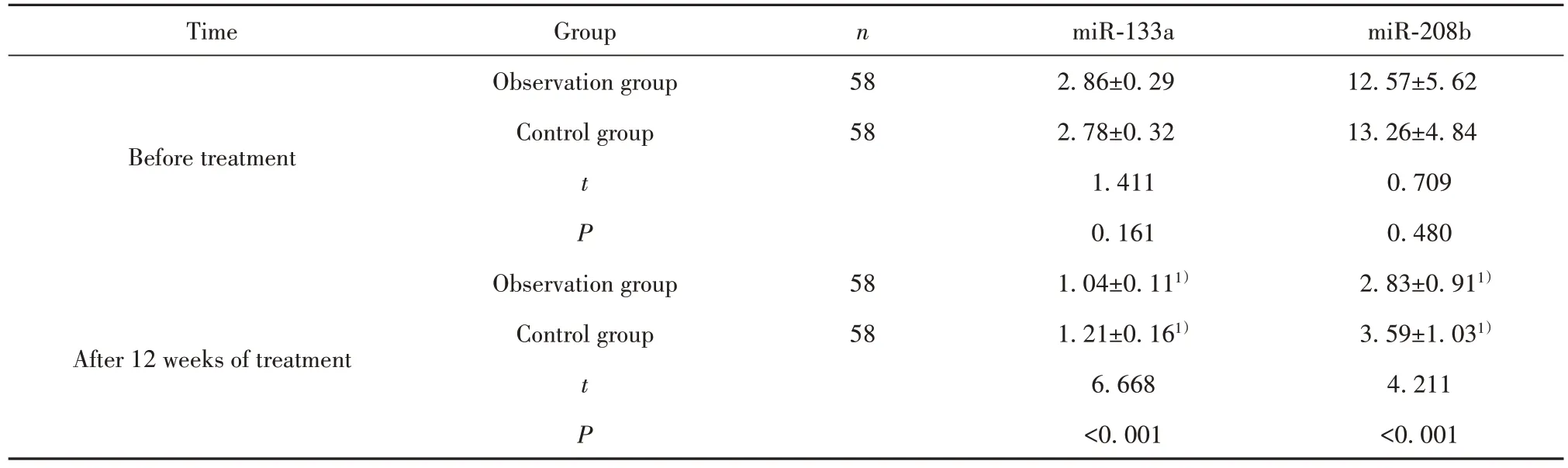
表7 两组血清miR-133a、miR-208b比较(±s)Tab.7 Comparison of serum miR-133a and miR-208b between two groups(±s)
Note:Compared with thisgroup beforetreatment,1)P<0.05.
TimeGroupnmiR-133amiR-208b Observation group582.86±0.2912.57±5.62 BeforetreatmentControl group582.78±0.3213.26±4.84 t 1.4110.709 P 0.1610.480 Observation group581.04±0.111)2.83±0.911)After 12 weeks of treatmentControl group581.21±0.161)3.59±1.031)t 6.6684.211 P<0.001<0.001
3 讨论
研究证明,动脉粥样硬化是AMI发生的主要病理基础,而血管内皮损伤是动脉粥样硬化的重要启动因素,与炎症反应过度激活、免疫功能紊乱等机制有关[8-10]。因此,抑制炎症反应、改善免疫功能、调节血液循环是治疗AMI的重点所在。重组人尿激酶原为既往临床治疗AMI患者的首选药物,能有效改善心肌灌注,但其存在严格适应证,且单一治疗部分患者整体疗效不甚理想。
赵艳军等[11]报道指出,血脂异常是AMI发生的重要危险因素,其中LDL-C水平高表达与冠状动脉粥样硬化发生存在正相关性。另外,周瑜等[12]研究表明,对AMI患者而言,发病1 d内及时采用他汀类药物有助于促进预后改善,明显降低心血管事件远期发生风险,但瑞舒伐他汀保护心脏功能的具体机制仍有待进一步证实。基于此,本研究针对AMI患者首次采用瑞舒伐他汀联合重组人尿激酶原治疗,结果显示,治疗12周后,观察组HDL-C水平高于对照组,LDL-C、TG、TC水平低于对照组,且总有效率可达93.10%。提示二者联合应用疗效确切,能明显调节血脂水平。瑞舒伐他汀具有“多向性效应”,可作用于血管内皮细胞,抑制平滑肌细胞增殖,降低巨噬细胞活性,合成一氧化氮合成酶,稳定斑块,调节血管内皮功能,同时其还能阻断细胞内经甲戊酸途径,减少胆固醇合成,反馈性调节LDL-C受体合成;重组人尿激酶原能加快纤溶酶合成,诱导尿激酶原向尿激酶转变,促进栓塞血块溶解;二者联合能发挥协同作用,强化治疗效果,降低LDL-C水平,提高低密度脂蛋白代谢能力,从而调节血脂。
同时,程敏菊等[13]认为,炎症反应过度激活为AMI发生实质,可进一步诱导易损斑块破裂,促使急性血栓形成。其中hs-CRP能促进动脉壁内皮细胞分泌促炎因子与黏附因子,参与冠状动脉粥样硬化的形成,可作为诊断AMI、评估心肌坏死程度的重要指标[14]。IL-6能控制炎症反应,缓解心肌炎症,发挥保护心肌的作用[15]。sICAM-1与AMI患者心肌损伤程度呈正相关性,可为评估AMI病情程度提供循证支持[16]。本研究数据表明,治疗12周后观察组血清sICAM-1、IL-6、hs-CRP水平低于对照组。瑞舒伐他汀能抑制程序性死亡因子表达,阻碍IL-6、hs-CRP等炎症介质释放,防止血小板聚集,联合重组人尿激酶原,有助于增强炎症介质释放抑制效果,减轻AMI患者炎症反应,预防冠状动脉狭窄、闭塞。FONSECA等[17]还发现,AMI发生后,坏死心肌细胞会释放大量抗原,诱导CD8+T淋巴细胞异常增殖,进而加重心肌损伤。本研究通过流式细胞仪检测发现,治疗12周后观察组血浆CD8+水平低于对照组,血浆CD4+、CD4/+CD8+水平高于对照组。提示瑞舒伐他汀联合重组人尿激酶原能明显调节AMI患者的免疫功能。进一步研究发现,瑞舒伐他汀联合重组人尿激酶原能有效抑制梗死范围扩大,防止缺血再灌注心肌细胞凋亡发生,继而缓解心肌氧化损伤,预防心室重构,延缓心脏纤维化进程,恢复心肌功能,保护心脏。
此外,miRNA具有改善心肌细胞的功能,参与多种心脑血管疾病的发生、发展,是诊断AMI的重要生物标志物[18-19]。miR-208b具有调控肌凝蛋白表达的作用,聂明攀等[20]认为,血清miR-208b水平在AMI患者呈异常高表达状态,并与肌酸激酶同工酶、肌钙蛋白Ⅰ存在正相关关系,可成为新的AMI诊断生物标志物。miR-133a对血管平滑肌细胞表型转换具有良好的调控作用,张松林等[21]通过绘制受试者工作特征曲线,表明miR-133a诊断AMI的曲线下面积为0.845,敏感度为84.5%,有望成为AMI诊断生物学标志物。进一步分析可知,观察组治疗12周后血清miR-133a、miR-208b水平明显低于对照组。表明重组人尿激酶原治疗联合瑞舒伐他汀能有效上调CD4+T淋巴细胞miRNA表达,调节缺血后心肌能量代谢,改善缺血区微循环,挽救可逆性心肌组织损伤,进而抑制血清miR-133a、miR-208b释放。
综上所述,瑞舒伐他汀、重组人尿激酶原联合治疗,疗效确切,能有效调节AMI患者血脂水平,拮抗炎症反应,抑制血清miR-133a、miR-208b释放,改善免疫功能,促进心功能恢复。然而本研究未进一步探讨瑞舒伐他汀联合重组人尿激酶原对AMI患者远期预后的影响,尚需进一步研究探讨。
