日本血吸虫表膜蛋白SjOST48 DNA疫苗的免疫保护作用研究①
2021-05-28肖楚丽邵阳学院医学检验学院邵阳422000
谭 潇 肖楚丽 肖 非 王 硕 (邵阳学院医学检验学院,邵阳422000)
日本血吸虫(Schistosoma japonicum,SJ)是一种严重危害人类健康的人畜共患寄生虫病,可导致肝、肠组织损伤,形成病理性虫卵肉芽肿和继发性肝纤维化[1-2]。虽然吡喹酮能有效治疗血吸虫病感染,但无法控制患者重复感染[3]。因此,疫苗研究依然是防控血吸虫病长期有效的策略。目前血吸虫病的疫苗研究主要经历了灭活疫苗、减毒活疫苗、亚单位疫苗、基因工程疫苗等,而且已经筛选出多种疫苗候选分子[3-6]。但是其免疫保护性并没有得到实际的临床应用。日本血吸虫病表膜蛋白(oligo‐saccharide transferase,SjOST48)是一种二磷酸寡糖转移酶,能够通过内质网膜催化高甘露糖型寡糖,进而参与锌蛋白质N-连接糖基化修饰过程[7-8]。目前这类蛋白质主要存在于外膜蛋白、分泌型蛋白和体液蛋白中,通常作为诊断抗原和治疗靶标[8]。LIU等[7]证实血吸虫重组表膜蛋白OST48具有较好的免疫原性,并且对血吸虫的生长发育具有重要作用,同时在小鼠体内产生了部分免疫保护作用。尽管如此,SjOST48重组蛋白作为免疫保护性抗原仍然存在一定问题,主要体现在免疫效力较弱,持续时间较短等。DNA疫苗作为一种新的疫苗接种策略主要是通过肌肉注射将质粒DNA注入到肌肉细胞中,从而诱导长期的体液和细胞免疫应答反应[9-10]。血吸虫病表膜蛋白OST48蛋白的DNA疫苗研究尚未报道。因此,本研究通过构建表膜蛋白OST48的DNA疫苗,肌肉注射到BALA/c小鼠,评估其免疫应答类型和抗血吸虫病感染的免疫保护效果,以期为血吸虫病临床疫苗的开发奠定基础。
1 材料与方法
1.1 材料 DNA质粒提取试剂盒购自Qiagen公司;6~8周龄雌性BALB/c小鼠购自湖南斯莱克景达有限公司(SCXK湘2016-0002);Lipofectamine 2000购自Invitrogen公司;Goat anti-mouse IgG、IgG1、IgG2a二抗购自Abcam公司;Mouse TNF-α、IFN-γ、IL-4和IL-10 ELISA试剂盒购自eBioscience公司;CCK-8试剂盒购自Dojindo公司;HeLa细胞、大肠杆菌E.coliBL21、血吸虫尾蚴的阳性钉螺和真核质粒pcDNA3.1(+)由南华大学病原生物研究所惠赠。
1.2 方法
1.2.1 OST48真核载体构建方法 依据参考文献[7]设计血吸虫病表膜蛋白OST48蛋白引物(上游引物:5′-GAAGAGCTCGAGGACAAGCGGAAAAAT-3′,下游引物:5′-GCGCTCGAGTTATTCACCCTTTTCT-3′),通过PCR扩增将OST48基因序列连接到pcDNA3.1(+)质粒上。将构建成功的真核质粒转入E.coilJM 109中培养,凝胶电泳鉴定成功后送至上海生工公司进行测序。
1.2.2 重组真核质粒转染HeLa细胞 将成功提取的质粒pcDNA3.1/SjOST48通过Lipofectamine 2000脂质体转染至HeLa细胞。48 h后加入蛋白裂解液,冰上孵育30 min,离心(4℃,13 000/rmin,15 min),收集细胞蛋白,Western blot检测pcDNA3.1/SjOST48在HeLa细胞中的表达情况。
1.2.3 动物免疫实验 6~8周龄雌性BALB/c小鼠(100只)随机分为5组:PBS组、pcDNA3.1(+)组、FA组、SjOST48重组蛋白组和pcDNA3.1/SjOST48组。每隔2周小鼠左后腿股四头肌肌肉注射相对应质粒100μg或者等剂量PBS并尾部静脉收集血清,共免疫3次,末次免疫2周后无菌分离小鼠脾淋巴细胞。本研究所有动物均得到邵阳学院动物福利审查委员会批准(批准文号:SYXK2015-0001)。
1.2.4 血清抗体检测 ELISA法检测各阶段免疫小鼠血清抗体水平,将SjOST48重组蛋白稀释后加入96孔ELISA检测板中[10μg/(ml·孔)],4℃ 过夜。将不同时间收集的小鼠血清倍比稀释(1:100)后作为一抗加入至96孔板中孵育2 h(37℃),每孔100μl。HRP标记的goat anti-mouse IgG、IgG1、IgG2a作为二抗(1:1 000)孵育1.5 h(37℃)。最后于450 nm处测定各孔OD值。
1.2.5 CCK-8法检测脾淋巴细胞增殖情况 将无菌分离的脾淋巴细胞以2×105个/孔接种于96孔板中。SjOST48重组蛋白(10μg/ml)刺激细胞。培养48 h(37℃,5%CO2)后每孔加入CCK-8溶液(10μl)继续培养4 h(37℃,5%CO2)后,于酶标仪450 nm处测定各组OD值。刺激指数(SI)=(刺激组OD值-空白组OD值)/(未刺激组OD值-空白组OD值)。
1.2.6 ELISA法检测脾淋巴细胞上清中的细胞因子 同法将收集的小鼠脾淋巴细胞以2×105个/ml加入24孔板中。SjOST48重组蛋白(10μg/ml)刺激细胞72 h后收集细胞上清,并按照细胞因子TNF-α、IFN-γ、IL-4、IL-10试剂盒说明书检测各免疫小鼠的细胞因子水平。
1.2.7 肝组织病理切片 末次免疫2周后血吸虫尾蚴感染小鼠,感染后6周麻醉处死小鼠,无菌分离肝脏组织后进行HE染色和Masson染色,显微镜下观察肝脏组织病理改变。采用UVP成像系统记录100倍视野中10个肉芽肿的面积。
1.2.8 小鼠肝脏减卵率计算 将上述无菌分离的肝脏组织(0.5 g)剪碎,溶于5%KOH溶液37℃水浴5 h,收集悬液(500μl),显微镜下计数虫卵数。肝脏减卵率(%)=(对照组平均肝虫卵数-免疫组平均肝虫卵数)/(对照组平均肝虫卵数)×100%。
1.3 统计学分析 采用GraphPad 5.0进行统计学分析。抗体水平、刺激指数、细胞因子水平以及肝脏减卵率等数据均以±s表示,组间数据采用单因素方差分析(Oneway-ANOVA)。P<0.05表示差异具有统计学意义。
2 结果
2.1 pcDNA3.1/SjOST48真核质粒载体构建和在HeLa细胞中表达 重组质粒pcDNA3.1/SjOST48的菌液PCR鉴定结果显示在1 248 bp处出现明显条带,与预期大小一致(图1A),并且测序结果与SjOST48基因序列一致(图1B)。将构建成功的真核质粒pcDNA3.1/SjOST48转染HeLa细胞后进行Western blot分析。结果显示在50 kD出现明显条带(图1C),说明pcDNA3.1/SjOST48重组质粒能够在真核细胞内稳定表达。

图1 重组质粒pcDNA3.1/Sj OST48的PCR与Western blot鉴定Fig.1 PCR and Western blot identification of recombi⁃nant plasmid pcDNA3.1/SjOST48
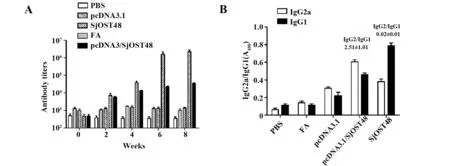
图2 免疫小鼠血清IgG以及IgG亚类水平Fig.2 Levels of serum IgG and IgG subclass in immu⁃nized mice
2.2 免疫小鼠血清中IgG及其亚类IgG1、IgG2a分泌水平 为了验证pcDNA3.1/SjOST48是否在小鼠体内诱导一定水平的体液免疫应答反应,通过检测不同时期血清中的抗SjOST48特异性抗体反应,其结果显示:免疫第2周即产生SjOST48特异性抗体,随后抗体水平逐渐增加,并在第8周达到最大(1:25 600)(P<0.05)(图2A)。 此 外 ,pcDNA3.1/SjOST48同样能够增强小鼠血清中IgG1、IgG2a分泌水平,且IgG2a/IgG1的比值均大于1(图2B)。
2.3 免疫小鼠脾淋巴细胞增殖水平 CCK-8法检测各实验组小鼠脾淋巴细胞增殖水平,图3所示,末次免疫2周后,pcDNA3.1/SjOST48免疫小鼠的脾淋巴细胞增殖指数(5.94±2.34)明显高于对照组(P<0.05)。
2.4 免疫小鼠脾淋巴细胞上清中细胞因子含量 图4结果显示pcDNA3.1/SjOST48免疫小鼠脾淋巴细胞上清中TNF-α、IL-10和IFN-γ含量显著增加(P<0.05)。与此相反的是IL-4的分泌水平与对照组相比无统计学意义(P>0.05)。进一步证明了pcD‐NA3.1/SjOST48能诱导Th1型细胞免疫反应。
2.5 HE染色法检测小鼠肝脏病理变化及虫卵数量 为了检测pcDNA3.1/SjOST48是否能提供保护性免疫,控制血吸虫病的感染,我们对血吸虫感染后小鼠的肝脏进行病理切片分析(图5)。结果显示,pcDNA3.1/SjOST48免疫小鼠的肝脏肉芽肿体积明显小于PBS组及SjOST48重组蛋白组,并且肉芽肿的数量也明显少于对照组;pcDNA3.1/SjOST48组的肝脏炎症浸润情况较对照组明显减轻,只有少量的嗜酸性粒细胞和淋巴细胞浸润;通过对虫卵数量的计数发现pcDNA3.1/SjOST48免疫小鼠的肝脏虫卵数量也明显少于对照组(表1),表明pcDNA3.1/SjOST48能显著增强SjOST48的免疫保护作用,有效控制血吸虫病的感染。

图3 免疫小鼠脾淋巴细胞增殖水平Fig.3 Level of lymphocyte proliferation in immunized mice
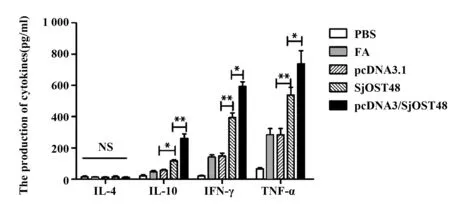
图4 免疫小鼠脾细胞上清细胞因子检测Fig.4 Levels of cytokines in spleen cell supernatant of im⁃munized mice
表1 各组小鼠减虫率及肝组织减卵率(±s,n=15)Tab.1 Worm and egg reduction rates of mice in each group(±s,n=15)

表1 各组小鼠减虫率及肝组织减卵率(±s,n=15)Tab.1 Worm and egg reduction rates of mice in each group(±s,n=15)
Note:Compared with control group(PBSand pcDNA 3.1),1)P<0.05.
GroupsWorm burdenWormreductionAveragenumber of eggsLiver egg rate(%)per gram liver tissue(×104)reduction rate(%)PBS26.63±3.41-36.86±6.25- pcDNA3.125.83±2.45-36.32±4.31- FA25.31±3.62-35.61±3.56-SjOST4820.36±2.1523.541)28.63±3.6522.331)pcDNA3.1/SjOST4818.06±1.2111.301)23.67±2.5435.781)
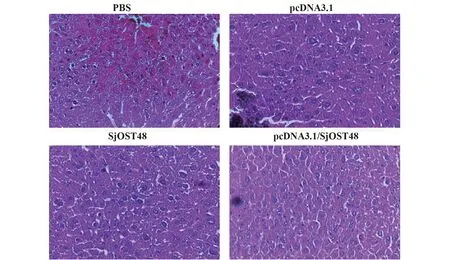
图5 各组小鼠肝脏病理变化(HE染色,×40)Fig.5 Histopathological changes in the liver after Schisto⁃soma japonicum infection in mice(HE,×40)
3 讨论
目前国内临床上针对血吸虫病的感染主要以抗生素治疗为主,但是重复感染病例依然很严重,单靠药物治疗并不能有效控制血吸虫病传播[3,13]。因此,疫苗研究依然是防控血吸虫病传播的首选策略。LIU等[7]证实SjOST48蛋白主要位于血吸虫表膜,并且作为寡糖转移酶,在血吸虫虫卵生殖和病理损伤方面发挥着重要作用。同时在小鼠体内也能诱导一定水平的免疫原性和免疫保护性。然而,这种重组抗原的免疫原性往往较差,而且不能产生免疫保护所需的免疫应答类型,限制了其在临床中的应用。DNA疫苗能诱导机体产生体液和细胞介导的免疫应答反应,目前已用于多种传染病动物模型的保护性研究[9,14]。而本研究通过构建SjOST48 DNA疫苗来增强其免疫保护性效果,以期能在血吸虫病疫苗的研制中提供理论基础。
本次实验中我们同样证实了SjOST48重组蛋白具有一定的保护性,能控制血吸虫病的感染,但是其免疫保护效果并不理想。而血吸虫疫苗产生的体液免疫在抗血吸虫病过程中发挥的作用并不明显,相反长期的保护性免疫主要依赖于Th1型细胞免疫反应[4,15]。检测抗体亚类结果显示,pcDNA3.1/SjOST48免疫小鼠血清中IgG2a/IgG1的比值均大于1,表明SjOST48的DNA疫苗能诱导Th1型细胞免疫反应。以往研究证明,Th2型免疫应答反应参与了血吸虫病的免疫病理损伤,能够促进组织肉芽肿形成[12,16]。 此 次 实 验 中pcDNA3.1/SjOST48诱 导 的Th1型细胞免疫应答反应抑制了Th2型细胞免疫,因此减轻了血吸虫病肝脏的病理损伤,相较于重组SjOST48蛋白,DNA疫苗的免疫保护性更加明显。研究表明Th1型细胞因子介导的免疫保护性是血吸虫病清除的主要机制[11-12]。LIU等[17]发现Th1型细胞因子TNF-α能够募集大量的炎症细胞介导肉芽肿形成而清除虫卵。TNF-α主要是由单核细胞和巨噬细胞等先天免疫细胞分泌的细胞因子[18]。而pcDNA3.1/SjOST48免疫小鼠脾淋巴细胞上清中存在大量的TNF-α,因此说明SjOST48 DNA疫苗可能激发了先天免疫应答反应,从而促进宿主早期清除血吸虫病感染。也有文献指出血吸虫病患者血清中能检测到大量Th1型细胞因子(IFN-γ、TNF-α、IL-6和IL-10),并且也证实这些细胞因子参与宿主体内血吸虫清除[15]。而pcDNA3.1/SjOST48免疫小鼠体内INF-γ、IL-10和TNF-α的大量分泌以及IL-4分泌水平无统计学意义,进一步说明SjOST48 DNA疫苗能诱导Th1型细胞免疫反应。INF-γ是早期清除血吸虫病感染最主要的Th1型细胞因子,能够活化T淋巴细胞和巨噬细胞[11]。本研究中,pcDNA3.1/SjOST48免疫小鼠肝脏的病理切片中肉芽肿数量及面积明显少于对照组。说明SjOST48 DNA疫苗诱导的Th1型细胞免疫保护性明显优于重组蛋白SjOST48。DNA疫苗虽然能同时诱导体液和细胞免疫,产生较强的免疫应答反应,但其免疫应答强度和稳定性受多方面的影响[19]。佐剂一直是疫苗研究的热点,和重组抗原一样,DNA疫苗也能通过佐剂增强免疫效果和稳定性。因此,在未来研究中我们将重点探索SjOST48 DNA疫苗的佐剂筛选。
综上所述,SjOST48 DNA疫苗能够诱导高水平的特异性SjOST48抗体,并且能诱导Th1型细胞免疫应答,显著增强其抗血吸虫病感染的保护作用,为研制预防和控制抗血吸虫病感染的DNA疫苗奠定基础。但是DNA疫苗免疫原性和稳定性的多方面影响仍然需要我们对其免疫保护机制进行更为深入的研究。
