湿热中阻方对脾胃湿热证小鼠氧化应激和炎症因子影响研究
2021-05-28段继昌柴晶美周丽雅
段继昌,曹 路,柴晶美,魏 岩,周丽雅
(长春中医药大学基础医学院,长春 130117)
近年来,随着高脂、高糖等饮食摄入的增加,脾胃湿热证的患者逐年增多。湿热中阻方是周丽雅教授临床治疗脾胃湿热证的自拟方,临床治疗多种与脾胃湿热相关的疾病取得了良好的临床疗效。脾胃湿热证主要有脘腹痞闷、厌食油腻、呕恶纳呆、大便臭晦黏腻、小便黄、苔腻等症状,常见于慢性乙型肝炎[1]、慢性胃炎[2]、胃癌[3]、肝癌[4]、溃疡性结肠炎[5]等多种消化系统疾病,具有病机复杂、缠绵难愈、治疗难度大等特点[6]。研究[7]显示,脾胃湿热证的发病机制与炎症病变密切相关。炎症反应是一种自我防御过程,但过度的炎症反应会对机体造成损伤,引发疾病。现代研究[8-10]表明,脾胃湿热证的脾胃组织存在大量炎症浸润和不同程度的ROS 损伤,氧化应激可能是引起脾胃功能病变的原因之一。
1 材料与方法
1.1 实验动物 选取6~8 周龄,SPF 清洁级昆明小鼠60 只,体质量18~20 g [辽宁长生生物科技有限公司,许可证号SCXK(辽)2019-005]。
1.2 药物及主要试剂 湿热中阻方方药组成:黄连10 g,姜厚朴15 g,制半夏10 g,淡豆豉10 g,焦栀子15 g,石菖蒲15 g,海螵蛸15 g,白及10 g,瓦楞子15 g,芦根30 g,长春中医药大学附属医院;RIPA 裂解液(P0013B),BCA 蛋白浓度测定试剂盒(P0012S),活性氧检测试剂盒(DCFH-DA,S0033M),上海碧云天生物技术有限公司;乳酸脱氢酶试剂盒(LDH,A020)、超氧化物歧化酶测定试剂盒(SOD,A001)、丙二醛测定试剂盒(MDA,A003)、谷胱甘肽过氧化物酶测定试剂盒(GSH-Px)、过氧化氢酶测定试剂盒(CAT,A007),南京建成生物有限公司;白介素-6(IL-6,BMS603HS)、肿瘤坏死因子(TNF-α,BMS607HS),赛默飞世尔科技(中国)有限公司;羊抗兔IgG [Goat Anti-Rabbit IgG(H+L)HRP,ZJ2020-R]、羊抗鼠IgG [Goat Anti-Mouse IgG(H+L)HRP,ZJ2020-M],Bioworld Technology 公司;极超敏ECL 化学发光即用型底物(AR1191),武汉博士得生物工程有限公司;引物序列(COX2、iNOS、HO-1、β-Actin),生工生物工程(上海)股份有限公司;p-P38MAPK(4511)、p-NF-κB(3039)、p-IKBα(2859)、HO-1(43966)、GAPDH(5174),Cell Signaling Technology(CST)公司。
1.3 方法
1.3.1 药物制备 湿热中阻方按照《医疗机构中药煎药室管理规范》的煎煮方法制备,药液低温浓缩至每1 mL 药液中含生药量1.2 g(根据《中药药理学》人鼠等效剂量换算),4 ℃冰箱中保存备用。
1.3.2 分组与造模 小鼠适应性饲养1 周后,区分雌雄,随机分成6 组,分别为空白组,湿热模型组,黄芩滑石汤组,湿热中阻方低、中、高剂量组,每组10只,雌雄各半。空白组普通饲料喂养,实验组予高脂高糖饲料喂养,即在普通饲料喂养的基础上,加用200 g/L 蜂蜜水自由饮用,且隔日按小鼠体质量灌服油脂10 g/kg,并与油脂隔日灌服10 mL/kg 白酒(红星二锅头56°,北京红星股份有限公司),共30 d。
1.3.3 动物给药 空白组:常规饲养,每日10:00 定时投放食物和水,温度25~28℃、湿度70%~80%。湿热模型组:采用内因湿热法造模,在造模之前12 h开始禁食不禁水。用高脂高糖饲料和蜂蜜水喂食。造模成功后,生理盐水灌胃,每日1 次。湿热中阻方低、中、高剂量组:造模成功后,予小鼠湿热中阻方灌胃,每日1 次。阳性药组:造模成功后,黄芩滑石汤灌胃,每日1 次。共治疗7 d。给药期间自由进食、饮水。每天观察其一般情况,记录精神状态、进食、活动和大便情况。
1.3.4 标本采集 取材前1 天开始禁食不禁水,取材前禁食24 h。眼球取血1 mL,静置1 h 后以3 000 r/min离心10 min,取上层血清置于EP 管中,于-20℃冰箱中保存待测。小鼠眼球取血后,脱颈处死,剪取胃窦,上述组织各取一半置于4%多聚甲醛溶液中固定24 h 以上,另一半置于液氮中冷冻保存。
1.4 指标检测
1.4.1 一般情况观察 观察小鼠的生理状况,如精神状态、皮毛色泽、活动度、大便性状等。每日测量小鼠的肛温和体质量,进食量和进水量。
1.4.2 iNOS mRNA、HO-1 mRNA、COX-2 mRNA 表达水平测定 1)取胃组织加入匀浆管中,加入4 ℃的RNA later;加入250 μL 三氯甲烷,在低温环境下,以12 000 r/min 离心10 min,取上清液,加入异丙醇,-20℃放置15 min。在低温环境下,继续以12 000 r/min 离心10 min,收集管底白色沉淀物,即为总RNA。2)引物:引物序列见表1。3)荧光定量PCR:取7.5 μL 反应体系于95 ℃ 10 min,95 ℃ 15 s,60 ℃ 60 s 扩增40 个循环,扩增后对产物作溶解曲线,每个样本重复3 次。

表1 PCR 引物序列表
1.4.3 血清生化指标检测 取胃组织约0.5 g,冷生理盐水冲洗,滤纸吸干,称定质量,剪碎,冰浴匀浆,制成10%组织匀浆,4 000 r/min 低温离心10 min,取上清液待测。取离心后的上层血清,按照试剂盒说明书检测血清中SOD、MDA、CAT、GSH-Px、IL-6、TNF-α、LDH、ROS 的含量。
1.4.4 Western blot 法分析胃窦p-P38MAPK、p-NF-κB、p-IKBα 表达水平 取胃窦组织,用预冷的PBS 洗涤2~3 次,裂解液裂解,12 000 r/min,4 ℃,离心10 min,收集上清液待测。将蛋白溶液按照4:1 的比例加入还原型蛋白上样缓冲液,沸水浴15 min 变性,灌胶后加入SDS-PAGE 电泳,将蛋白转印到PVDF 膜上。将转印完的膜放入TBST 孵育槽中,室温下封闭30 min,加入相应一抗4 ℃孵育过夜,再加二抗室温孵育30 min,ECL 显色,拍照。Alpha 软件分析结果。
1.5 统计学方法 运用SPSS 25.0软件进行统计分析,数据均以均数±标准差()表示,组间比较采用单因素方差分析,以P<0.05 表示差异有统计学意义。
2 结果
2.1 小鼠一般状况 空白对照组小鼠精神状态良好,皮毛有光泽,反应灵敏,活动自如,大便正常。湿热模型组小鼠出现嗜睡懒动,反应迟钝,皮毛无光泽,大便溏腻等表现。湿热中阻方治疗后,上述症状逐渐改善。
2.2 湿热中阻方对LDH释放的影响 与空白对照组比较,湿热模型组小鼠LDH释放量显著升高(P<0.001),LDH 是胃肠组织损伤的标志物,说明脾胃湿热模型形成;与湿热模型组比较,湿热中阻方中、高剂量组小鼠LDH 释放量明显降低(P<0.05,P<0.01);湿热中阻方低剂量组LDH 释放量明显降低,但无显著性差异;与湿热模型组比较,阳性药组LDH 释放量显著降低(P<0.001)。结果表明,湿热中阻方能够抑制脾胃湿热引起LDH 的释放,缓解胃肠组织损伤。见图1。

图1 湿热中阻方对LDH 释放的影响
2.3 湿热中阻方对ROS 释放的影响 与空白对照组比较,湿热模型组ROS 生成显著上升(P<0.001);与湿热模型组比较,湿热中阻方低、中、高剂量组ROS生成受到显著抑制(P<0.05,P<0.05,P<0.01),阳性药组ROS 生成量受到显著抑制(P<0.001)。结果表明,湿热中阻方可以降低脾胃湿热刺激的胃细胞内ROS的水平,调节胃细胞氧化还原体系的平衡。见图2。

图2 湿热中阻方对ROS 释放的影响
2.4 湿热中阻方对氧化应激因子CAT、GSH-Px、MDA、SOD 释放的影响
2.4.1 湿热中阻方对CAT 释放的影响 与空白对照组比较,湿热模型组CAT 生成量明显降低(P<0.001);与湿热模型组比较,湿热中阻方中、高剂量组CAT 生成量明显升高(P<0.001);湿热中阻方低剂量组CAT 生成量明显升高(P<0.05);阳性药组CAT 生成量显著升高(P<0.001)。结果表明,湿热中阻方可以升高体内CAT 的生成量,增强对自由基的清除能力,抑制氧化应激。见图3。
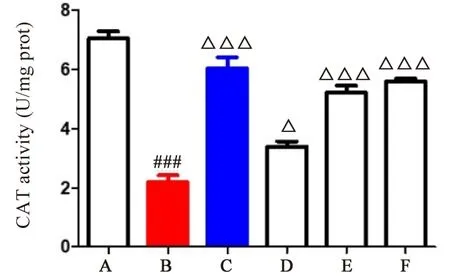
图3 湿热中阻方对CAT 释放的影响
2.4.2 湿热中阻方对GSH-Px 释放的影响 与空白对照组比较,湿热模型组GSH-Px 生成量明显降低(P<0.001);与湿热模型组比较,湿热中阻方高剂量组GSH-Px 生成量明显升高(P<0.01);湿热中阻方低、中剂量组GSH-Px 生成量明显升高,但无显著性差异;阳性药组GSH-Px 生成量明显降低(P<0.001)。结果表明,湿热中阻方可以升高体内GSH-Px 的生成量,增强对自由基的清除能力,抑制氧化应激。见图4。
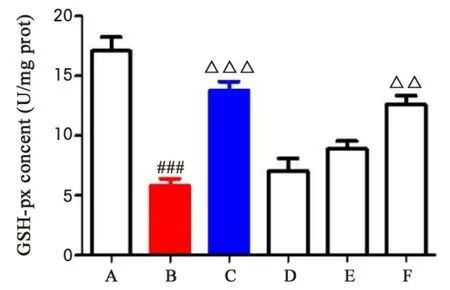
图4 湿热中阻方对GSH-Px 释放的影响
2.4.3 湿热中阻方对MDA 释放的影响 与空白对照组比较,湿热模型组MDA生成量明显升高(P< 0.05),说明氧化自由基产生增加,抗氧化能力减弱;与湿热模型组比较,湿热中阻方高剂量组MDA 生成量明显降低(P<0.05);湿热中阻方低、中剂量组MDA 生成量明显降低,但无显著性差异;阳性药组MDA 生成量受到显著抑制(P<0.05)。结果表明,湿热中阻方可以抑制脾胃湿热证引起的机体脂质过氧化程度,抑制氧化应激。见图5。

图5 湿热中阻方对MDA 释放的影响
2.4.4 湿热中阻方对SOD 释放的影响 与空白对照组比较,湿热模型组SOD 生成量明显降低(P<0.001);与湿热模型组比较,湿热中阻方中、高剂量组SOD 生成量明显升高(P<0.01,P<0.001);湿热中阻方低剂量组SOD 生成量明显降低,但无显著性差异;阳性药组SOD 生成量受到显著抑制(P<0.001)。结果表明,湿热中阻方可以升高体内SOD 的生成量,增强对自由基的清除能力,抑制氧化应激。见图6。

图6 湿热中阻方对SOD 释放的影响
2.5 湿热中阻方对炎症因子IL-6、TNF-α 释放的影响 与对照组比较,湿热模型组IL-6、TNF-α 释放量显著升高(P<0.01),说明脾胃湿热证小鼠体内炎症因子含量升高;与湿热模型组比较,湿热中阻方高剂量组IL-6、TNF-α 释放量显著降低(P<0.01,P<0.05),湿热中阻方中剂量组IL-6、TNF-α 释放量显著降低(P<0.05),湿热中阻方低剂量组IL-6、TNF-α释放量明显降低,但无统计学差异;与湿热模型组比较,阳性药组IL-6、TNF-α释放量显著降低(P<0.01)。结果表明,湿热中阻方能降低炎症因子的含量,减轻炎症反应。见图7。

图7 湿热中阻方对IL-6、TNF-α 释放的影响
2.6 湿热中阻方对iNOS mRNA、HO-1 mRNA、COX-2 mRNA 表达的影响
2.6.1 湿热中阻方对iNOS mRNA 表达的影响 与空白对照组比较,湿热模型组iNOS mRNA 的表达量显著升高(P<0.001);与湿热模型组比较,湿热中阻方高剂量组的表达量显著降低(P<0.001);湿热中阻方中剂量组的表达量显著性降低(P<0.01),湿热中阻方低剂量组的表达量明显降低,但无显著性差异;与湿热模型组比较,阳性药组的表达量显著降低(P< 0.001)。结果表明,湿热中阻方能抑制炎症介质iNOS mRNA 的表达,减轻炎症反应。见图8。

图8 iNOS mRNA 的表达量
2.6.2 湿热中阻方对HO-1 mRNA 表达的影响 与空白对照组比较,湿热模型组HO-1 mRNA 表达量显著升高(P< 0.001);与湿热模型组比较,湿热中阻方高剂量组表达量显著降低(P<0.01);湿热中阻方低、中剂量组表达量明显降低,但无显著差异;与湿热模型组比较,阳性药组表达量显著降低(P<0.01)。结果表明,湿热中阻方能抑制炎症介质HO-1 mRNA的表达,减轻炎症反应。见图9。
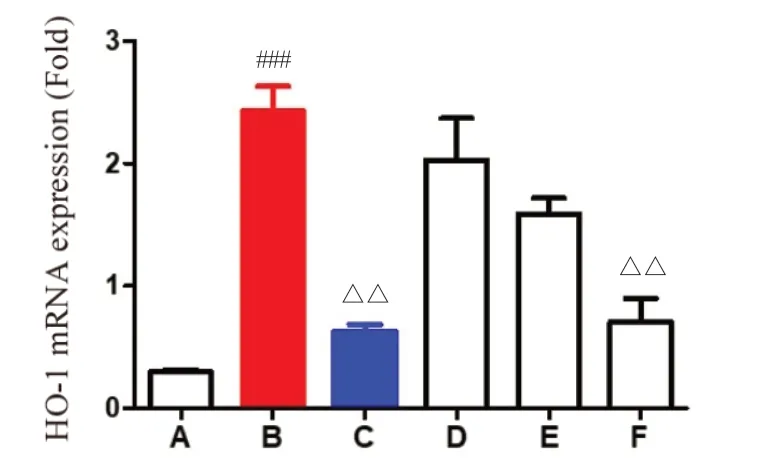
图9 HO-1 mRNA 的表达量
2.6.3 湿热中阻方对COX-2 mRNA 表达的影响 与空白对照组比较,湿热模型组COX2 mRNA 的表达量显著升高(P<0.001);与湿热模型组比较,湿热中阻方高剂量组的表达量显著性降低(P<0.01),湿热中阻方中剂量组的表达量显著降低(P<0.05),湿热中阻方低剂量组的表达量明显降低,但无显著性差异;与湿热模型组比较,阳性药组的表达量显著降低(P<0.001)。结果表明,湿热中阻方能抑制炎症介质COX2 mRNA 的表达,减轻炎症反应。见图10。

图10 COX2 mRNA 的表达量
2.7 湿热中阻方对蛋白表达的影响 与空白对照组比较,湿热模型组小鼠P-p38MAPK、P-NF-κB、P-IKBα蛋白表达量显著升高(P<0.001);与湿热模型组比较,湿热中阻方高剂量组蛋白表达量均显著降低(P<0.01,P< 0.001,P<0.001);与湿热模型组比较,湿热中阻方中剂量组P-p38MAPK、P-IKBα 蛋白表达量显著降低(P< 0.05,P<0.001),对P-NF-κB 的蛋白表达量无显著差异(本数据有明显错误,故排除);与湿热模型组比较,湿热中阻方中、高剂量组P-NF-κB、P-IKBα 蛋白表达量显著降低(P<0.001),P-p38MAPK 蛋白的表达量无显著差异;与湿热模型组比较,阳性药组蛋白表达量均显著降低(P<0.01,P<0.001,P<0.001)。结果表明,湿热中阻方能抑制p38MAPK、NF-κB、IKBα 信号通路,降低活化的P-p38MAPK、P-NF-κB、P-IKBα 含量。见图11,表2。

图11 湿热中阻方对P-p38MAPK、P-NF-κB、P-IKBα蛋白表达的影响
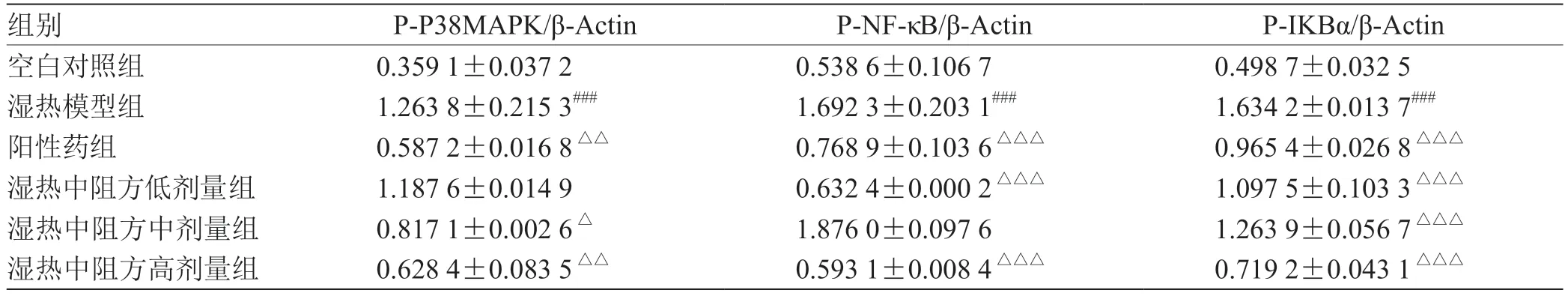
表2 湿热中阻方对P-p38MAPK、P-NF-κB、P-IKBα 蛋白表达的影响
3 讨论
脾胃湿热证的临床表现主要是消化系统的炎症反应,大量炎症细胞浸润胃组织并释放炎症介质,炎症介质刺激ROS 释放,产生氧化应激反应。脾胃湿热证产生的ROS 可进入血液循环而使外周血中ROS 含量增加[11],机体产生氧化应激反应,氧化-抗氧化系统的平衡被打破,ROS 表达过量[12],进而刺激机体释放大量促炎因子,产生严重的炎症反应,导致胃黏膜的结构和功能损伤[13]。
本研究结果表明,脾胃湿热模型组的ROS、LDH含量增高,CAT、SOD、GSH-Px 含量降低,说明脾胃湿热证激活小鼠氧化应激反应,增加细胞损伤。脾胃湿热模型组的炎症调控因子P-p38MAPK、P-NF-κB、P-IKBα 蛋白表达水平较空白对照组显著升高,其进入细胞核激活多种促炎转录因子如HO-1 mRNA、COX2 mRNA、iNOS mRNA 表达,从而促进炎症细胞的浸润与活化,使IL-6、TNF-α 表达量升高,加剧胃组织损伤。脾胃湿热证形成后,大量炎症细胞浸润胃组织并释放炎症介质,炎症因子的表达破坏了氧化-抗氧化系统之间的平衡,氧化应激能促进TNF-α、IL-6 等炎症介质的表达[14-15],炎症细胞活化后产生更多的ROS,导致炎症性病变后的氧化应激水平升高。氧化因子MDA、LDH 增多,抗氧化因子CAT、GSH-Px、SOD减少,生成过多的ROS,ROS 的增加被认为是氧化应激的主要原因。且ROS 增多能够继续激活氧化通路,使氧化损伤不断扩大。
中焦脾胃为枢机之地,湿热之邪阻滞中焦,则中焦气机不通,治法当恢复脾胃生理功能。湿热中阻方以辛开苦降法为组方原则,辛以化浊,苦以降浊,脾升胃降,则功能自复。脾胃湿热证小鼠经过湿热中阻方治疗后,氧化因子MDA、ROS、LDH 的含量降低,抗氧化因子CAT、GSH-Px、SOD含量升高,P-p38MAPK、P-NF-κB、P-IKBα 蛋白表达量降低,HO-1 mRNA、COX2 mRNA、iNOS mRNA 的含量降低,炎症因子IL-6、TNF-α 含量降低,说明湿热中阻方可以通过抑制氧化应激,进而抑制炎症因子的表达。
综上所述,脾胃湿热证与炎症之间关系密切,湿热中阻方对脾胃湿热证小鼠具有一定治疗作用。湿热中阻方能够通过清除LDH、ROS,降低炎症因子MDA 的表达,增加抗氧化因子SOD、CAT、GSH-Px的表达,降低氧化应激水平来改善脾胃湿热证小鼠炎症反应。
