加减驻景方对脉络膜新生血管动物模型缺氧信号因子表达的影响
2021-05-28陶方方亢泽峰陈水龄褚文丽刘健周志豪
陶方方,亢泽峰,陈水龄,褚文丽,刘健,周志豪
加减驻景方[1]是治疗年龄相关性黄斑变性(age-related macular degeneration,AMD)和病理性近视等伴有脉络膜新生血管(choroidal neovascularization,CNV)眼底疾病的经验用方,临床治疗有效,其作用机制尚不清晰,本研究采用组织学和分子生物学技术检测CNV 动物模型中雷帕霉素靶蛋白(mammal target of rapamycin,mTOR)信号通路相关因子活性,探 讨 蛋 白 激 酶B(protein kinase B,PKB,AKT)/mTOR/缺氧诱导因子-1α(hypoxia-inducible factor,HIF-1α)/血管内皮生长因子(vascular endothelium growth factor,VEGF)信号通路在CNV 形成中的作用,从而揭示加减驻景方抑制CNV 的机制。
1 材料与方法
1.1 实验动物
8 周龄雄性SPF 级棕色挪威(brown norway,BN)大鼠138 只,体重180~220 g,购买于北京市维通利华公司。动物许可证号:SCXK(京)2012-0001。实验前,适应性饲养3 d。
1.2 试剂与仪器
PCR 仪(Biometra,TProfessional ThermoCycler),全自动荧光定量PCR 仪(7500,ABI)。SP-9000 试剂盒(中杉金桥),AKT、VEGF(Cell Signaling Technology),mTOR、HIF-1α(Abcam),cDNA 第一链合成试剂盒(Thermo Scientific,K1622)。
1.3 实验分组与给药
大鼠任一只眼为实验眼,行激光造模,每只眼光凝8~10 个点。激光功率360 mW,光斑直径50 μm,曝光时间0.05 s。按随机数字表法将造模成功的大鼠分为模型组、中药组、西药组、联合组,各30 只。
空白组:18 只大鼠,正常饲养,不做特殊处理。
模型组:光凝后第1d 予生理盐水灌胃,每日1 次,共21 d。
中药组:光凝后第1 d 予中药灌胃,每日1 次,共21 d。中药加减驻景方由楮实子、枸杞子、菟丝子、五味子、茺蔚子、三七粉、桂枝、茯苓、三棱、郁金、生黄芪和当归等多种药物组成,给药中药浓度为0.775 g/ml,灌胃量10 ml/kg。
西药组:光凝后第1 d 予玻璃体腔注射康柏西普(Conbercept),共计1 次。康柏西普,成都康鸿药业,规格10 mg/ml,微量注射器玻璃体腔注射5 μl。
联合组:光凝后第1 d 予中药灌胃(同中药组),每日1 次,共21 d,光凝后第1 d 予玻璃体腔注射康柏西普(同西药组),共计1 次。
1.4 免疫组织化学法检测AKT、mTOR、HIF-1α 和VEGF
模型组和各治疗组在光凝后第7 d、14 d、21 d各处死6 只大鼠取材。空白组在光凝后21 d 处死取材。制作组织切片,行免疫组织化学染色。石蜡切片脱蜡至水;PBS 洗涤5 min,3 次;抗原修复;3%H2O2阻断内源性过氧化物酶活性,10 min;1%Triton-100,室温1 h;试剂A,室温30 min;滴加稀释后的一抗,阴性对照用PBS 溶液代替,4°C 过夜;试剂B,室温下孵育30 min;试剂C,室温下孵育10 min;DAB 染色;自来水冲洗,苏木素复染1 min,盐酸酒精分化30 s,氨水返蓝30 s;梯度酒精脱水,二甲苯透明,中性树胶封片,晾干;光学显微镜拍摄照片。一抗稀释倍数:AKT(1:100);mTOR(1:200);HIF-1α(1:200);VEGF(1:100)。
1.5 实时荧光定量聚合酶链式反应检测AKT、mTOR、HIF-1α 和VEGF 的mRNA 表达
采用实时荧光定量聚合酶链式反应(real-time fluorescent quantitative polymerase chain reaction,RT-qPCR)技术,光凝后21 d,每组各处死6 只大鼠获取眼杯,参照试剂盒方法用Trizol 一步法裂解组织,提取总RNA,按照试剂盒说明书,合成cDNA。配制反应体系如下:RealMasterMix 和SYBR 混合物10μl,上游引物1 μl,下游引物1 μl,cDNA 1 μl,超纯水定容至20 μl,进行PCR 循环,95℃预变性10 min;95℃变性20 s、60℃退火30 s、68℃延伸60 s;循环40 次。引物由北京科悦达生物科技有限公司合成(表1)。
1.6 蛋白免疫印迹技术检测目的蛋白表达
采用蛋白免疫印迹(western blotting)技术检测目的蛋白表达,光凝后21 d,每组各处死6 只大鼠获取眼杯,获取蛋白质样品,测定总蛋白浓度,SDS 聚丙烯酰胺凝胶电泳,起始电压设定为80 V,当样品进入分离胶时,调整电压至120 V,继续电泳,直至溴酚蓝跑至底部时,结束电泳。转膜;5%脱脂牛奶封闭,室温摇床孵育2 h;一抗4℃孵育过夜;1:5000 稀释的辣根过氧化物酶标记的羊抗兔IgG,室温孵育1 h;显影液显影。
1.7 图像分析方法
每组选取15 张包含CNV 的免疫组化图像,Image Pro Plus 6.0 软件分析图像的平均光密度值(average optical density,AOD)值作为半定量测定阳性表达物的依据。用空白组目的基因与内参GAPDH的相对表达量进行校正,得到空白组目的基因mRNA 相对表达量为1 时,实验组目的基因mRNA 表达量是空白组的倍数。将“2-ΔΔCt”视为各目的基因mRNA 的相对表达量。使用Quantity One 分析软件测定条带光密度值,以GAPDH 条带的光密度值校正,目的蛋白的相对表达量以目的基因条带的光密度值与GAPDH 条带的光密度值之比来表示。
1.8 统计学方法
采用统计学软件SPSS 21.0 进行数据分析。计量资料以平均数±标准差()描述,多组间比较采用单因素方差分析,两组间比较采用方差分析中LSD-t检验。当P<0.05 时,则认为差异具有统计学意义。
2 结果
2.1 免疫组化结果
2.1.1 AKT 空白组大鼠视网膜组织中可见AKT 表达,视网膜神经节细胞层可见阳性反应物。模型组和各治疗组视网膜光凝区CNV 组织中AKT 表达均呈强阳性,CNV 组织中可见大量黄棕色阳性反应物。模型组和联合组AKT 表达量在光凝后7 d 时最大,21 d时缓慢减少(P<0.05);中药组和西药组AKT 表达量在光凝后14 d 时最大,21 d 时显著减少(P<0.05)。
光凝后7 d,各治疗组AKT 表达量均低于模型组,中药组AKT 表达量高于西药组与联合组(P<0.05),西药组与联合组无明显差异(P>0.05)。光凝后14 d 与21 d,各治疗组AKT 表达量均低于模型组,联合组AKT 表达量最低,西药组次之,西药组AKT 表达量低于中药组(P<0.05)(表2,图1)。
2.1.2 mTOR 空白组BN 大鼠视网膜组织中可见mTOR 表达,视网膜神经节细胞层可见少量阳性反应物。模型组和各治疗组CNV 组织中mTOR 呈强阳性表达,CNV 组织中可见大量黄棕色阳性反应物。模型组、中药组和联合组mTOR 表达量在光凝后7 d 时最大,21 d 时显著减少(P<0.05)。西药组mTOR 表达量在光凝后14 d 时最大,21 d 时显著减少(P<0.05)。

表1 RT-qPCR 引物序列
表2 光凝后不同时间各组AKT 的AOD 值变化(,n=15)
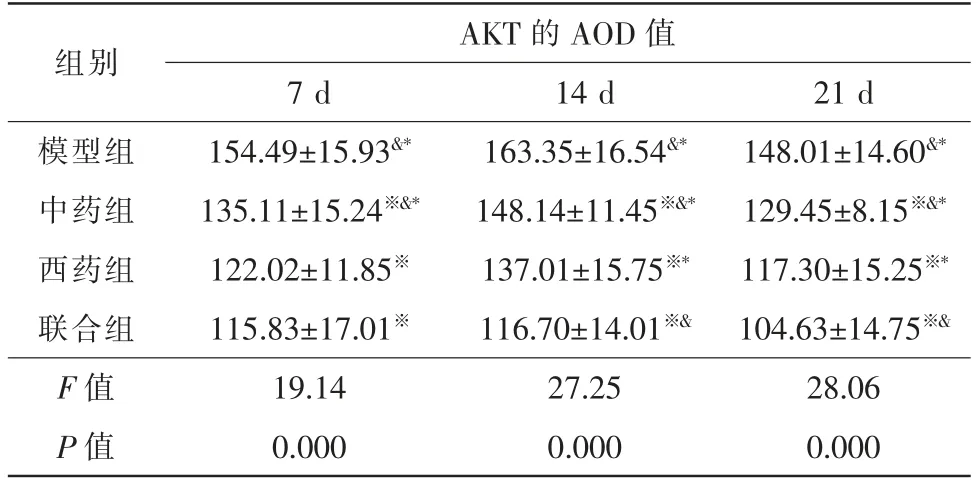
表2 光凝后不同时间各组AKT 的AOD 值变化(,n=15)
注:※ 与同时间段模型组比较,P<0.05;# 与同时间段中药组比较,P<0.05;&与同时间段西药组比较,P<0.05;* 与同时间段联合组比较,P<0.05
光凝后7 d,西药组与联合组mTOR 表达量均低于模型组和中药组(P<0.05),中药组与模型组无明显差异(P>0.05)。光凝后14 d 与21 d,各治疗组mTOR 表达量均低于模型组,联合组mTOR 表达量最低,西药组次之,西药组mTOR 表达量低于中药组(表3,图2)。
表3 光凝后不同时间各组mTOR 的AOD 值变化(,n=15)
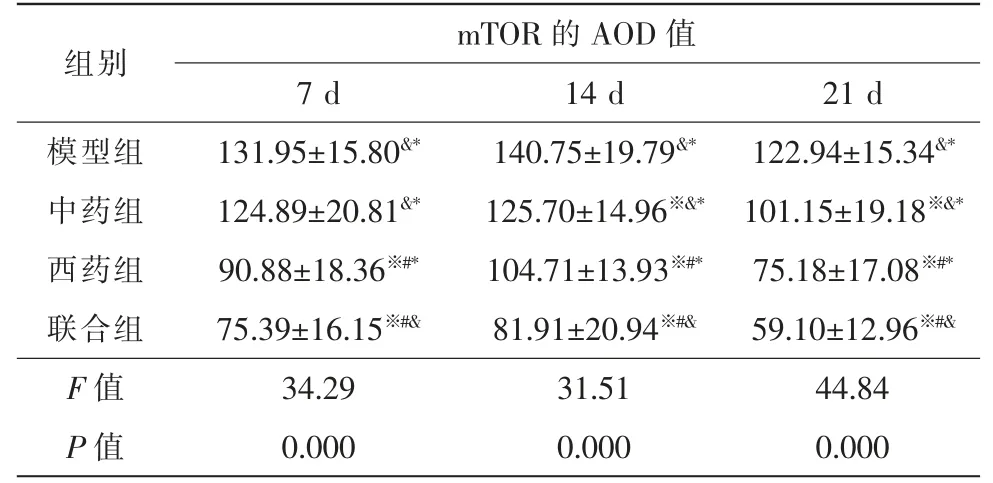
表3 光凝后不同时间各组mTOR 的AOD 值变化(,n=15)
注:※ 与同时间段模型组比较,P<0.05;# 与同时间段中药组比较,P<0.05;&与同时间段西药组比较,P<0.05;* 与同时间段联合组比较,P<0.05
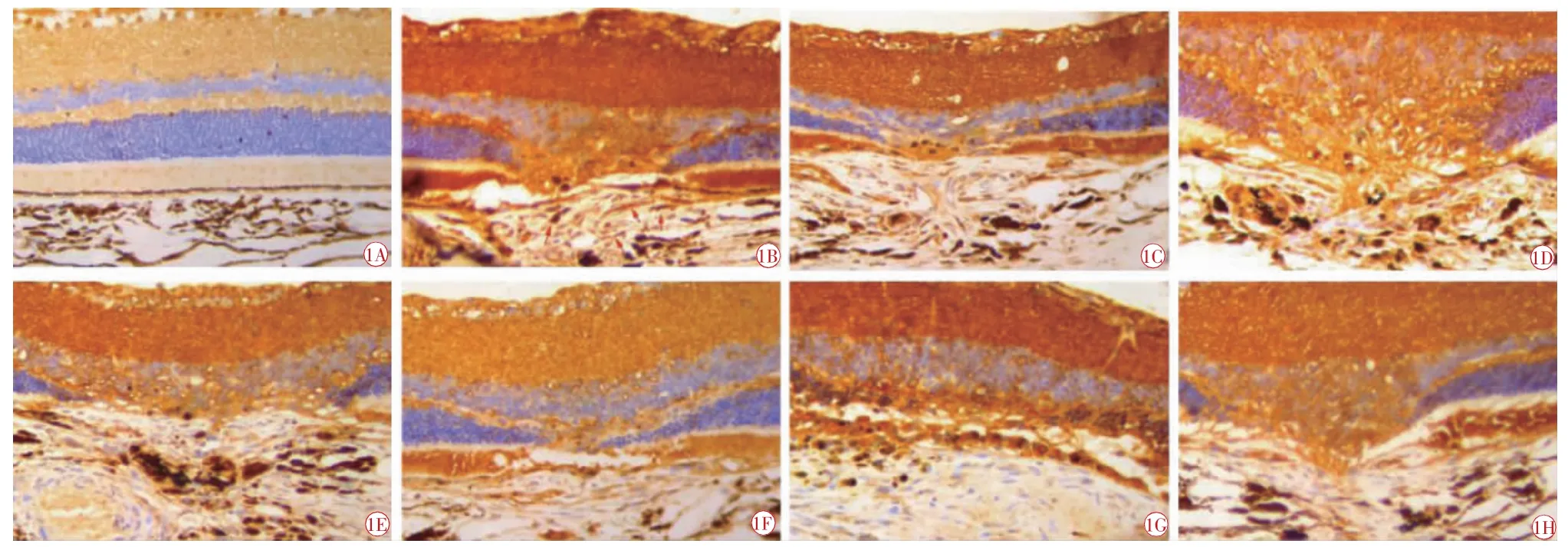
图1 AKT 免疫组化图像(DAB 染色,×400)。1A 空白组,正常BN 大鼠视网膜组织中AKT 呈阳性表达。1B 7 d 模型组;1C 7 d 中药组;1D 21 d 中药组;1E 7 d 西药组;1F 21 d 西药组;1G 7 d 联合组;1H 21 d 联合组。模型组和各治疗组CNV 中AKT 呈强阳性表达

图2 mTOR 免疫组化图像(DAB 染色,×400)。2A 空白组,正常BN 大鼠视网膜组织中mTOR 呈阳性表达;2B 7 d 模型组;2C 7 d 中药组;2D 21 d 中药组;2E 7 d 西药组;2F 21 d 西药组;2G 7 d 联合组;2H 21 d 联合组。模型组和各治疗组CNV 中mTOR 呈阳性表达
2.1.3 HIF-1α 空白组BN 大鼠视网膜组织中可见HIF-1α 表达,视网膜神经节细胞层可见阳性反应物。模型组和各治疗组CNV 组织中HIF-1α 呈阳性表达,CNV 组织中可见大量黄棕色阳性反应物。模型组、中药组和联合组HIF-1α 表达量在光凝后14 d时最大,21 d 时显著减少(P<0.05)。西药组HIF-1α表达量在光凝后不同时间无明显变化(P>0.05)。
光凝后7 d,西药组与联合组HIF-1α 表达量均低于模型组和中药组(P<0.05),中药组与模型组无明显差异(P>0.05)。光凝后14 d,各治疗组HIF-1α表达量均低于模型组,西药组HIF-1α 表达量最低,联合组次之,联合组HIF-1α 表达量低于中药组(P<0.05)。光凝后21 d,各治疗组HIF-1α 表达量均低于模型组,联合组HIF-1α 表达量最低,西药组次之,西药组HIF-1α 表达量低于中药组(P<0.05)(表4,图3)。
表4 光凝后不同时间各组HIF-1α 的AOD 值变化(,n=15)
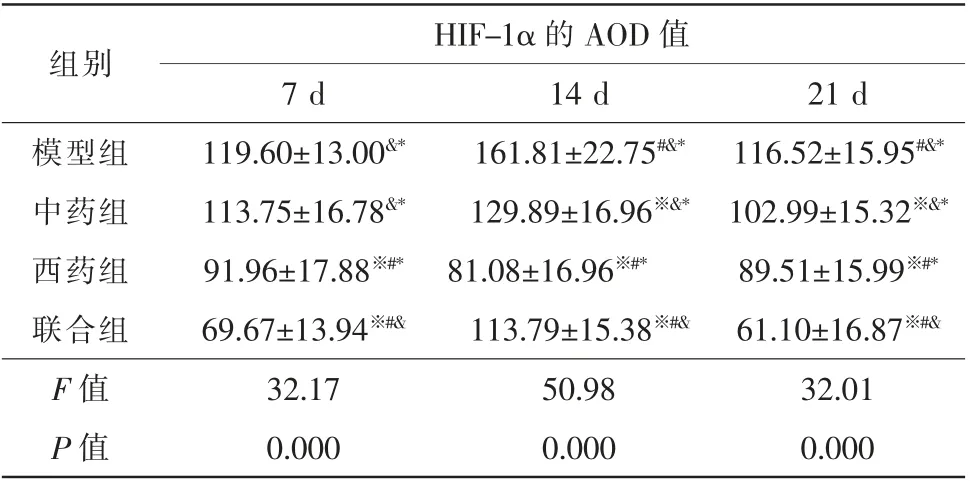
表4 光凝后不同时间各组HIF-1α 的AOD 值变化(,n=15)
注:※ 与同时间段模型组比较,P<0.05;# 与同时间段中药组比较,P<0.05;&与同时间段西药组比较,P<0.05;* 与同时间段联合组比较,P<0.05
2.1.4 VEGF 空白组BN 大鼠视网膜组织中可见VEGF 表达,视网膜神经节细胞层可见少量阳性反应物。模型组和各治疗组CNV 组织中VEGF 呈阳性表达,CNV 组织中可见大量黄棕色阳性反应物。模型组和中药组VEGF 表达量在光凝后7 d 时最大,随后逐渐减少(P<0.05)。西药组VEGF 表达量在光凝后7 d 时最大,21 d 时显著减少(P<0.05)。联合组VEGF 表达量在光凝后7 d 时最大,14 d 时显著减少,21 d 较14 d 有明显增加(P<0.05)。
光凝后7d、14d 与21d,各治疗组VEGF 表达量均低于模型组,联合组VEGF 表达量最低,西药组次之,西药组VEGF 表达量低于中药组(P<0.05)(表5,图4)。
表5 光凝后不同时间各组VEGF 的AOD 值变化(,n=15)
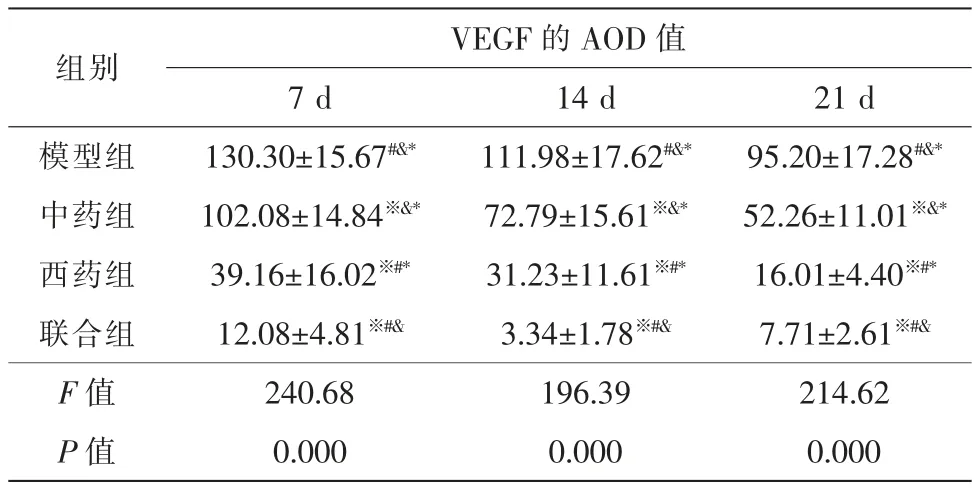
表5 光凝后不同时间各组VEGF 的AOD 值变化(,n=15)
注:※ 与同时间段模型组比较,P<0.05;# 与同时间段中药组比较,P<0.05;&与同时间段西药组比较,P<0.05;* 与同时间段联合组比较,P<0.05
2.2 RT-qPCR 检测mRNA 相对表达量
模型组与治疗组各目的基因mRNA 相对表达量较空白组均有明显增多(P<0.05)。除mTOR 以外,各治疗组目的基因mRNA 相对表达量均低于模型组(P<0.05),中药组mTOR mRNA 相对表达量与模型组无明显差异(P>0.05)。各治疗组AKT、mTOR 和VEGF mRNA 相对表达量由高到低依次为中药组、西药组和联合组(P<0.05)。中药组HIF-1α mRNA相对表达量高于西药组和联合组(P<0.05),西药组和联合组之间无明显差异(P>0.05)(表6)。

图3 HIF-1α 免疫组化图像(DAB 染色,×400)。3A 空白组,正常BN 大鼠视网膜组织中HIF-1α 呈阳性表达;3B 7 d 模型组;3C 7 d 中药组;3D 21 d 中药组;3E 7 d 西药组;3F 21 d 西药组;3G 7 d 联合组;3H 21 d 联合组。模型组和各治疗组CNV 中HIF-1α 呈阳性表达
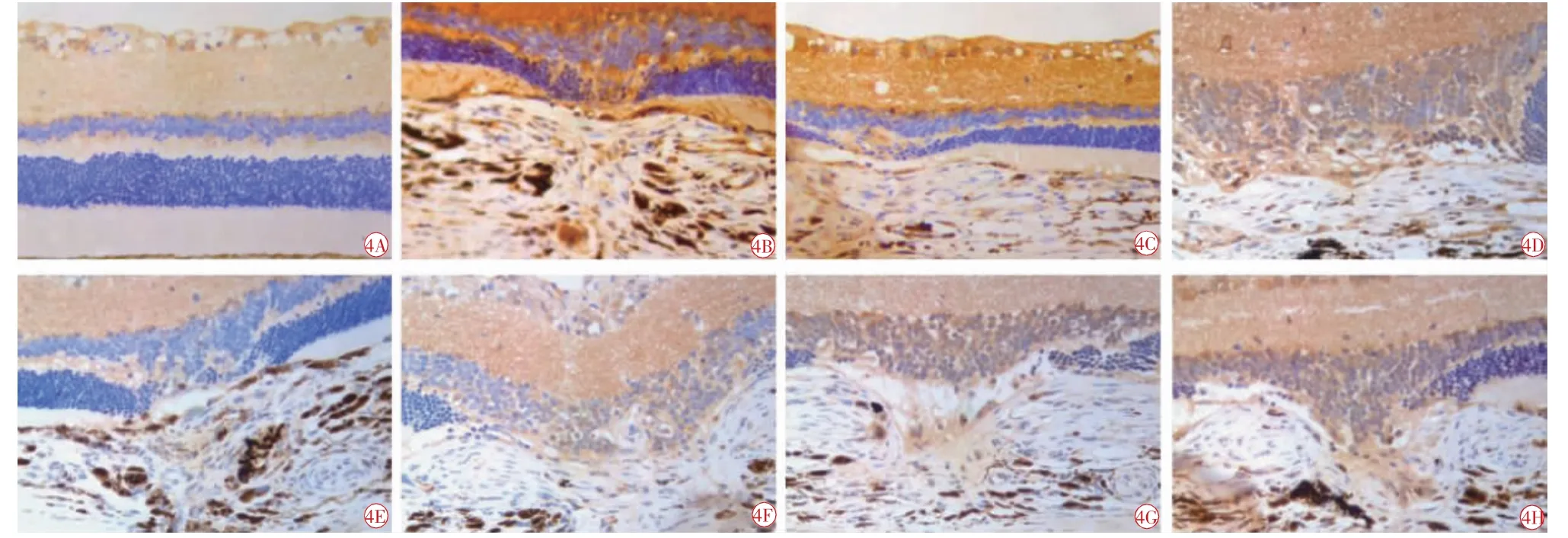
图4 VEGF 免疫组化图像(DAB 染色,×400)。4A 空白组,正常BN 大鼠视网膜组织中VEGF 呈阳性表达;4B 7 d 模型组;4C 7 d 中药组;4D 21 d 中药组;4E 7 d 西药组;4F 21 d 西药组;4G 7 d 联合组;4H 21 d 联合组。模型组和各治疗组CNV 中VEGF 呈阳性表达
表6 AKT、mTOR、HIF-1α 与VEGF mRNA 相对表达量δ(,n=9)
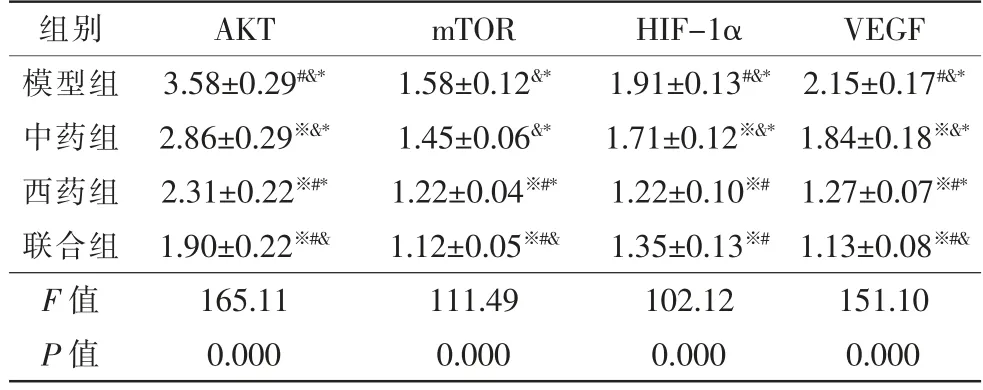
表6 AKT、mTOR、HIF-1α 与VEGF mRNA 相对表达量δ(,n=9)
注:δ 空白组设为1,其他组与其相除获得相对值;※ 与模型组比较,P<0.05;# 与中药组比较,P<0.05;&与西药组比较,P<0.05;* 与联合组比较,P<0.05
2.3 Western blotting 检测蛋白相对表达量
模型组和治疗组各目的蛋白相对表达量较空白组均有明显增多(P<0.05)。模型组、中药组AKT 蛋白相对表达量较西药组、联合组高(P<0.05)。除AKT蛋白以外,各治疗组目的蛋白相对表达量均低于模型组(P<0.05)。各治疗组mTOR 与VEGF 蛋白相对表达量由高到低依次为中药组、西药组和联合组(P<0.05)。HIF-1α 蛋白相对表达量中药组较高(P<0.05),西药组与联合组无明显差异(P>0.05)(表7,图5)。
表7 AKT、mTOR、HIF-1α 与VEGF 蛋白相对表达量δ(,n=9)
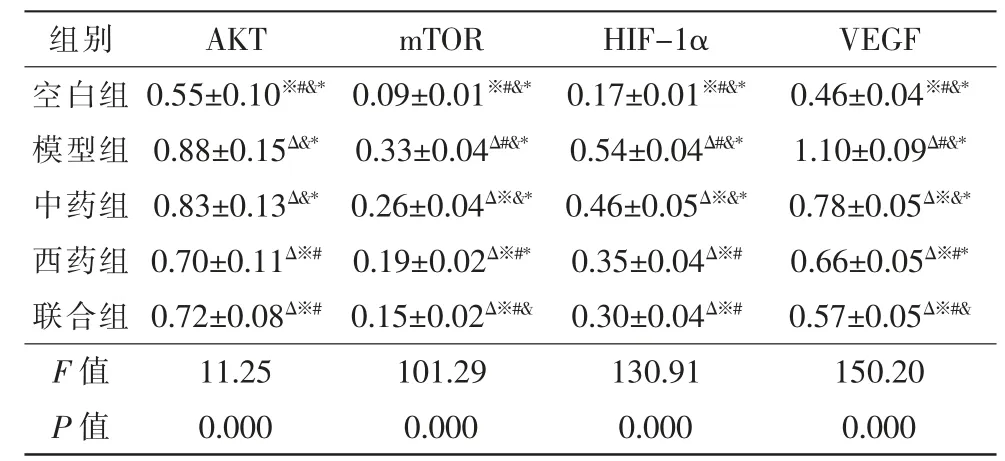
表7 AKT、mTOR、HIF-1α 与VEGF 蛋白相对表达量δ(,n=9)
注:δ 内参GAPDH 设为1,其他组与其相除获得相对值;Δ 与空白组比较,P<0.05;※ 与模型组比较,P<0.05;# 与中药组比较,P<0.05;&与西药组比较,P<0.05;* 与联合组比较,P<0.05
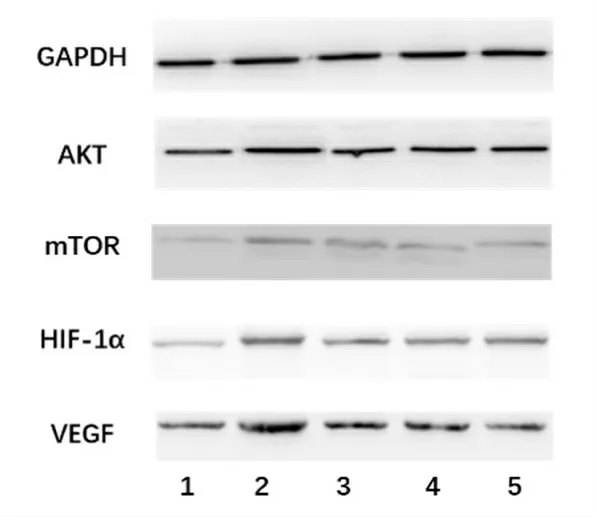
图5 Western blotting 图像。1~5 依次为空白组、模型组、中药组、西药组和联合组
3 讨论
CNV 是AMD、病理性近视等多种严重损害视功能眼病的共同病理产物,其病因尚不十分明确,治疗棘手。CNV 的形成与VEGF、白细胞介素-6 等多种细胞因子的作用有关,其中AKT/mTOR/HIF-1α是调控VEGF 表达的主要信号通路之一[2]。
VEGF 是目前已知促进CNV 生成最关键的因子,VEGF-A 是最重要的家族成员,以往称为VEGF,主要高表达于有新生血管的组织与细胞中,如肿瘤组织、缺血缺氧性眼病组织、胎儿组织等,而在正常人与动物组织中低表达。VEGF-A 不仅可以有选择的促进血管内皮细胞的有丝分裂、移行,诱导毛细血管形成来促进新生血管的生成[3],还可以增加微小血管通透性,促进细胞外基质形成,为新生血管的形成提供营养[4],促进血管形成。
PI3K/AKT/mTOR 信号通路是内皮细胞中调控HIF-1α mRNA 翻译的关键信号通路[5-6],生长因子、缺氧等因素可以激活PI3K/AKT/mTOR 信号通路[7],促使HIF-1α 蛋白表达的上调,HIF-1 与靶基因的缺氧反应元件结合,如VEGF,从而激活VEGF mRNA 的转录[2,8-10],进而激活VEGF 的表达,使内皮细胞迁移促进CNV 的形成。本研究中,模型组表达的AKT、mTOR、HIF-1α、VEGF 蛋白及mRNA 较空 白组均有显著增强。氪激光诱导的BN 大鼠CNV 模型中,AKT/mTOR/HIF-1α/VEGF 信号通路的激活促进了CNV 的生成。
加减驻景方是亢泽峰教授治疗AMD 和病理性近视等伴有CNV 眼底疾病的经验用方,亢教授将AMD 归为中医眼科“瞳神络病”的范畴[11-12]。清代名医叶天士[13]有言:“久病必治络—病久气血推行不利,血络之中必有瘀凝,故致病气缠延不去,必疏其络而病气可尽也”。王清任[14]认为:“元气既虚,必不能达于血管,血管无气,必停留而瘀”。亢教授认为,本病病机主要为肝肾不足,兼具气血津液功能障碍,表现为瘀、痰、湿的本虚标实证,治以补肾明目、活血通络为要则,辅以利水渗湿、止血活血、益气养血、温阳通络之药。因此,组成了以“补肾明目、益气活血、化瘀通络”为治则的加减驻景方。
方中菟丝子补肾益精,养肝明目,为平补阴阳之品,善滋补肝肾、益精养血而明目,《神农本草经》[15]言:“久服明目”。枸杞子,为平补肾精肝血之品,与菟丝子合用,常用于肝肾阴虚之内障目昏,共为君药。五味子酸咸,敛肺金滋肾水;楮实子,益精强阴;黄芪甘温,益气健脾补中,伍以甘温之当归,凑健脾益气补血之效,目得血而能视;以上共助君药补益肝肾、益气养血明目而为臣。三七,活血通窍。郁金,活血行气,通利玄府清窍,又制臣药之温燥。三棱,破血行气,《神农本草经疏》[16]曰:“从血药则治血,从气药则治气”,三者相合,散瘀行气之力著。茯苓,渗湿健脾,消痰利水。合芪、归,能补益心脾,使血行畅通、生血有源,又可防诸药滋腻,合于桂枝,温通血脉,化气利水,共达行瘀利水之效。以上共为佐药,减君臣药之滋腻,又奏气滞血瘀之效,使水行、络脉通,减轻痰湿、血瘀等“邪阻”之证。加减驻景方中多种药物具有耐缺氧、增加血流量、降低血管阻力、抑制VEGF表达等作用。如菟丝子具有增加冠状动脉血流量与降低血管阻力作用[17],枸杞多糖有耐缺氧作用[18],三棱含药血清有抑制血管内皮细胞表达VEGF 的作用[19]。
本研究中,各治疗组均有抑制AKT/mTOR/HIF-1α/VEGF 信号通路活性的作用。西药组与联合组对AKT/mTOR/HIF-1α/VEGF 信号通路活性的抑制作用强于中药组,加减驻景方通过降低AKT/mTOR/HIF-1α/VEGF 信号通路活性,发挥了抑制CNV 形成的作用,这可能与方药中多种药物耐缺氧、增加冠状动脉血流量、抑制VEGF 表达的作用有关。
