miR-4286靶向FOXO4对肺癌细胞增殖、迁移、侵袭及凋亡的影响①
2021-05-27厉永强石贞玉河南大学淮河医院呼吸与危重症医学科开封475000
赵 敏 厉永强 石贞玉(河南大学淮河医院呼吸与危重症医学科,开封 475000)
肺癌是恶性肿瘤中发病率和死亡率增长最快的疾病之一,更是全球癌症相关死亡的最主要原因,对人类的健康和生命构成严重威胁[1]。由于肺癌起病隐匿,确诊时多为中晚期,且手术、放化疗后易复发和转移,缩短了患者的生存期。因此,寻找有效的诊疗靶点抑制肺癌的转移是目前肺癌治疗的重大课题。微小RNA(microRNA,miRNA)是长度为20~25个核苷酸的内源性非编码小RNA,其通过与靶基因的3′非翻译区(untranslated region,UTR)结合调节细胞的存活、增殖、凋亡、侵袭和转移[2]。大量研究证实,在包括肺癌在内的多种恶性肿瘤中,miRNA发挥抑癌基因或致癌基因作用[3-4]。miR-4286位于人染色体8p23.1位点,已经证实可参与调节黑色素瘤、食管鳞癌和胰腺癌进程[5-7]。在肺癌细胞中,miR-4286呈高表达,其高表达与肿瘤大小、淋巴结转移及TNM分期相关[8]。然而,miR-4286在肺癌进展中的作用机制并未完全阐明。生物信息学分析显示叉头样转录因子O4(forkhead box O4,FOXO4)可能是miR-4286的靶基因,作为一种转录抑制因子,研究显示肺癌中FOXO4表达显著降低,抑制其表达可促进肺癌转移[9-10]。但miR-4286能否靶向FOXO4参与肺癌进展尚未明确。本研究旨在揭示miR-4286和FOXO4在肺癌细胞生长、转移和凋亡中的作用,为miR-4286在肺癌临床生物治疗中的应用提供科学依据。
1 资料与方法
1.1 资料
1.1.1 组织来源 选择我院收治的肺癌患者29例,其中男性17例,女性12例;年龄40~75岁。分别取其肺癌组织及与其对应的癌旁组织,手术切除后立即放入液氮中保存,随后放入-80℃冰箱保存备用。所有病例术前均未接受化疗或放疗。所有患者均签署知情同意书,且经本院伦理委员会批准。
1.1.2 细胞株和主要试剂 肺癌细胞A549购于中国科学院上海细胞研究所;DMEM培养液、胎牛血清购于美国Hyclone公司;逆转录试剂盒、SYBR Pre‑mix Ex TaqⅡ试剂盒购于大连宝生物工程有限公司;miRNA抑制物阴性对照(anti-miR-NC)、miR-4286抑制物(anti-miR-4286)、小干扰RNA阴性对照(si-NC)、FOXO4小干扰RNA(si-FOXO4)购于上海生工生物工程有限公司;细胞计数试剂盒(cell counting kit 8,CCK-8)、膜联蛋白V异硫氰光素荧光素/碘化丙啶(Annexin V-FITC/PI)双染细胞凋亡检测试剂盒购于杭州贝博生物公司;Transwell小室和基质胶购于美国Cornning公司;兔源FOXO4、P21、半胱氨酸天冬氨酸蛋白酶(Caspase-3)、上皮细胞钙黏蛋白(E-cadherin)、基质金属蛋白酶2(matrix me‑talloproteinase 2,MMP-2)和磷酸甘油醛脱氢酶(glyc‑eraldehyde phosphate dehydrogenase,GAPDH)抗体购于美国Abcam公司;山羊抗兔二抗购于北京中山金桥生物科技有限公司。实验引物由上海生工生物工程有限公司提供。FOXO4上游引物5′-CCGGCAAAAGCTCTTGGTG-3′,下 游 引 物5′-GGTCCACATATCGGCTTCTTCA-3′;GAPDH上游引物5′-TG‑GTGAAGACGCCAGTGGA-3′,下游引物5′-GCACC‑GTCAAGGCTGAGAAC-3′;miR-4286上游引物5′-ACACTCCAGCTGGGACCCCACTCCT-3′,下游引物5′-TACCAGGAGTGGGGTTT-3′;U6上 游 引 物5′-CTCGCTTCGGCAGCACA-3′,下游引物5′-AAGGCTTCACGAATTTGCGT-3′。
1.2 方法
1.2.1 RT-qPCR检 测miR-4286和FOXO4 mRNA的表达Trizol法检测肺癌组织、癌旁组织中总RNA,将提取的总RNA溶解于RNase-free水,紫外分光光度计检测RNA浓度和纯度。根据逆转录试剂盒说明书将RNA逆转为cDNA后,按照SYBR Pre‑mix Ex TaqⅡ试剂盒说明书对miR-4286和FOXO4进行PCR扩增。miR-4286的检测以U6为内参,FOXO4 mRNA的检测以GAPDH为内参。2-ΔΔCt法计算miR-4286和FOXO4 mRNA的相对表达水平。
1.2.2 细胞培养和实验分组 将A549细胞分为anti-miR-NC组(转染anti-miR-NC)和anti-miR-4286组(转染anti-miR-4286)。采用含10%胎牛血清的DMEM培养液于37℃、5%CO2的培养箱中培养肺癌A549细胞。转染前1 d,将A549细胞以2×105个/孔的密度接种于6孔板,按照脂质体LipofectamineTM2000说明书将anti-miR-NC、anti-miR-4286分别转染至A549细胞,转染48 h,检测转染效果合格后进行其他指标检测。为证实miR-4286是通过调控FOXO4进而影响A549细胞的增殖、迁移侵袭能力和凋亡,将A549细胞分为anti-miR-4286+si-NC组(共转染anti-miR-4286和si-NC)和anti-miR-4286+si-FOXO4组(共转染anti-miR-4286和si-FOXO4),转染48 h检测转染效果合格后检测细胞的增殖、迁移侵袭能力及凋亡变化。
1.2.3 CCK-8法检测细胞存活 将1×104个A549细胞接种于96孔板,根据实验分组进行细胞转染,培养箱孵育48 h,向各孔内加入10µl CCK-8试剂,继续孵育2 h,酶标仪检测450 nm处各孔的吸光度值,计算细胞存活率。细胞存活率=(实验组OD-空白组OD)/(对照组OD-空白组OD)。
1.2.4 克隆形成实验检测细胞克隆形成能力 收集转染48 h的anti-miR-NC组、anti-miR-4286组、an‑ti-miR-4286+si-NC组 和anti-miR-4286+si-FOXO4组A549细胞,胰酶消化后,取2×103个细胞均匀分散铺于6孔板,细胞培养箱常规培养7 d,当出现肉眼可见的集落时,弃去培养基,PBS缓冲液洗涤细胞1次,依次加入多聚甲醛和结晶紫染液进行固定和染色,PBS缓冲液冲洗3次,常温晾干后,显微镜下统计大于50个细胞的集落数。
1.2.5 流式细胞术检测细胞凋亡 收集转染48 h的anti-miR-NC组、anti-miR-4286组、anti-miR-4286+si-NC组和anti-miR-4286+si-FOXO4组A549细胞,胰酶消化后,PBS洗涤细胞2次,离心后加入适量结合缓冲液制备细胞浓度为1×106个/ml的单细胞悬液。取100µl细胞悬液加入流式管,按照Annexin V-FITC/PI细胞凋亡试剂盒分别加入5µl Annexin V-FITC和5µl PI,避光孵育15 min,补加结合缓冲液至500µl,混匀后1 h上机检测各组A549细胞凋亡情况。
1.2.6 Transwell实验检测细胞迁移和侵袭 侵袭实验:将基质胶均匀平铺于Transwell小室上室膜,备用。细胞转染48 h消化后,采用无血清培养基制备单细胞悬液。取200µl接种于Transwell上室,24孔板下室仅加入500µl含20%胎牛血清的细胞培养基,将含有Transwell小室的24孔板置于培养箱常规培养24 h,取出Transwell小室,轻轻擦去上室膜未过膜细胞后,依次采用多聚甲醛、结晶紫进行固定和染色,将Transwell小室倒置于显微镜下观察细胞过膜情况,随机选取5个视野进行计数和拍照,以其均值表示侵袭细胞数目。迁移实验采用未包被基质胶的Transwell小室,其他步骤同上。
1.2.7 Western blot检测FOXO4、P21、Caspase-3、Ecadherin和MMP-2蛋白的表达 采用RIPA分别提取anti-miR-NC组、anti-miR-4286组、anti-miR-4286+si-NC组 和anti-miR-4286+si-FOXO4组A549细 胞 的总蛋白,BCA试剂盒测定蛋白浓度。沸水浴3 min变性细胞蛋白,配制浓缩胶和分离胶,以每泳道30µg蛋白样品上样,随后进行聚丙烯酰胺凝胶电泳。结束后,常规湿法将分离细胞蛋白转移至硝酸纤维素膜。将膜置于5%的牛血清蛋白溶液中室温条件封闭1 h,洗膜后,将膜置于稀释的一抗溶液室温孵育2 h,洗膜,将膜置于稀释的二抗溶液中室温孵育1 h,洗膜后,于暗室进行化学发光盒显色。以GAPDH为内参,采用Image J分析软件分析各条带的灰度值,以目的蛋白灰度值和GAPDH灰度值的比值表示目的蛋白相对表达量。
1.2.8 双荧光素酶报告基因实验验证miR-4286和FOXO4的靶向关系 采用TargetScan在线分析软件预测miR-4286的靶基因,发现FOXO4是miR-4286的潜在功能性靶基因之一,推测miR-4286能靶向调控FOXO4表达,并进行双荧光素酶报告基因实验验证。构建含有FOXO4-3′UTR序列的野生型荧光素酶报告质粒(WT-FOXO4)及含有FOXO4-3′-UTR突变序列的突变型荧光素酶报告质粒(MUT-FOXO4),质粒构建由上海吉玛公司完成。将A549细胞接种至6孔板,利用细胞转染试剂LipofectamineTM2000将WT-FOXO4、MUT-FOXO4分别与miR-NC、miR-4286 mimics共转染至A549细胞,6 h后更换为完全细胞培养液,培养48 h后检测各组细胞荧光素酶活性变化。为验证miR-4286对FOXO4的调控作用,以miR-NC、miR-4286 mimics、anti-miR-NC、anti-miR-4286分别转染A549细胞,转染48 h裂解细胞按照Western blot步骤检测FOXO4蛋白的表达变化。
2 结果
2.1 miR-4286、FOXO4在肺癌组织和癌旁组织中的表达RT-qPCR检测肺癌组织和癌旁组织中miR-4286和FOXO4 mRNA的表达,结果显示,肺癌组织中miR-4286的表达较癌旁组织显著升高,FOXO4 mRNA的表达较癌旁组织显著降低(P<0.05)。见表1。
表1 miR-4286、FOXO4在肺癌组织和癌旁组织中的表达(±s)Tab.1 Expressions of miR-4286 and FOXO4 in lung can-cer and paracancerous tissues(±s)
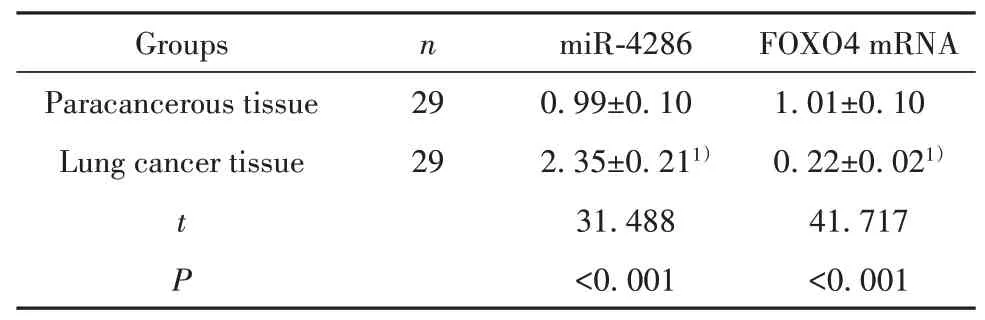
表1 miR-4286、FOXO4在肺癌组织和癌旁组织中的表达(±s)Tab.1 Expressions of miR-4286 and FOXO4 in lung can-cer and paracancerous tissues(±s)
Note:1)P<0.05,compared with paracancerous tissue group.
FOXO4 mRNA 1.01±0.10 0.22±0.021)41.717<0.001 Groups Paracancerous tissue Lung cancer tissue n 29 29 t P miR-4286 0.99±0.10 2.35±0.211)31.488<0.001
2.2 抑制miR-4286对肺癌细胞增殖、凋亡的影响见图1,转染anti-miR-4286抑制miR-4286表达后,A549细胞中P21和Caspase-3蛋白表达显著升高,细胞存活率从(100.12±10.06)%降为(47.95±4.68)%,克隆形成数从162±15.31降为76±7.15,细胞凋亡率从(7.65±0.83)%升高为(23.21±2.26)%(P<0.05)。

图1 抑制miR-4286对肺癌细胞增殖、凋亡的影响Fig.1 Effect of inhibiting miR-4286 on proliferation and apoptosis of lung cancer cells
2.3 抑制miR-4286对肺癌细胞迁移、侵袭的影响 见图2,转染anti-miR-4286抑制miR-4286表达后,A549细胞E-cadherin蛋白表达显著增加,MMP-2蛋白的表达显著降低,迁移和侵袭细胞数显著降低(P<0.05)。

图2 抑制miR-4286对肺癌细胞迁移、侵袭及E-cadherin、MMP-2蛋白表达的影响Fig.2 Effect of inhibiting miR-4286 on lung cancer cell migration,invasion,and expression of E-cadherin and MMP-2 proteins
2.4 miR-4286靶向、调控FOXO4表达TargetScan预测miR-4286的靶基因结果显示,miR-4286和FOXO4的3′-UTR区域存在部分连续互补的核苷酸序列,见图3A。双荧光素酶报告实验验证miR-4286和FOXO4的靶向关系发现,上调miR-4286表达可降低转染WT-FOXO4的A549细胞的荧光素酶活性(P<0.05);而上调miR-4286表达对转染MUTFOXO4的A549细胞的荧光素酶活性无显著影响(图3B),Western blot结果显示上调miR-4286表达后A549细胞FOXO4在mRNA和蛋白水平的表达显著降低;抑制miR-4286表达后A549细胞FOXO4蛋白的表达水平显著升高(P<0.05),见图3C。
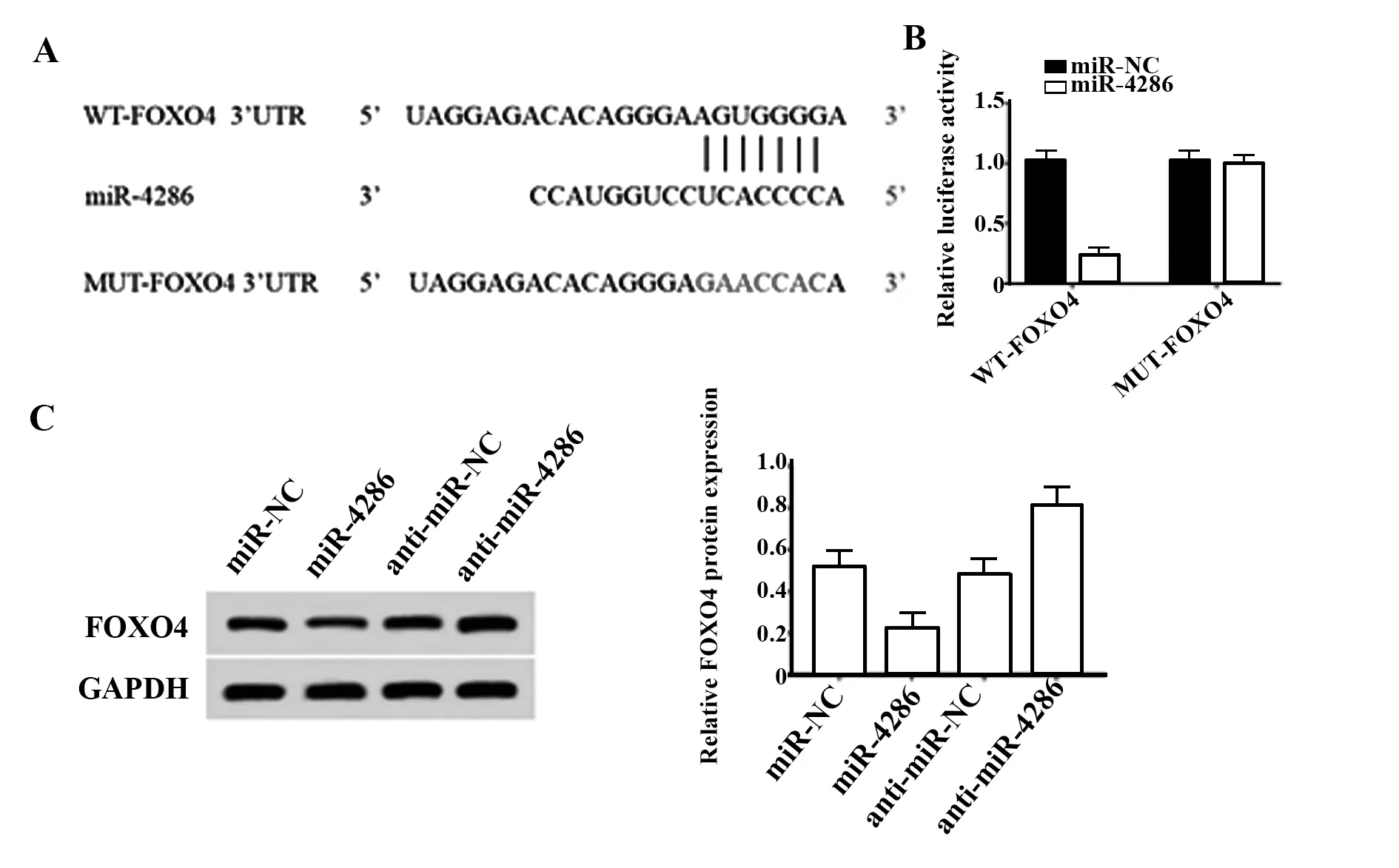
图3 miR-4286靶向调控FOXO4Fig.3 miR-4286 targets regulated FOXO4
2.5 抑制FOXO4能逆转抑制miR-4286对肺癌细胞增殖、凋亡的作用 见图4,与anti-miR-4286和si-NC共转染组比较,anti-miR-4286和si-FOXO4共转染组A549细胞FOXO4、P21和Caspase-3蛋白表达显著降低,细胞存活率从(48.23±4.61)%升高为(86.91±8.58)%,克隆形成数从77±7.15升高为137±12.94,细胞凋亡率从(23.11±2.18)%降为(11.34±1.26)%(P<0.05)。抑制FOXO4表达可逆转抑制miR-4286对肺癌细胞增殖和凋亡的影响。
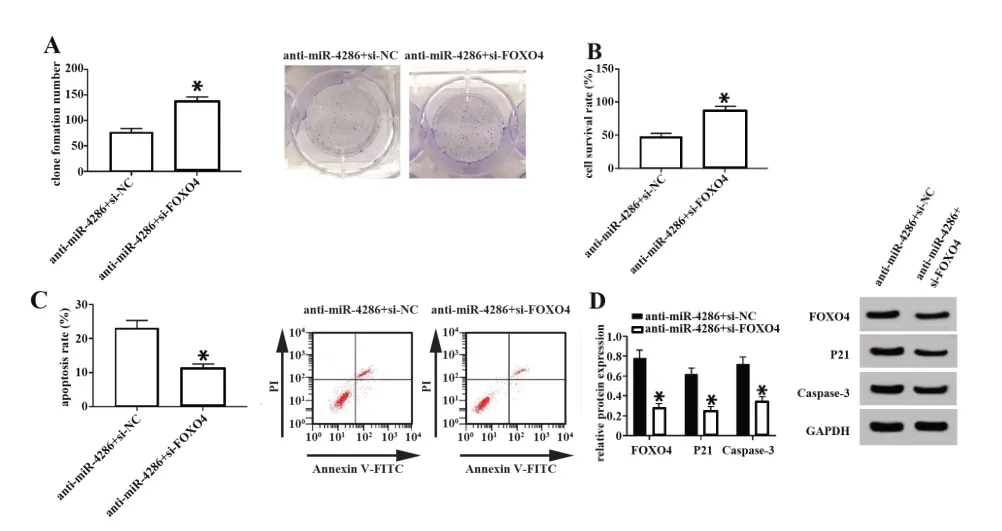
图4 抑制FOXO4能逆转抑制miR-4286对肺癌细胞增殖、凋亡的影响Fig.4 Inhibiting FOXO4 can reverse effects of inhibition of miR-4286 on lung cancer cell proliferation and apoptosis
2.6 抑制FOXO4能逆转抑制miR-4286对肺癌细胞迁移、侵袭的作用 见图5,与anti-miR-4286和si-NC共转染组比较,anti-miR-4286和si-FOXO4共转染组A549细胞E-cadherin蛋白表达显著降低,MMP-2蛋白表达显著升高,迁移和侵袭细胞数显著增加(P<0.05)。提示抑制FOXO4表达可逆转抑制miR-4286对肺癌细胞增殖和凋亡的影响。
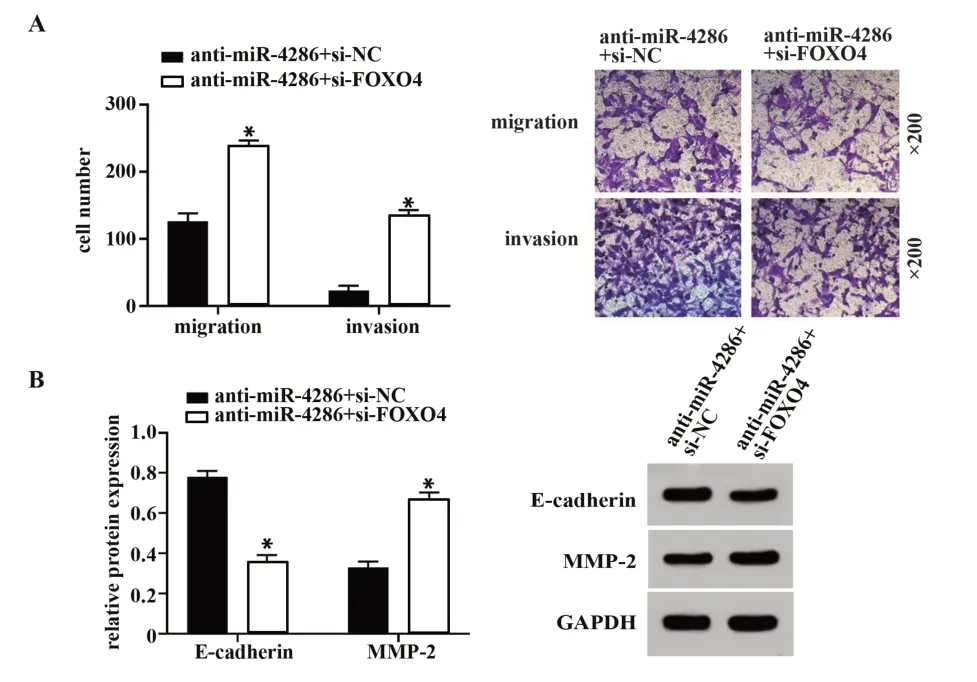
图5 抑制FOXO4能逆转抑制miR-4286肺癌细胞迁移、侵袭及E-cadherin、MMP-2蛋白表达的影响Fig.5 Inhibiting FOXO4 can reverse effects of inhibiting miR-4286 on lung cancer cell migration,invasion,and E-cadherin,MMP-2 protein expression
3 讨论
肿瘤转移是一个多步骤、多基因参与,并受精确调控的过程。阐明肺癌发生转移的分子机制,寻找有效抑制肺癌转移的靶基因对肺癌患者的精准治疗意义重大。
miR-4286已被证实是肿瘤进展的重要参与者。KOMINA等[5]研究发现黑色素瘤中miR-4286表达显著增加,转染miR-4286抑制剂后黑色素瘤细胞凋亡率增加2.6倍,细胞增殖活力下降1.7倍。LI等[11]指出miR-4286在前列腺癌中呈高表达,下调miR-4286可抑制前列腺癌细胞增殖,诱导细胞凋亡。ZHANG等[6]研究表明,miR-4286高表达通过激活蛋白酪氨酸激酶2/信号转导子与激活子3(JAK2/STAT3)信号通路显著增加细胞活力以及迁移、侵袭能力,促进食管癌发生发展。本研究显示,肺癌组织中miR-4286表达显著升高,抑制miR-4286可促进A549细胞P21和Caspase-3蛋白表达,降低细胞增殖、迁移侵袭能力,诱导细胞凋亡。黏附和侵袭在肿瘤转移中起重要作用,E-cadherin是一种典型的钙黏蛋白,其下调导致上皮细胞特征的丧失和间充质表型的获得,从而促进细胞增殖、运动和侵袭,并可能导致癌症进展[12]。MMP-2是破坏是肿瘤侵袭屏障的关键蛋白酶,其表达增加与肿瘤的转移潜能增加有关[13]。因此,抑制miR-4286可能通过抑制A549细胞MMP-2表达,促进E-cadherin表达,进而发挥抗肺癌转移作用。既往研究显示,miR-4286过表达在肺癌细胞中具有肿瘤启动子作用,抑制miR-4286表达除可抑制细胞活力、增殖和迁移以及促进细胞凋亡外,还可诱导细胞周期G1期阻滞,与本研究类似[14-15]。以上研究表明,miR-4286在肺癌中发挥癌基因作用,抑制miR-4286可有效抑制肺癌进展。
FOX转录因子是一个大的进化保守的转录调控家族,具有高度保守的双翼螺旋DNA结合域。研究显示FOXO4具有诱导细胞周期阻滞、凋亡和DNA损伤修复的功能,是人类肿瘤的理想抑癌因子[16]。FOXO4表达缺失是膀胱癌预后不良的危险因素[17]。在结肠癌和胃癌中上调FOXO4可抑制肿瘤细胞的增殖和迁移[18-19]。在肺癌中FOXO4表达缺失是上皮间质转化发生的重要原因之一,miR-150通过靶向FOXO4促肺癌转移[20]。本研究显示肺癌组织中FOXO4表达显著降低,与miR-4286的表达呈负相关。荧光素酶报告基因实验显示,FOXO4是miR-4286的功能性靶基因。外源性miR-4286模拟物或抑制物转染A549细胞可分别抑制或促进FOXO4蛋白表达。进一步研究显示抑制FOXO4表达可逆转抑制miR-4286对A549细胞增殖、迁移侵袭及凋亡的影响。提示miR-4286/FOXO4分子轴参与肺癌发生发展。
综上所述,本研究发现miR-4286/FOXO4分子轴在肺癌中表达失调。抑制miR-4286通过上调FOXO4抑制肺癌细胞增殖、迁移、侵袭,并诱导细胞凋亡。因此,靶向抑制miR-4286可能是转移性肺癌的潜在治疗策略。
