鼠伤寒沙门菌SseK1蛋白的表达及其免疫生物学特性研究①
2021-05-27杨亚东杜付玉张春杰
路 霞 杨亚东 郁 川 杜付玉 张春杰
(河南科技大学动物科技学院/洛阳市活载体生物材料与动物疫病防控重点实验室,洛阳 471023)
新发传染病是威胁人类健康和生命安全的重大医学问题,鼠伤寒沙门菌(Salmonella typhimurium)是一种对人类健康和养殖业构成严重威胁的重要病原菌,目前该菌在我国的感染发病率居沙门菌感染的首位[1-2]。沙门菌感染常用抗生素进行治疗,而抗生素的使用导致临床沙门菌耐药菌株不断产生,使药物难以治疗鼠伤寒沙门菌引起的各种疾病[3]。近几年来,亚单位疫苗备受研究者的青睐,亚单位疫苗不仅组分明确、安全性良好,且生产便利[4]。因此,对鼠伤寒沙门菌潜在的毒力因子或保护性抗原的研究尤为重要。研究发现SseK1(Salmonella secreted effector K1)是一种由鼠伤寒沙门菌致病岛SPI-2上的毒力基因所编码并由Ⅲ型分泌系统(typeⅢsecretion system,T3SS)分泌的效应蛋白。其通过T3SS分泌系统被递送到宿主细胞中,使细菌能够侵入并持续存在于宿主体内[5-7],而国内有关效应蛋白SseK1引起的炎症反应及该蛋白的抗原性研究尚未见报道,因此,本研究对鼠伤寒沙门菌SL1344的sseK1基因进行了克隆表达和纯化,并对其免疫生物学特性作了初步分析,为进一步研究鼠伤寒沙门菌与机体在感染和免疫方面的相互作用以及新型重组亚单位疫苗的开发奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株及表达载体 鼠伤寒沙门菌SL1344、表达载体pET-32a、DH5α感受态细胞和大肠杆菌BL21都由本实验室保存;克隆载体pMD-18-T购自宝生物工程(大连)有限公司。
1.1.2 主要试剂及试剂盒 镍柱亲和层析蛋白纯化试剂盒、Taq PCR Master Mix(2×,blue dye)购自生工生物工程(上海)股份有限公司;限制性内切酶BamHⅠ和HindⅢ,T4 DNA连接酶,DNA marker购自碧云天生物有限公司;质粒小量提取试剂盒购自北京康为世纪生物科技有限公司;DNA凝胶回收试剂盒购自康宁生命科学(吴江)有限公司;异丙基-β-D-硫代半乳糖苷(IPTG)购自Sigma公司;HRP标记山羊抗小鼠IgG均购自宝生物工程(大连)有限公司;6~8周龄BALB/c雌性小鼠购自郑州大学实验动物中心。
1.2 方法
1.2.1 引物设计及合成 根据GenBank已公布的鼠伤寒沙门菌SL1344株sseK1基因序列(登录号No.FQ321003.1)设计sseK1基因的PCR引物。F:5′-GGATCCATGATCCCACCATTAAATAG-3′(下 划线处为BamⅠ酶切位点);R:5′-AAGCTTCTACTG‑CACATGCCTCGC-3′(下划线处为HindⅢ酶切位点)。由生工生物工程(上海)股份有限公司合成。1.2.2 pMD-18-T-sseK1的构建与鉴定 为获得sseK1基因片段,本研究以鼠伤寒沙门菌SL1344作为模板,通过PCR方法进行扩增。PCR反应程序为:95℃5 min初始变性;95℃30 s,56℃30 s,72℃80 s,30个循环;72℃延伸10 min,琼脂糖凝胶回收PCR扩增出的sseK1片段,并连接至pMD18-T克隆载体,将携带有sseK1基因的克隆载体pMD18-TsseK1转化至大肠杆菌感受态细胞DH5α中进行扩增,对构建的pMD18-T-sseK1重组质粒进行PCR鉴定和双酶切鉴定,鉴定正确后送至生工生物工程(上海)股份有限公司对其序列进一步测序。
1.2.3 pET-32a-sseK1重组表达载体的构建与鉴定 利用限制性内切酶BamHⅠ和HindⅢ对构建重组质粒pMD-18T-sseK1进行双酶切鉴定正确后连接至质粒pET-32a,然后将携带有sseK1基因的原核表达载体pET-32a-sseK1转化至感受态细菌BL21中,经PCR和双酶切进行鉴定,构建sseK1基因原核表达菌(pET-32a-SseK1-BL21)。
1.2.4 重组菌的蛋白表达纯化及Western blot鉴定 用终浓度为1 mmol/L的IPTG对重组菌BL21(pET-32a-SseK1)进行诱导表达。用PBS重悬收集的菌体并冰浴超声,超声后分离上清和沉淀,按一定比例加入含β-巯基乙醇的SDS-PAGE蛋白上样缓冲液,煮沸处理后SDS-PAGE检测重组菌的蛋白表达情况。用镍离子亲和层析法纯化重组蛋白,然后将纯化的SseK1蛋白与兔抗鼠伤寒沙门菌阳性血清反应,进行Western blot鉴定。
1.2.5 鼠伤寒沙门菌标准强毒株LD50的测定 正式实验的最高与最低剂量分别是在预实验中求得BALB/c小鼠全死亡或90%以上死亡的剂量和动物不死亡或10%以下死亡的剂量。根据预实验结果,随机将小鼠分为5组,每组6只,选取合适的菌落稀释度,实验组小鼠每个稀释度灌胃感染剂量为200µl/只,对照组小鼠灌胃等量的无菌生理盐水。灌胃感染后,准确记录小鼠死亡情况。同时,从死亡小鼠分离细菌并用沙门菌特异性引物进行鉴定,Bliss法计算鼠伤寒沙门菌标准强毒株SL1344对小鼠的LD50。
1.2.6 小鼠免疫试验 实验分为实验1组和实验2组,对照1组和对照2组。每组8只6周龄BALB/c小鼠,免疫剂量为实验组小鼠每只100µg重组蛋白,SseK1蛋白与Montanide ISA 201 VG佐剂按体积比4.6∶5.4充分混合乳化,小鼠免疫方式采用背部皮下多点注射,背部皮下注射5个注射点,总计1 ml。免疫对照组小鼠以等量的佐剂与PBS混合后免疫。在小鼠一免14 d后加强一次免疫,免疫剂量和途径与一免相同。二免后第7天、第14天、第21天和第28天进行眼底采血,ELISA方法检测抗体效价。
1.2.7 抗体效价检测 上述免疫小鼠眼底采血后进行血清分离,用纯化的SseK1蛋白(浓度为5µg/ml)作为抗原进行包被,采用间接ELISA方法检测抗体效价。效价定义为:P为阳性450 nm处的吸光度值,N为阴性对照450 nm处的吸光度值,当P/N≥2.1判为阳性,P/N<1.5判为阴性。抗血清的效价为阳性血清的最大稀释比例。
1.2.8 小鼠淋巴细胞增殖转化试验 参考文献[8]方法,在小鼠二免14 d后,从每组中随机取3只小鼠无菌摘取脾脏,分离脾脏淋巴细胞,用RP‑MI1640培养液悬浮细胞,调整细胞浓度为1×106个/ml,每孔100µl接种于96孔细胞培养板,37℃,5% CO2条件下培养。以SseK1或ConA刺激细胞(5µg/孔),每孔设3个重复,培养72 h后加入MTT溶液(5 mg/ml)20µl/孔,继续孵育4 h后终止培养,弃去培养上清液,按150µl/孔加入DMSO,振荡10 min使结晶物充分溶解。酶标仪检测OD490nm。
1.2.9 小鼠攻毒试验 按照上述1.2.6方法免疫小鼠,在小鼠二免14 d后,分别对实验1组和对照1组小鼠进行灌胃攻毒SL1344强毒株100µl(3.16×105CFU),实验2组和对照2组小鼠则正常饲喂。攻毒后记录免疫小鼠死亡情况,从而对SseK1蛋白的免疫保护作用进行评价。
1.3 统计学处理 采用SPSS17.0对实验数据进行统计学分析,计量资料用±s表示,两组间差异比较采用Students't检验,多重比较采用单因素方差分析,以P<0.05表示差异有统计学意义。
2 结果
2.1 pMD-18-T-sseK1的构建和鉴定 以鼠伤寒沙门菌SL1344为模板,用所设计的sseK1引物PCR扩增出目的片段sseK1,经1.0%琼脂凝胶电泳显示:成功扩增出约1 000 bp大小的目的条带(图1A),与预期1 011 bp相符。用限制性内切酶BamHⅠ、HindⅢ对构建的pMD-18T-sseK1重组质粒进行双酶切鉴定,结果出现约为2 600 bp的载体条带和约1 000 bp的目的条带(图1B),表明重组质粒pMD-18-T-sseK1构建正确。随后将构建正确的重组质粒pMD-18-TsseK1送至生工生物工程(上海)股份有限公司进行测序,结果与GenBank中的鼠伤寒沙门菌SL1344株sseK1基因的同源性为100%,无差异,说明PCR扩增出的sseK1基因片段正确。
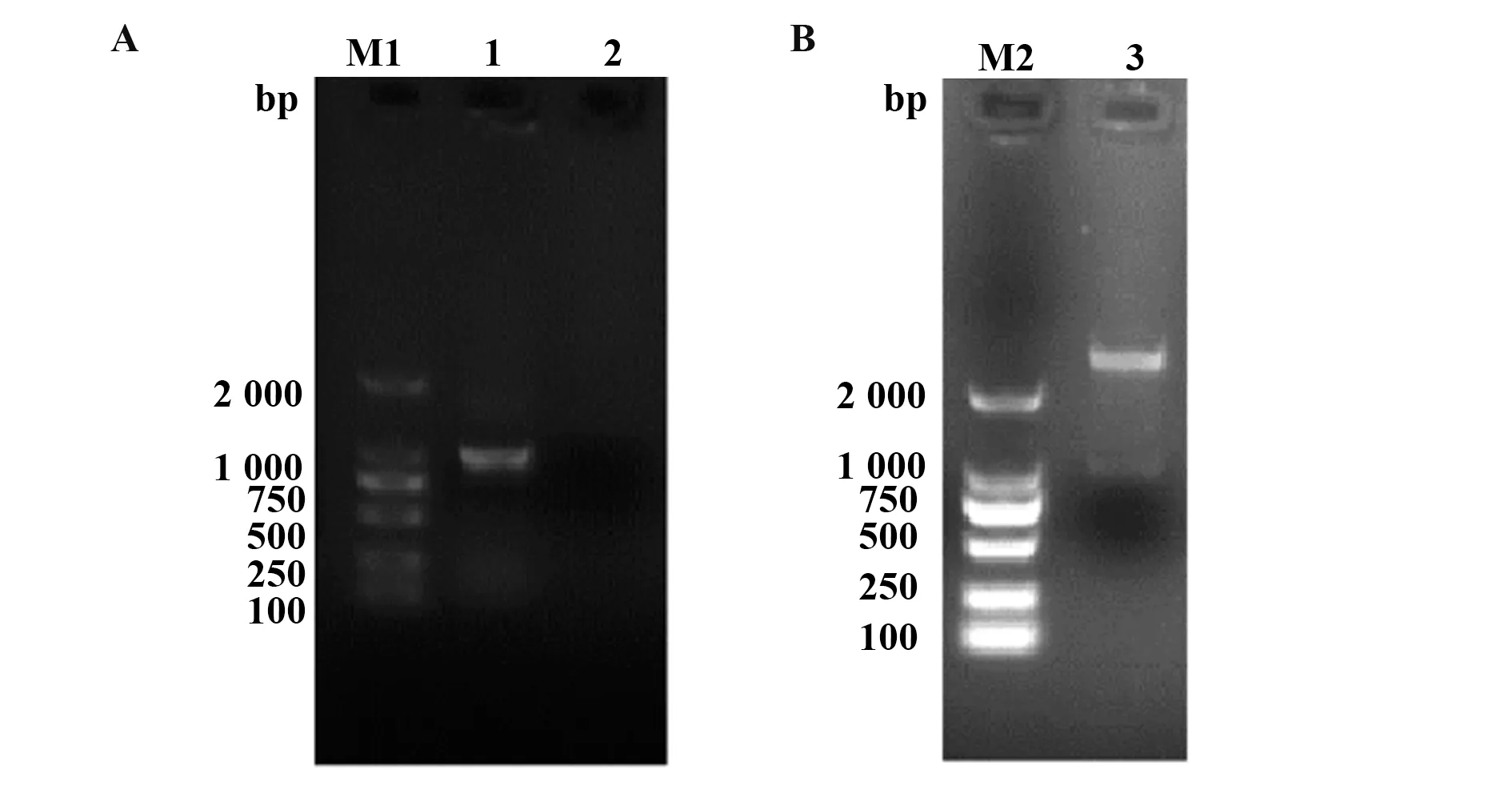
图1 sseK1基因的PCR扩增(A)和pMD18-T-sseK1(B)的酶切鉴定Fig.1 PCR amplification of sseK1 gene(A)and identifica-tion of double enzyme for pMD18-T-sseK1(B)
2.2 pET-32a-sseK1重组质粒的构建与鉴定 挑取含有pET-32a-sseK1重组质粒的菌落,提取PCR鉴定的阳性菌落的重组质粒,用限制性内切酶BamHⅠ、HindⅢ进行双酶切鉴定,电泳可见约6 000 bp载体条带和1 000 bp的目的条带(图2),与预期结果相符,说明原核表达载体构建成功。
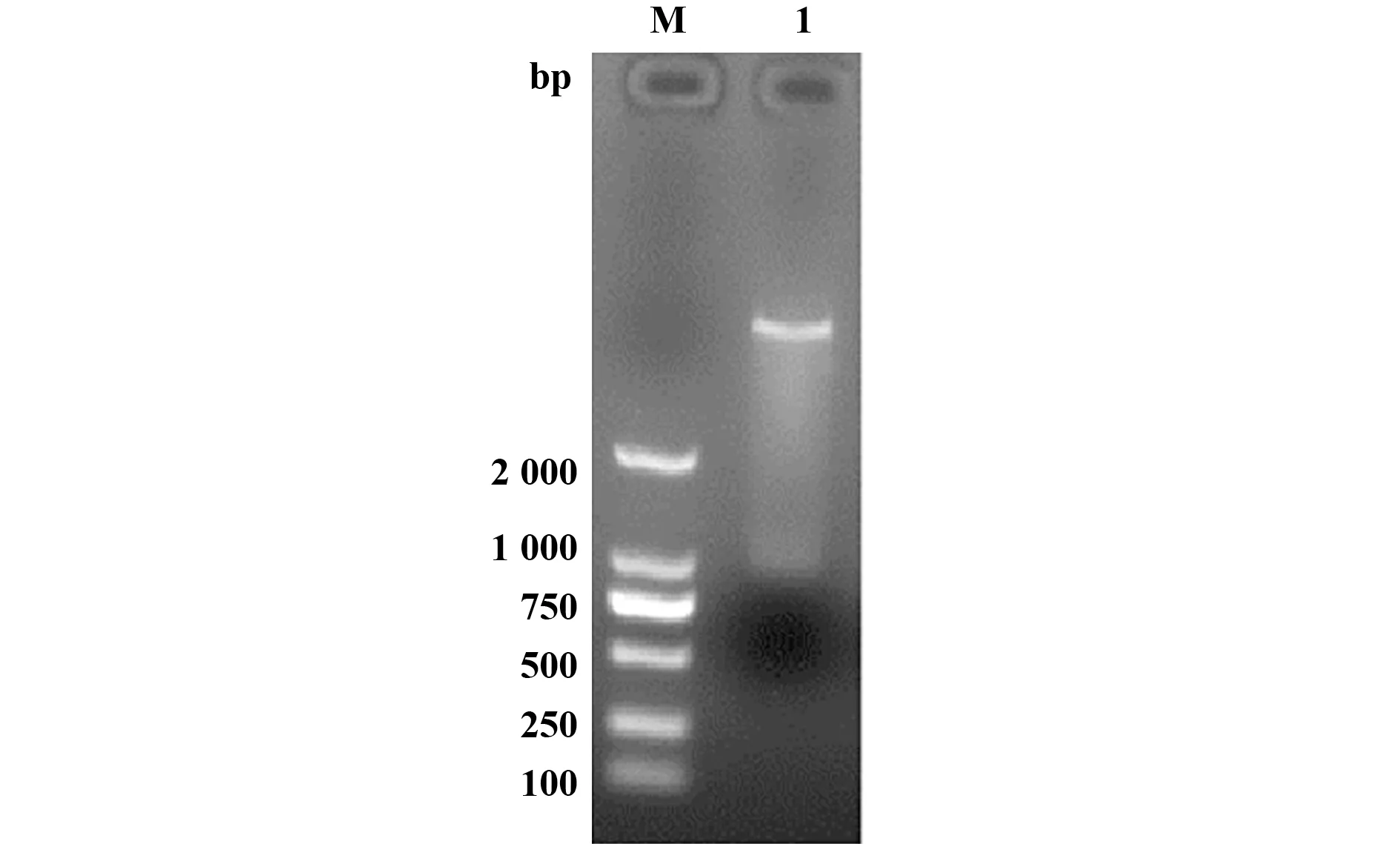
图2 pET-32a-sseK1的酶切鉴定Fig.2 Double enzyme digestion identification of pET-32asseK1
2.3 pET-32a-sseK1的诱导表达纯化及Western blot分析结果 在适宜条件下,对pET-32a-SseK1重组菌进行诱导表达和纯化。SDS-PAGE分析显示,表达的融合蛋白在约43 kD处有表达带(图3),说明该蛋白主要以可溶性蛋白形式存在于菌体超声破碎后的上清中。经镍柱亲和层析纯化后可见较纯的融合蛋白条带,经Western blot鉴定,该重组表达蛋白大小正确,为SseK1蛋白(图4)。

图3 重组蛋白SseK1的SDS-PAGE分析Fig.3 SDS-PAGE analysis of recombinant protein SseK1

图4 重组蛋白的Western blot鉴定Fig.4 Western blot identification of recombinant protein
2.4 LD50的测定 用标准强毒株对小鼠口服感染,实验组小鼠均出现不同程度的死亡。从死亡小鼠中分离的细菌均能用pi1/pi2引物扩增出约580 bp的特异性条带;对照组小鼠存活正常。Bliss法计算鼠伤寒沙门菌标准强毒株SL1344灌胃感染小鼠的LD50为3.16×105CFU(表1)。

表1 鼠伤寒沙门菌标准强毒株SL1344的毒力测定Tab.1 Mortality of mice after infection with Salmonella typhimurium SL1344
2.5 重组蛋白诱导的抗体反应 用重组蛋白对小鼠进行二免后第7天即可诱导产生一定水平的特异性抗体,小鼠血清抗体效价达到1∶14 000,而佐剂与PBS组则未产生特异性抗体;第14天血清抗体效价均为1∶38 000;第21天抗体效价达到最大,为1∶124 000;第28天效价与第21天相比较抗体效价有所降低,为1∶46 000;且实验组IgG水平均显著高于佐剂与PBS混合组,差异具有统计学意义(P<0.05)。
2.6 细胞免疫反应 以SseK1(5µg/孔)对小鼠脾脏淋巴细胞进行刺激,阳性对照组以相同剂量的ConA刺激,对于阴性对照组则不作处理。结果表明,只有以SseK1刺激的实验组和以ConA刺激的阳性对照组产生了显著的T淋巴细胞增殖反应,差异具有统计学意义(P<0.01,图5)。

图5 小鼠T淋巴细胞增殖转化试验结果Fig.5 T lymphocyte proliferation in immunized mice
2.7 重组蛋白对小鼠免疫保护效果检测 小鼠死亡情况为:7 d内,对照1组小鼠全部死亡;实验1组死亡1只;8~15 d内,实验1组小鼠死亡2只,其余5只一直存活至观察期结束,观察期为14 d;对照2组和实验2组小鼠均正常存活。鼠伤寒沙门菌强毒株对重组蛋白SseK1二免14 d后的小鼠攻毒产生60%以上的免疫保护率。
3 讨论
鼠伤寒沙门菌是一种导致人和多种动物食源性感染和胃肠道感染的重要病原菌,严重时能够引起哺乳动物和人死亡,对公共卫生构成了重大的负担[9-10]。近年来,沙门菌病主要靠药物预防和治疗,但是由此引发了沙门菌耐药株的产生和动物食品药物残留等严重问题。目前,亚单位疫苗及重组疫苗已逐渐成为人们研究的热点,其中亚单位疫苗因为组成成分明确,结构简单,安全和特异性好而备受研究者的关注[11]。而筛选有效的免疫抗原蛋白是制备新型高效沙门菌亚单位疫苗的基础和关键,这些保护性抗原的鉴定为新一代的亚单位疫苗的研制提供了方向。
在感染宿主过程中许多细菌通过表达毒力基因做出响应,在宿主致病的发生发展中发挥作用,而那些在宿主体内表达的毒力基因,如果其编码的蛋白质具有抗原性,那么这些基因对研究病原菌致病机理及研制安全有效的疫苗则具有重要的研究意义[12-13]。沙门菌毒力的一个重要组成部分是沙门菌毒力岛SPI-2编码的T3SS分泌系统。通过这种蛋白分泌系统,沙门菌能将囊泡中的效应蛋白转运到宿主细胞中,干扰先天免疫应答所需要的关键信号传 导 途 径[14]。SseK1(Salmonella secreted effector K1)作为鼠伤寒沙门菌致病岛SPI-2编码的一个重要的效应分子,已被鉴定为鼠伤寒沙门菌感染宿主细胞过程中必不可少的毒力蛋白[15]。另外有研究表明SseK1可通过调控宿主细胞上的NF-κB信号通路来调控沙门菌对于细胞的侵染,在沙门菌的致病中发挥着重要作用,且SseK1基因在沙门菌染色体基因组上高度保守,具有良好的研究价值[16]。而关于鼠伤寒沙门菌SseK1蛋白结构功能及免疫原性的研究在国内尚未见报道。因此,本实验克隆了鼠伤寒沙门菌SseK1基因,在大肠杆菌BL21中进行了诱导表达,并对其免疫生物学特性做了初步研究。
研究表明,重组蛋白SseK1经SDS-PAGE分析,在约43 kD处有比较明显的特异蛋白表达带,与预期大小一致。Western blot分析显示,纯化后的SseK1重组蛋白可与兔抗鼠伤寒沙门菌阳性血清反应,在约43 kD处有SseK1重组蛋白单一条带,表明SseK1蛋白具有良好的反应原性。在重组蛋白SseK1诱导抗体反应中,二免后第21天抗体效价达到最大,为1∶124 000,并于第4周起降低,且实验组IgG水平均显著高于佐剂与PBS混合组,差异具有统计学意义(P<0.05),该结果与LIAUDET等[17]将纯化后沙门菌重组鞭毛蛋白腹腔注射小鼠后而引起的血清中相关炎症因子分泌量增加的研究结果相似;在细胞免疫反应中,小鼠脾脏淋巴细胞以SseK1蛋白刺激的实验组和以相同剂量ConA刺激的阳性对照组均产生了显著的T淋巴细胞增殖反应,差异具有统计学意义(P<0.01),阴性对照组并未引起,说明SseK1能够有效地刺激机体的免疫功能。在重组蛋白对小鼠的免疫保护效力检测中,重组蛋白Ssek1二免14 d后的小鼠对鼠伤寒沙门菌强毒株攻毒产生60%以上的免疫保护率,充分表明重组sseK1蛋白具有良好的免疫原性和保护效力。
综上所述,鼠伤寒沙门菌SseK1重组蛋白可被兔抗鼠伤寒沙门菌阳性血清识别,具有较高的抗体效价,能够显著刺激小鼠T淋巴细胞增殖,并能提供较好的免疫保护效力,表明SseK1蛋白具有生物学活性和良好的抗原性,能激发机体产生强烈的细胞免疫应答和较好的体液免疫应答,可以作为重组亚单位疫苗的候选抗原蛋白,为深入研究鼠伤寒沙门菌与机体在感染和免疫方面的相互作用奠定了一定的理论基础。
