大鼠急性低氧运动对心肌细胞瞬时外向钾电流的影响
2021-05-27马山山李佳鑫陈雅婷蔡钟奇白婧刘传斌李泱曹雪滨
马山山,李佳鑫,陈雅婷,蔡钟奇,白婧,刘传斌,李泱*,曹雪滨
(1承德医学院研究生院,河北 承德 067000;2解放军陆军第八十二集团军医院心肾内科,河北 保定 071000;3河北大学中医学院,河北 保定 071000;4解放军总医院第六医学中心心血管病医学部研究所,北京100048)
随着高原地区经济和旅游业突飞猛进的发展,越来越多的平原人前往高原地区。西部高原也是我国国防的重中之重,而平原地区部队急进高原,尤其是在急进高原后进行强体力作业(抢险救灾、军训军演、爬山负重等)将引起机体尤其是心脏功能的损伤[1]。高原低氧环境对心脏功能的损伤导致心律失常事件增加已被广泛认知[2,3]。急性运动后心率变异性增高,机体氧化应激水平明显升高,导致心功能降低,心律失常时间增加[4]。但急进高原低氧与强体力作业复合应激刺激对心脏功能的影响研究较少,相关机制尚不清楚。
众所周知,心律失常的基础是心肌细胞电生理改变,急性缺氧和力竭运动均可改变心脏电生理,诱发心律失常[5,6]。瞬时外向钾电流(transient outward potassium current,Ito)是心肌细胞复极化电流的一个重要成分,它主要参与了动作电位复极化的1 期和2期,其改变可引起复极异常,诱发心律失常[7]。虽然已有低氧状态下Ito电流改变的研究,但目前尚未发现力竭运动是否也影响Ito,尤其是急性低氧和力竭运动复合应激源刺激对Ito电流影响尚未见报道。本研究利用低压氧舱联合转轮力竭运动制备大鼠应激模型,利用膜片钳技术记录单个心房肌细胞Ito的变化,进一步探讨其电流变化的门控机制,探究急进高原后进行强体力作业诱发心律失常的可能细胞电生理机制。
1 材料与方法
1.1 试剂与溶液
胶原酶Ⅱ、胰蛋白酶、牛血清白蛋白、天门冬氨酸钾、丙酮酸钠、三磷酸腺苷镁(magnesium adenosine triphosphate,MgATP)、4-羟乙基哌嗪乙磺酸[4-(2-hydroxyerhyl)piperazine-1-erhanesulfonic acid,HEPEs]、CaCl2、CdCl2、BaCl2、4-氨基吡啶(4-aminopyridine,4-AP)、河豚毒素(tetrodotoxin,TTX)、乙二醇醚二胺四乙酸(ethylene glycol ether diamine tetraacetic acid,EGTA)、多非利特均为美国希格玛公司产品;其他试剂均为分析纯。
台氏液(Tyrode′s solution,Tyrode′s 液)的组成成份:NaCl 135.00 mmol/L,KCl 5.40 mmol/L,CaCl21.80 mmol/L,MgCl21.00 mmol/L,NaH2PO40.33 mmol/L,HEPEs 10.00 mmol/L,葡萄糖10.00 mmol/L,pH值用NaOH调至7.3;无钙Tyrode液和0.20 mmol/L Ca2+Tyrode液,分别为Tyrode液中不加CaCl2和加0.20 mmol/L CaCl2。
记录Ito电流的细胞外液:NaCl 140.0 mmol/L,MgCl25.0 mmol/L,CaCl20.5 mmol/L,HEPEs 5.0 mmol/L,CdCl20.1 mmol/L,用NaOH调pH值至7.2。
记录Ito电流的细胞内液:KCl 45 mmol/L,门冬氨酸钾(K-aspartate)85 mmol/L,天冬氨酸钠(Na-pytuvate)5 mmol/L,MgATP 5 mmol/L,EGTA 10 mmol/L,HEPEs 10 mmol/L,葡萄糖11 mmol/L,用KOH调pH值至7.4。
细胞保护液(KB solution,KB液):KOH 110 mmol/L,牛磺酸10 mmol/L,草酸10 mmol/L,谷氨酸70 mmol/L,KCl 25 mmol/L,KH3PO410 mmol/L,EGTA 5 mmol/L, HEPEs 5 mmol/L,葡萄糖10 mmol/L,用KOH调至pH 7.4。
1.2 仪器
动物实验氧舱(中国烟台冰轮高氧舱有限公司,10-UWC800-02)、真空压力表(中国青岛工业仪表研究所,MC02000113)、数字智能测氧仪(中国北京航天鹏程仪器仪表有限公司,ML-I)、膜片钳放大器(美国分子仪器公司,Axon-700B)。刺激信号及电压输入信号的采集应用数模转换器(美国分子仪器公司,Digidata 1440A),处理软件(美国分子仪器公司,pCLAMP10.4)。微电极拉制仪(日本成茂公司,pp-83)。
1.3 建立大鼠低氧运动模型
健康雄性清洁级SD大鼠40只,购买自解放军总医院动物中心,体质量(160±15)g,实验室环境下喂养7 d,使大鼠熟悉环境。将大鼠随机分为以下4组,每组10只:低氧运动组(hypoxic exercise,HO-E)、低氧安静组(hypoxic quiescent,HO-Q)、常氧运动组(normal oxygen exercise,NO-E)、常氧安静组(normal oxygen quiescent,NO-Q)。参照文献进行低压氧舱/跑轮运动模拟试验[8,9],选择2组低压氧舱的大鼠,单只置于饲养笼或力竭运动跑轮中,分别放入低压氧舱内,关闭低压氧舱舱门,打开负压泵与负压阀,控制降压速度,使低压氧舱氧分压在25 min左右降低至61.6 kPa。其中HO-E组跑轮运动时间设定:总时间为4 h,每运行25 min停转5 min,运行速度为18 m/min,正转倒转交替进行,试验结束时打开泄压阀,在25 min左右升压至大气压;HO-Q组:在上述低氧条件下饲养4 h。待低压氧舱内气压稳定至大气压后,开启舱门取出跑轮和饲养笼。
选择2组常氧的大鼠,单只置于饲养笼或力竭运动跑轮中,依照低氧组设定条件进行实验。
1.4 大鼠单个心室肌细胞分离
参照文献采用酶解法制备心室肌单细胞[10]。上述各组大鼠经腹腔20%水合氯醛(2 ml/kg)麻醉,迅速取心脏,在37℃和通氧条件下行离体哺乳动物心脏灌流(Langendorff法)。用无Ca2+Tyrode′s 液灌流3~5 min,用含Ⅱ型胶原酶50 mg、胰蛋白酶8 mg无Ca2+Tyrode′s 液灌流(30 ml)15~20 min。沿房室间沟取心室肌,剪碎入KB液中并吹打使细胞脱落,并于2℃~8℃保存,1.0 h后进行实验。取保存液加于1.0 ml灌流槽中,待细胞贴壁后,于倒置显微镜下选择边缘整齐、表面无颗粒、横纹清晰、无收缩的细胞,室温下进行实验。
1.5 干扰电流的排除
于细胞外液加入多非利特5 nmol/L阻断IKr,CdCl2100 μmol/L阻断ICa-L,TTX 100 μmol/L阻断INa。
1.6 膜片钳全细胞记录
采用全细胞膜片钳记录方法,在电压钳制下记录电流。将膜片钳放大器同计算机连接。刺激信号及电压输入信号的采集应用数模转换器,均由软件控制。GG-17玻璃毛坯经pp-83微电极拉制仪拉制成电阻为2.0~5.5 MΩ的电极。调节三维操纵器进行封接,使封接电阻达1 GΩ 以上,吸破细胞膜形成全细胞记录模式。测定电容时,施以0.4 V/s的斜坡刺激,测电流并按方程Cm=I/(dV/dt)计算(Cm为膜电容,I为电流值,dV/dt即电压斜率)。为消除细胞间的误差,I值以电流密度(pA/pF)表示。信号经截止频率为1 kHz的四阶贝塞尔低通滤波器滤波,采样率为5 kHz。串联电阻补偿90%~95%以消除电压偏差,液接电位补偿校正至小于2 mV,慢电容补偿约为85%~90%,以消除膜电容的充放电影响。
1.7 电流参数的设定[11]
Ito的峰值电流测定:在电压钳方式下,保持电位-80 mV,先给予-40 mV,20 ms的预刺激失活钠电流,施予+40 mV,300 ms的去极化脉冲,可记录到快速激活的外向电流,该电流被2 mmol/L的4-AP阻断,即为Ito。
Ito电流-电压曲线的绘制:在电压钳方式下,保持电位-80 mV,先给予-40 mV,20 ms预刺激失活钠电流,再施予300 ms,阶跃10 mV,-40 mV~+50 mV的系列去极化脉冲,求算电流密度。以各电压下的电流密度与测试电压作图,得电流-电压曲线。
Ito稳态激活曲线的绘制:保持电位-80 mV,先给予-40 mV,20 ms的预刺激失活钠电流,再施予500 ms,阶跃为10 mV,-80 mV~+40 mV的系列去极化脉冲,可记录到Ito电流,标准化各电流幅值,以相对电流对各膜电位作图得稳态激活曲线,并用Boltzmann方程I/Imax=1/{1 + exp[(Vm-V1/2)/k]}进行曲线拟合求出半激活电压(V1/2)和激活曲线斜率(k)。
Ito稳态失活曲线的绘制:保持电位-80 mV,施予1000 ms,阶跃为10 mV,-90 mV~+20 mV的系列去极化脉冲在每一条件脉冲后紧跟一固定去极化至+40 mV,300 ms的测试脉冲,记录Ito,标准化各电流幅值,以相对电流对各膜电位作图得稳态失活曲线,并用Boltzmann方程I/Imax=1/{1+exp[-(Vm-V1/2)/k]}进行曲线拟合求出半失活电压(V1/2)和失活曲线斜率(k)。
Ito关闭态失活时间常数:钳制电位-110 mV,给予+40 mV,300 ms的条件刺激,回复至-110 mV,再给予-65 mV,5、10、25、50、100、200、400、800 ms不同时间使通道失活,在每个时间间隔后紧接着一个+40 mV,300 ms的测试刺激,此过程用单项指数式拟合。
Ito失活后恢复曲线的绘制:钳制电位-80 mV,给予+40 mV,300 ms的去极化脉冲,分别间隔40、80、160、320、640、1280、2560和5120 ms后,再施予第2次+40 mV,300 ms的方波刺激,将第2次方波脉冲引出的电流与条件刺激电流相比,按单项指数式:I=A×Exp(-t/τ),求出恢复曲线的值。
1.8 统计学处理

2 结 果
2.1 急性低氧运动对大鼠心室肌细胞Ito电流密度的影响
在+40 mV时,NO-Q组、HO-Q组、NO-E组和HO-E组电流密度分别为 (28.2±3.2)、(17.6±1.9)、(14.5±2.1)和(9.8±1.1)pA/pF。HO-Q组、NO-E组、HO-E组与NO-Q组比较,差异均有统计学意义(P<0.05或P<0.01)。与常NO-Q组相比,NO-E组大鼠心室肌细胞的Ito电流密度明显降低,说明急性低氧运动可明显降低Ito电流密度,且较单独急性低氧或力竭运动的效应更加明显(图1)。
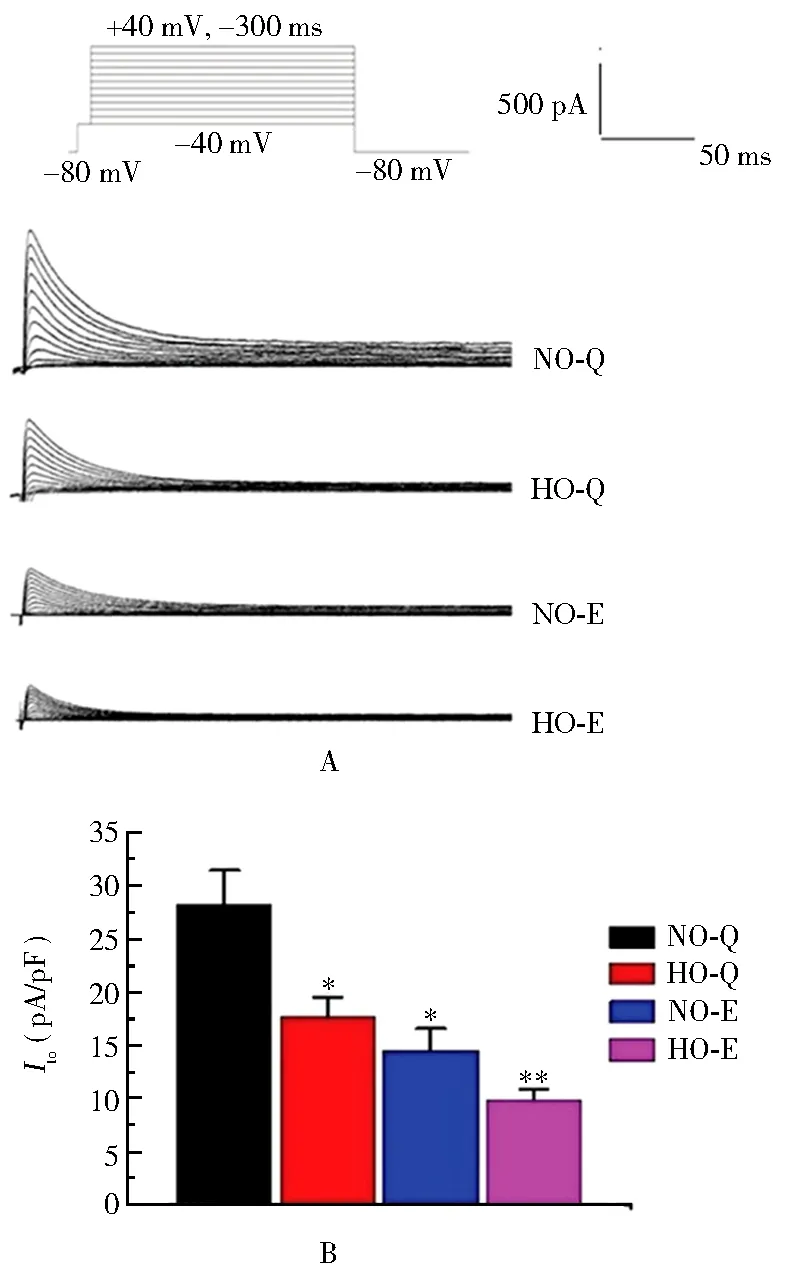
图1 急性低氧运动对Ito电流幅值及电流密度的影响Figure 1 Effect of acute hypoxic exercise on Ito current amplitude and current density A: influence of acute hypoxic exercise on current amplitude; B: effect of acute hypoxic exercise on peak current density. Ito: transient outward potassium current; NO-Q: normal oxygen quiescent; HO-Q: hypoxic quiescent; NO-E: normal oxygen exercise; HO-E: hypoxic exercise. Compared with NO-Q group, *P<0.05, ** P<0.01.
2.2 急性低氧运动对大鼠心室肌细胞Ito作用的电压依赖性
大鼠心肌细胞约在-10 mV 电位刺激时,Ito电流开始被激活,随着刺激脉冲向去极化移动,电流密度逐渐增加,并呈现出明显的外向整流特征。低氧运动后,各电压下电流密度均降低,尤其是在+10 mV以上,随着刺激电压的增加电流密度降低更加明显,提示低氧运动时大鼠心室肌细胞Ito的阻滞效应具有电压依赖性特征(图2)。

图2 急性低氧运动对Ito电流I-V曲线的影响Figure 2 Effect of acute hypoxic exercise on I-V curve of Ito current Ito: transient outward potassium current; I-V: voltage-current curve; NO-Q: normal oxygen quiescent; HO-Q: hypoxic quiescent; NO-E: normal oxygen exercise; HO-E: hypoxic exercise.
2.3 急性低氧运动对大鼠心室肌细胞Ito稳态激活的影响
低氧运动后,大鼠心室肌细胞的Ito激活曲线明显向去极化方向移动,NO-Q组半激活电压(V1/2,act)为(-36.4±2.4)mV、而HO-Q组、NO-E组和HO-E组分别为(-32.8±3.5)、(-26.0±2.7)和(-17.9±2.1)mV。其中NO-E组、HO-E组与NO-Q组相比,差异有统计学意义(P<0.05或P<0.01)。低氧运动对通道激活曲线斜率(kact)几乎无影响(图3)。进一步,单纯低氧应激较单纯力竭运动均对通道半激活电压有影响,但前者小于后者。
2.4 急性低氧运动对大鼠心室肌细胞Ito稳态失活和关闭态失活的影响
研究结果显示,低氧运动使大鼠心肌细胞Ito稳态失活左移,半失活电压(V1/2inact)数值增大,且低氧运动使通道的失活曲线斜率(kinact)增加,提示在相同刺激电位下,低氧运动后通道失活增加,有效通道数减少(图4)。进一步,单纯低氧应激与单纯力竭运动对通道半失活电压的影响相似,而单纯低氧应激与单纯力竭运动对通道失活斜率电压的影响要小,且两者之间存在显著性差异(P<0.05),提示单纯低氧应激降低Ito电流的门控机制由改变稳态激活及稳态失活电压所致,而单纯力竭运动降低Ito电流的门控机制主要来自稳态失活斜率的改变。

图3 急性低氧运动对Ito电流稳态激活曲线的影响Figure 3 Effect of acute hypoxic exercise on steady-state activation curve of Ito current A: acute hypoxic exercise shifts the current steady-state activation curve to the right; B: acute hypoxic exercise shifts the semi-activated voltage to the correct voltage; C: acute hypoxic exercise causes the slope of the current steady-state activation curve to change less. Ito: transient outward potassium current; NO-Q: normal oxygen quiescent; HO-Q: hypoxic quiescent; NO-E: normal oxygen exercise; HO-E: hypoxic exercise. Compared with NO-Q group, *P<0.05, ** P<0.01.

图4 急性低氧运动对Ito电流稳态失活曲线的影响Figure 4 Effect of acute hypoxic exercise on steady-state inactivation curve of Ito current A: acute hypoxic exercise shifts the current steady-state inactivation curve to the left; B: acute hypoxic exercise shifts the half-inactivation voltage to a more negative voltage; C: acute hypoxic exercise increases the slope of the current steady-state inactivation curve. Ito: transient outward potassium current; NO-Q: normal oxygen quiescent; HO-Q: hypoxic quiescent; NO-E: normal oxygen exercise; HO-E: hypoxic exercise. Compared with NO-Q group, *P<0.05, ** P<0.01.
关闭态失活动力学结果显示,低氧运动对关闭态失活曲线及电流的时间参数虽有影响,但差异无统计学意义。提示急性低氧运动抑制通道电流的作用与通道关闭态失活关系不大(图5)。
2.5 急性低氧运动对大鼠心室肌细胞Ito失活后恢复曲线的影响
大鼠心室肌细胞Ito的失活后恢复在HO-E组显著减慢,恢复时间常数(τ)明显延长,NO-Q组、HO-Q组、NO-E组和HO-E组时间常数分别为(333.2±25.1)、(382.5±17.8)、(430.2±31.6)和(464.2±29.7)ms,可见低氧联合力竭运动后Ito的恢复曲线明显右移,提示通道失活后恢复过程减慢(图6)。

图5 急性低氧运动对Ito电流关闭态失活动力学的影响Figure 5 Effect of acute hypoxic exercise on inactivation mechanics of Ito current closed state Ito: transient outward potassium current; NO-Q: normal oxygen quiescent; HO-Q: hypoxic quiescent; NO-E: normal oxygen exercise; HO-E: hypoxic exercise.

图6 急性低氧运动对Ito电流失活后恢复动力学的影响Figure 6 Effect of acute hypoxic exercise on recovery kinetics after Ito current inactivation A: acute hypoxic exercise makes the recovery curve shift to the right after the current is inactivated; B: acute hypoxic exercise increases the recovery time constant after the current is inactivated. Ito: transient outward potassium current; NO-Q: normal oxygen quiescent; HO-Q: hypoxic quiescent; NO-E: normal oxygen exercise; HO-E: hypoxic exercise. Compared with NO-Q group, *P<0.05.
3 讨 论
高原低氧环境和运动应激均能对心脏功能造成损伤,研究显示,急进高原人员心脏功能明显降低,心电图发生显著变化,易诱发心律失常的发生[12,13]。但急进高原低氧环境中运动应激复合刺激影响心肌电生理及心律失常的机制尚不清楚。本研究发现,在急性低氧联合力竭运动的大鼠模型中,心室肌细胞的Ito降低,而且较单独低氧或运动的效应更加明显。Ito电流的大小对动作电位的形态和时程有较大影响,主要与动作电位的复极1相有关。研究显示,当心肌应激时,Ito作为复极早期的重要电流,其电流密度降低将诱发心律失常[14]。本研究结果提示急性低氧运动导致心律失常发生的机制很可能与其阻滞心室肌细胞细胞膜Ito电流、延长动作电位时程、导致心肌细胞复极异常有关。
通过门控机制研究,我们发现Ito电流降低主要与急性低氧运动后通道稳态激活和稳态失活过程有关,使相同电位刺激时,通道开放降低,失活增加,从而降低有效通道的数量,引起Ito电流密度降低。同时,电流降低还与急性低氧运动使通道失活后恢复动力学减缓,恢复时间常数增加有关,进一步延缓了心肌的动作电位时程[15]。但急性低氧运动对通道关闭态失活动力学几乎没有影响。本研究结果显示,单纯低氧应激与单纯力竭运动均可降低Ito密度,但两者Ito通道的门控机制效应却不相同,单纯低氧应激比单纯力竭运动对通道失活斜率电压的影响更小,提示单纯低氧应激降低Ito电流的门控机制由改变稳态激活及稳态失活电压所致,力竭运动降低Ito电流的门控机制主要来自稳态失活斜率的改变。
本实验局限性在于未能深入探究调节Ito通道蛋白的相关基因。我们知道,一个离子通道电流的改变,主要来自两个方面:(1)通道门控机制的变化,包括通道稳态激活、稳态失活过程、激活与失活动力学及失活后恢复动力学的改变[11];(2)细胞膜有效通道数量的变化,可能由于通道基因合成、转录、翻译及翻译后修饰,尤其是通道蛋白从高尔基体向细胞膜的转运过程改变[16],而基因和蛋白的表达,特别是Kv4.2/Kv4.3蛋白在细胞膜的表达,直接影响Ito电流密度的大小,这在今后的工作中需要补充研究。
本研究结果显示,心肌细胞瞬时外向钾电流的变化作为影响心肌电生理的基础,是急性低氧运动导致心律失常的重要机制之一,为相关复合应激刺激引起的心肌损伤和心律失常的机制探讨提供理论依据。
