室温条件下青海湖水中镁离子浓度对沉淀碳酸钙同质多像类型的调控
2021-05-26牛元哲冯诗海
杨 康,李 红,雷 云,牛元哲,冯诗海
(大陆动力学国家重点实验室,西北大学 地质学系,陕西 西安 710069)
青海湖是我国最大的内陆性封闭微咸-咸水湖(Henderson and Holmes, 2009),位于青藏高原的东北隅。近年来有报道发现湖底沉积物中除陆源碎屑和粘土矿物外,还有自生碳酸盐矿物,如方解石、文石和白云石(刘兴起等,2003;李善营等,2006;于炳松等,2007)、高镁方解石和文石等(金章东等,2013)。由于青海湖独特的地理位置以及对全球性气候变化的敏感性,以往的研究多是试图通过自生碳酸盐的沉积记录来反演古气候的变化特征(王云飞,1993; Liuetal., 2009)或推断青海湖的演化趋势(Lietal., 2012),然而了解自生碳酸盐矿物形成机理对于解释湖泊沉积物中自生碳酸盐岩中记录的古气候意义至关重要(Xuetal., 2010)。目前对于青海湖水中各种自生碳酸盐矿物的形成机理研究较少,鉴于此,本文选用正常青海湖水和除菌青海湖水作为主要载体,通过实验观测不同浓度的Mg2+对碳酸钙同质多像体沉淀矿物的影响,以期为常温条件下青海湖水中碳酸盐矿物形成机理的研究提供实验参考。
1 实验部分
1.1 实验水样的获取

1.2 仪器与试剂
实验用到的主要仪器有FEI Quanta 400 FEG型环境扫描电子显微镜(捷克FEI公司)、OXFORD IE 350型能谱仪(英国OXFORD公司、D/MAX-3C型X射线衍射仪(日本理学公司)、SHB-Ⅲ型循环水式多用真空泵(郑州长城科工贸有限公司)、DHG-9030A型电热鼓风干燥箱(上海一恒科学仪器有限公司),过滤装置购自四川蜀牛玻璃仪器有限公司。
主要试剂有CaCl2(天津市恒兴化学试剂制造有限公司)、MgCl2·6 H2O(天津市化学试剂三厂)、无水乙醇(天津市富宇精细化工有限公司)和蒸馏水。所用试剂均为分析纯。
1.3 晶体的制备
将取回来的青海湖水分为若干份倒入编号的烧杯之中,每份50 mL。取其中6份湖水,按照表1所示,称取不等量的CaCl2添加进湖水,再取其中的8份湖水,称取等量的CaCl2和不等量的MgCl2·6 H2O添加进湖水中。使用玻璃棒搅拌5~10 min后用透明薄膜密封,置于反应台上,在常温条件下(25±2 ℃)反应48 h。待反应结束后,使用过滤装置过滤出粉末状的沉淀物,将沉淀物用无水乙醇洗涤2~3次,再将其放到电热鼓风干燥箱干燥,然后进行粉晶X射线衍射分析、扫描电镜和能谱分析。
为了消除青海湖水中微生物及有机质对沉淀矿物可能带来的潜在影响,本次实验还利用除菌处理后的青海湖水进行了对照的实验(表1、表2),除菌处理具体步骤如下:在无菌操作台上用紫外线灯持续照射青海湖水24 h,随后用抽滤装置将细菌和有机质过滤,仅保留湖水。
1.4 晶体的表征

表 2 两类青海湖水中添加MgCl2·6 H2O和CaCl2的实验条件
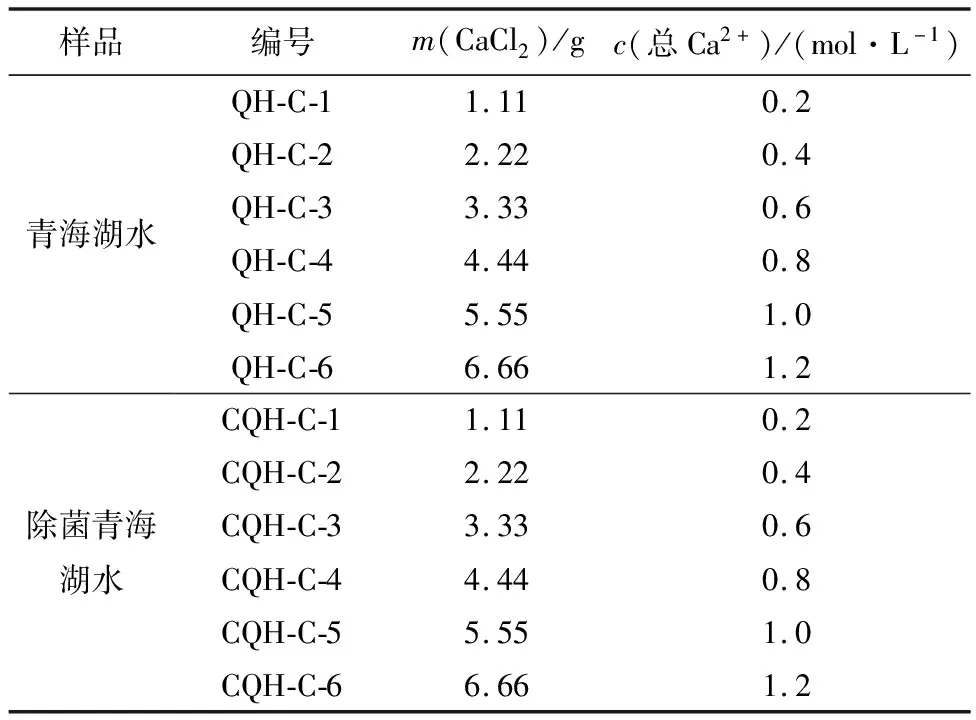
表 1 两种青海湖水中添加CaCl2的实验条件
采用环境扫描电子显微镜系统(SEM)对不同条件所得的沉淀样品进行了外观形貌及分散状态观察,将晶体均匀粘在贴有双面胶的样品台上,喷金,然后置于样品室中观察,放大倍数为400~100 000。
采用X射线衍射仪(XRD)对沉淀样品进行物相分析,Cu 靶,石墨单色滤光片,X射线衍射仪的测试条件:狭缝SS/DS 为1°, RS为0.15 mm,工作电压35 kV,管电流35 mA, 连续扫描,扫描步长为0.02°,扫描范围为0~70°。
2 实验结果
2.1 湖水添加CaCl2时生成的沉淀
在向青海湖水添加CaCl2的实验中,所得到的沉淀物XRD表征如图1a所示。从图中可以看出,沉淀物为石膏和球霰石的混合物,属于石膏的特征衍射峰清晰明了,尖锐笔直,而球霰石特征衍射峰在图谱中只出现了少部分,且峰值非常低。湖水中Ca2+的浓度从0.2 mol/L增加到1.2 mol/L,石膏和球霰石的特征衍射峰值变化的幅度很小且无明显规律,但没有出现新的特征衍射峰,说明沉淀矿物并没有发生改变,依旧是以石膏为主的石膏、球霰石两者混合物。表3列出了沉淀物石膏和球霰石的相对含量,从中可以看出Ca2+浓度的变化对于各类生成物的含量没有明显影响。将除菌的青海湖水的实验结果与上述结果进行对比,发现沉淀矿物无论是种类还是相对含量并无明显变化(表3、图1b)。
2.2 湖水加CaCl2和MgCl2·6H2O时生成的沉淀物
向两类青海湖水中同时添加CaCl2和MgCl2·6 H2O,所得沉淀物的X射线衍射结果如图2所示,生成物类型及相对含量见表4。从图2中可以看出,此时生成的沉淀物与只添加Ca2+所得到的沉淀物有明显不同,图1中尖锐笔直的石膏特征衍射峰完全消失,取而代之的是碳酸钙的3种同质多像体方解石、球霰石、文石的特征衍射峰。
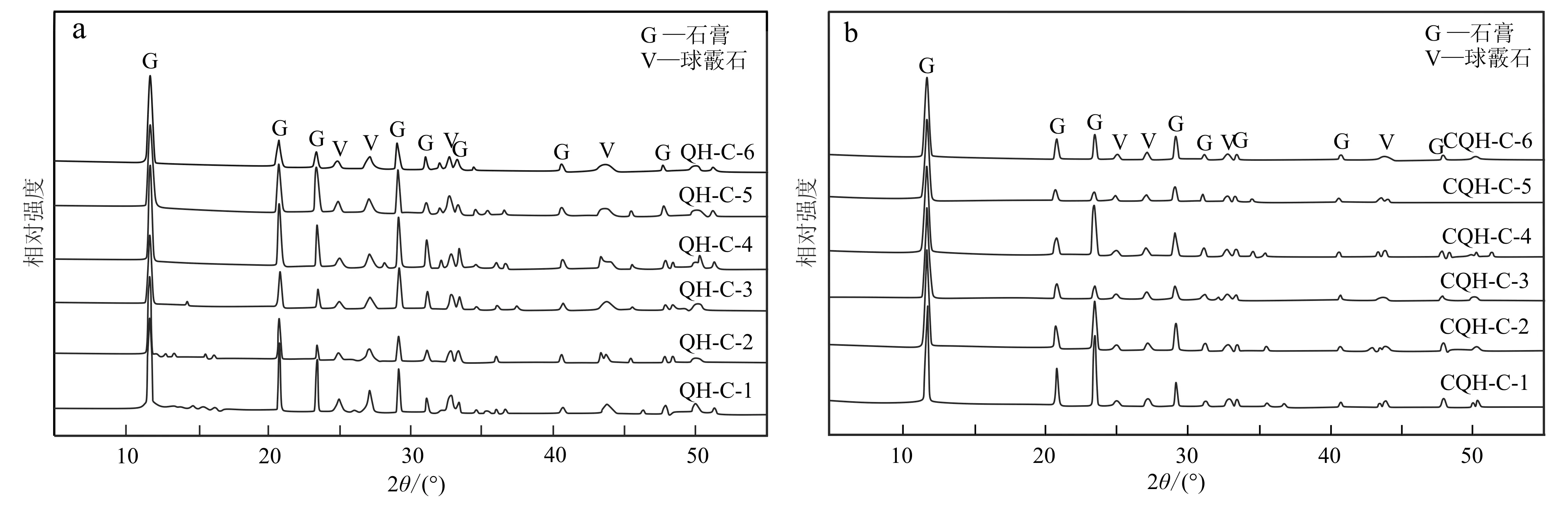
图 1 不同Ca2+浓度下两类青海湖水所得到的沉淀样品XRD图谱

表 3 两类青海湖水在不同Ca2+浓度下沉淀的矿物及相对含量
保持Ca2+浓度0.2 mol/L不变,将Mg2+浓度从0.22 mol/L逐渐增至1.62 mol/L,XRD图谱出现规律性变化(图2)。当Mg2+浓度为0.22 mol/L时(图2a中的QH-1、图2b中的CQH-1),出现方解石的特征衍射峰(2θ=29.04°),同时还有球霰石的特征衍射峰(2θ=24.92°,26.99°,32.78°,43.80°),方解石的特征衍射峰数量少、峰值低,球霰石的特征衍射峰数量多、峰值高,这说明此时沉淀物为球霰石和方解石的混合物,且以球霰石为主(表4)。Ca2+浓度不变,当Mg2+的浓度增至0.42 mol/L时(图2a中的QH-2、图2b中的CQH-2),球霰石的特征衍射峰值降低,方解石的特征衍射峰值增加,且在2θ=23.02°、39.38°位置上出现新的方解石特征峰,表明沉淀中球霰石的含量降低,方解石含量增加。Mg2+浓度增至0.62 mol/L时(图2a中的QH-3、图2b中的CQH-3),无论是正常青海湖水还是除菌的青海湖水,沉淀物中球霰石特征衍射峰完全消失,开始出现文石的特征峰,沉淀物为方解石和文石的混合物。随着Mg2+的浓度逐渐增加,方解石的特征衍射峰逐渐减弱,取而代之的是文石特征衍射峰值逐渐变强,说明方解石含量逐渐减少,文石含量逐渐增加。当Mg2+的浓度增加至1.22 mol/L时(图2a中的QH-6、图2b中的CQH-6),方解石特征衍射峰完全消失,此时沉淀全部为文石。此时,即使继续增加Mg2+(图2a中的QH-7和QH-8、图2b中的CQH-7和CQH-8),谱线也不再变化。
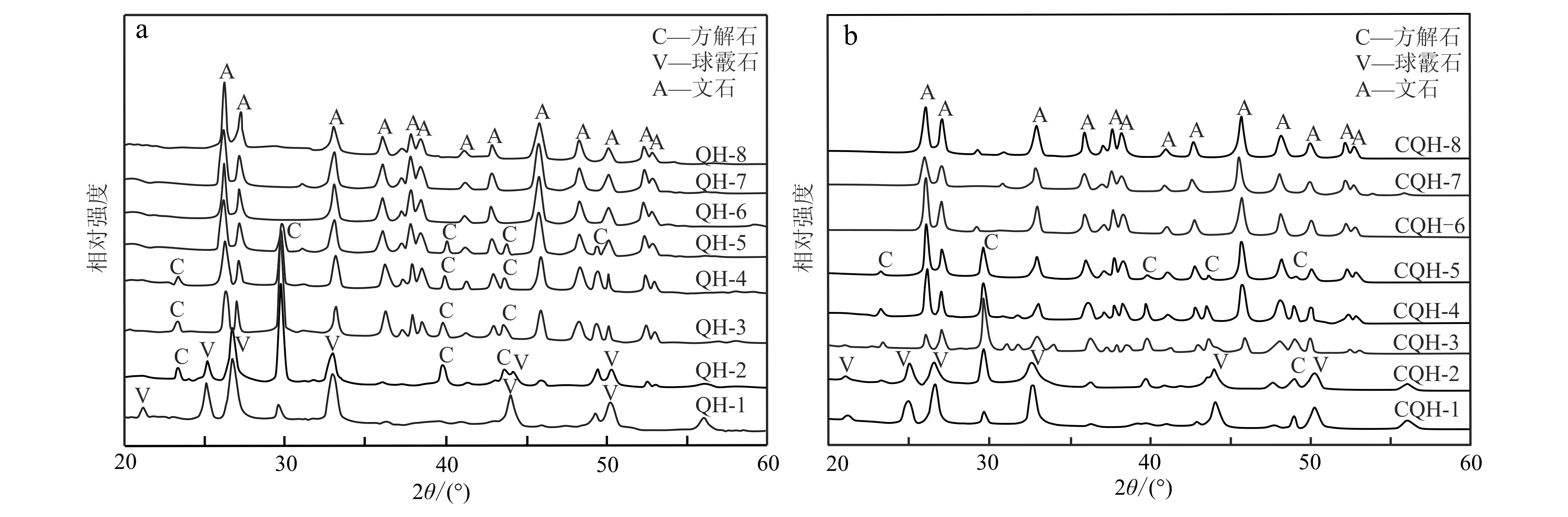
图 2 不同Mg2+浓度下两类青海湖水所得到的沉淀样品XRD图
采用Kontoyannis 和 Vagenas(2000)的方法,根据X射线衍射特征峰值结果对碳酸钙沉淀中方解石、球霰石、文石的相对含量进行了计算,结果见表4。实验和计算结果显示,正常湖水与除菌湖水的沉淀物在矿物组成及相对含量上基本一致,表明本次实验中微生物对沉淀反应的影响可以忽略,因此后续讨论不再赘述。
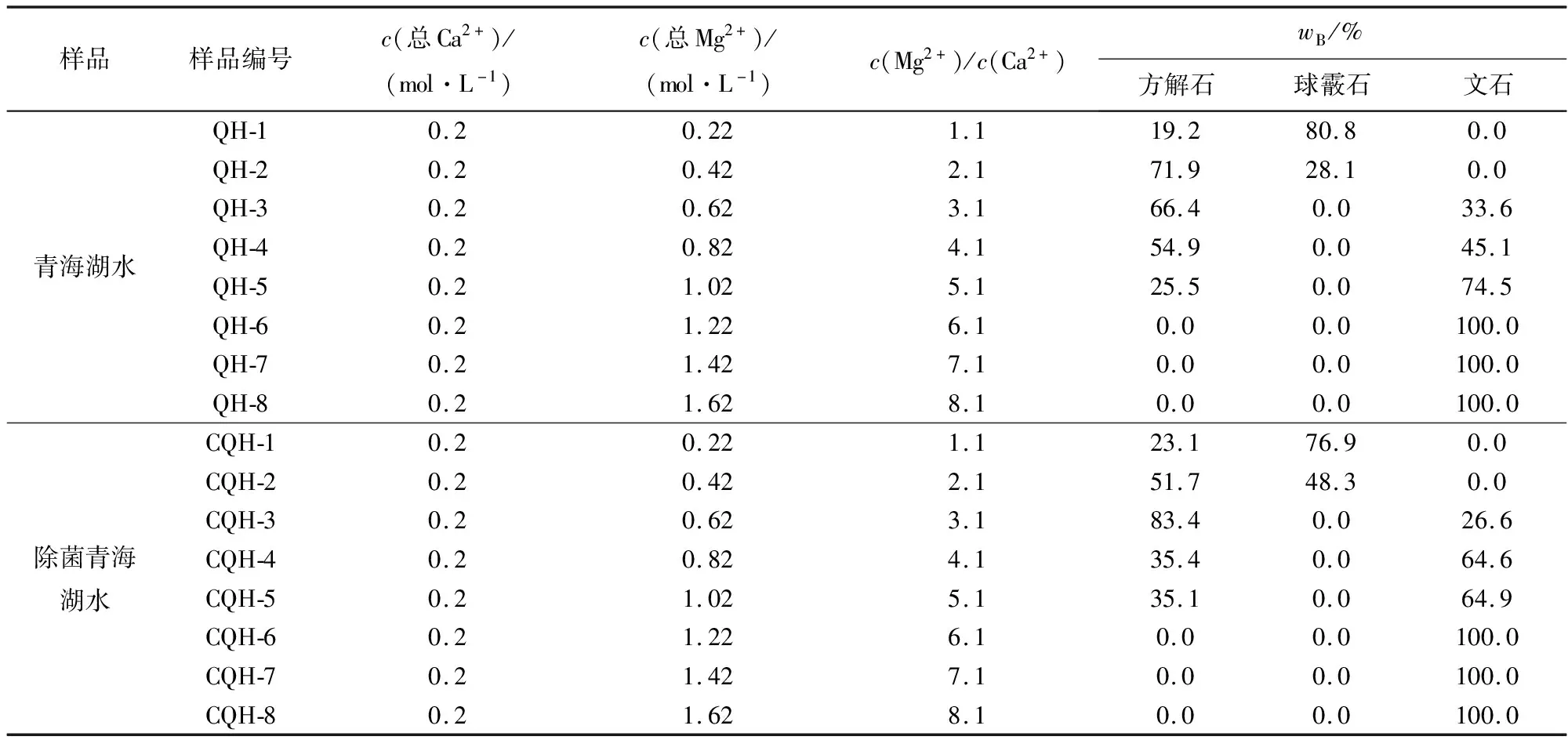
表 4 两类青海湖水在不同Mg2+浓度下沉淀的碳酸钙同质多像体类型及相对含量
2.3 沉淀物晶体形貌特征
图3展示了青海湖水中仅添加CaCl2所得到石膏和球霰石的扫描电镜(SEM)图像。由图3可以看出,沉淀物为石膏和球霰石的混合物,石膏晶体普遍呈菱板状、片状以及短柱状,粒径约为20~30 μm;球霰石则呈微球状,多以聚集体的形式出现,附着在石膏晶体上。SEM 图像显示,Ca2+浓度的变化对沉淀矿物形貌的影响较小。
图4展示了青海湖水中同时添加Ca2+和Mg2+时碳酸钙沉淀的形貌特征。当Mg2+浓度为0.22 mol/L时,石膏晶体消失,球霰石为微球集合体(图4a)。Mg2+浓度为0.42 mol/L时,球霰石仍为微球状,方解石为长10 ~ 15 μm的长板状、纤维状集合体以及少量菱板状单体(图4b)。Mg2+浓度增至0.62 mol/L时,小球状球霰石完全消失,沉淀中开始出现针状、短柱状文石,它们附着在薄板状碳酸钙上,文石晶体长6 ~ 10 μm(图4c)。当Mg2+浓度增至1.22 mol/L时,方解石彻底消失,文石为两头等粗的短柱状集合体(图4d)。当Mg2+的浓度为1.42 mol/L时,短柱状文石集合体的两头开始收缩,显现出中间粗、两头细的形态(图4e)。在Mg2+浓度增至1.62 mol/L时,柱状文石呈现出梭状集合体(图4f)。

图 3 青海湖水在不同Ca2+浓度下沉淀物的显微形貌
3 讨论
3.1 Mg2+与的相互作用对沉淀物类型的影响

图 4 青海湖水在不同Mg2+浓度下获得的CaCO3同质多像体的显微形貌
3.2 Mg2+浓度对碳酸钙同质多像的调控
从图4、表4中可以看出,在沉淀物全部转换成碳酸钙后,Mg2+浓度对碳酸钙同质多像类型和含量均产生了明显的影响。Mg2+浓度较低的情况下(镁离子浓度小于等于0.42 mol/L),沉淀物为球霰石和方解石的混合物,且随着Mg2+浓度增加,沉淀物中的球霰石迅速转换成方解石。球霰石作为碳酸钙3种无水结晶相中热力学最不稳定的相态,根据奥斯特瓦尔德阶梯法则,随着时间的推移,它会逐渐被热力学更稳定的相态(方解石、文石)所取代(De Yoreoetal., 2015)。本次实验中,Mg2+浓度低的青海湖水能够产生大量的球霰石(表4中的QH-1),这意味着在Mg2+浓度较低的情况下,球霰石向方解石转化的过程是比较缓慢的,在48 h后只形成了少部分的方解石。而Mg2+浓度增加后球霰石的相对含量迅速降低直至消失,表明溶液中的Mg2+可以加速转化的过程,使得反应结束后获得的沉淀是热力学更稳定的相态,即方解石和文石(镁离子浓度大于0.42 mol/L)。此外,Bots等(2011)的实验表明Mg2+参与到球霰石晶格中,会显著降低球霰石的晶胞参数,这种在结构上产生的变化也可能是球霰石在高Mg2+浓度下不能稳定存在的原因之一。
随着Mg2+浓度的继续增加,沉淀物中方解石和文石的相对含量也在发生着改变,方解石的含量逐渐降低,文石的相对含量逐渐增加,在镁离子浓度等于1.22 mol/L时,沉淀物仅为文石(表4)。前人研究表明,之所以方解石的含量会随着Mg2+浓度增加而减少,是因为溶液中Mg2+会对方解石的结晶生长产生抑制作用,这种抑制作用主要来源于以下3个方面:① 方解石在结晶的过程中,Mg2+会通过类质同像的方式替换方解石晶格中的部分Ca2+,这会增大方解石的溶解度,从而导致过饱和溶液更倾向于形成溶解度更低、生长速率更快的文石(Berner, 1975; De Choudens-Sanchez and Gonzalez, 2009);② 由于Ca2+(r=1.14 Å)和Mg2+(r=0.86 Å)在离子半径上的差异(Shannon, 1976),Mg2+添加到方解石晶格后产生的晶格应变会降低方解石在热力学上的稳定性(Kulik, 2006);③ 大量的实验工作证明Mg2+在方解石的生长动力学上有显著的阻碍作用(Wasylenkietal., 2005; Stephensonetal., 2008; Astillerosetal., 2010)。相对于Ca2+而言,Mg2+的半径更小,这会导致它有更高的电荷密度以及更大的水合能。当Mg2+吸附在矿物表面时,形成的含水壳(water shell)将会增加方解石成核和生长的动力学障碍(Losteetal., 2003; De Yoreoetal., 2009)。因此,Mg2+浓度越高,方解石的抑制作用越明显。而对于文石而言,由于文石在结晶过程中Mg2+无法参与到晶格之中,不会影响文石正常的结晶生长(Berner, 1975; Mucci and Morse, 1983),所以在高Mg2+浓度情况下,文石将会是碳酸钙唯一稳定存在的相态。
在显生宙时期,大洋曾数次出现“方解石海”与“文石海”之间的转变(Sandber, 1983)。研究认为导致海水这种转变的原因与海水中的镁离子含量的变化密切相关,当海水中的Mg/Ca值大于1(Wilkinson and Algeo, 1989)~2(Hardie,1996)时,海洋沉淀的碳酸钙主要是文石,反之则是方解石。本次实验的结果也在一定程度上证实了该观点,即镁离子含量的变化对方解石相和文石相的转变能起到至关重要的作用。不过,它们的区别在于,青海湖水中沉淀碳酸钙完全转化成文石所需的Mg/Ca值为6.1(镁离子浓度1.22 mol/L),该值远远大于古代海水转换成“文石海”的临界值;现代海水Mg/Ca≈5,处于“文石海”阶段(Wilkinson and Given, 1986; Hardie, 1996),这个值与本次实验结果相近。上述结果意味着在地质历史时期,“方解石海”向“文石海”转化时Mg/Ca值可能只是影响因素之一,也许还有其它因素影响着两者之间的转化。因此要了解“方解石海”向“文石海”转化的关键机制,还需要进一步的深入探索。
4 结论