尿苷二磷酸-葡萄糖醛酸转移酶基因UGT2B7和UGT2C1与赤拟谷盗磷化氢抗性关系研究
2021-05-26杜文蔚陈二虎王康旭唐培安
杜文蔚 陈二虎 王康旭 宋 伟 唐培安
(南京财经大学食品科学与工程学院;江苏省现代粮食流通与安全协同创新中心,南京 210023)
尿苷二磷酸-葡萄糖醛酸转移酶(UGTs,UDP-glucuronosyl transferas)是一类广泛分布于各种动植物、细菌和病毒的多功能超家族酶类,这一类酶能够将活化的核苷糖供体上的糖基转移到糖苷配基上,从而改变受体的性质,包括生物活性、溶解性、跨膜运输等特性[1,2]。活化的核苷糖主要有UDP-葡糖醛酸、UDP-葡萄糖、UDP-半乳糖、UDP-木糖等,而受体分子既可以为内源物,也可以是外源物,其中昆虫体内一般以UDP-葡萄糖为主要糖源[3]。Kaplanoglu等[4]通过转录组数据分析发现多条UGT基因在马铃薯甲虫(Leptinotarsadecemlineata)吡虫啉抗性品系中显著上调表达,通过RNAi技术沉默UGT2基因后,马铃薯甲虫对吡虫啉的敏感性显著提高,表明UGTs基因在马铃薯甲虫的吡虫啉抗性形成过程中发挥重要作用。李秀霞等[5]发现在小菜蛾(PlutellaXylostella)幼虫抗性种群中,UGT33AA4的表达量均显著高于敏感种群(30.7~77.4倍),RNA干扰抑制UGT33AA4表达后,抗性和敏感小菜蛾幼虫对氯虫苯甲酰胺的死亡率分别增加27.3%和29.8%,证明UGT33AA4的过表达与小菜蛾对氯虫苯甲酰胺的抗性相关。
赤拟谷盗Triboliumcastaneum是一种具有重要经济意义的世界性储藏物害虫,属鞘翅目(Coleptera),拟步甲科(Tenebrionidae),拟谷盗属(Tribolium)[6]。赤拟谷盗在世界范围内主要分布于热带与温带地区[7,8],在我国至少23个省(区)有分布[9]。此外,赤拟谷盗有臭腺分泌臭液,其分泌物含有致癌物,导致粮食品质下降,尤其对粮食中的粉类物质的危害最严重,所以当赤拟谷盗大量发生时,面粉会被严重污染形成块状,产生腥臭味,颜色改变,使其无法食用,造成极大的经济损失[10-12]。PH3熏蒸是目前防治储粮害虫的主要方式[13],然而由于长期对PH3单一药剂的过度依赖,导致赤拟谷盗对PH3产生了严重的抗性,对我国的储粮安全构成巨大威胁[14-17]。转录组学研究已经表明,赤拟谷盗不同PH3抗性种群基因表达量存在明显差异,其中包括2个尿苷二磷酸-葡萄糖醛酸转移酶基因—UGT2B7和UGT2C1基因,二者在赤拟谷盗PH3抗性种群中显著高表达[18],然而其在PH3抗性形成过程中的功能尚属未知。据此,本研究以赤拟谷盗为研究对象,分析UGT2B7和UGT2C1基因在赤拟谷盗不同抗性水平以及PH3熏蒸前后的表达模式;进而通过RNA干扰技术沉默靶标基因,分析赤拟谷盗PH3敏感性变化情况,从而揭示UGT2B7和UGT2C1基因与赤拟谷盗PH3抗性形成的关系。
1 材料与方法
1.1 实验材料
1.1.1 供试昆虫
赤拟谷盗的敏感和抗性种群分别于2016年采自云南西双版纳农户(YN)和广东省深圳某粮库(SZ)(抗性倍数分别为3.0、862.7倍[19]),并在南京财经大学粮食储运国家工程实验室培养至今。在实验室内以人工饲料(全麦粉∶酵母粉=19∶1),在恒温29~31 ℃、相对湿度为70%~80%、无光照的培养箱中饲养。
1.1.2 主要试剂
RNA easy、HiScript3®II 1st Strand cDNA Synthesis Kit试剂盒、ChamQTMSYBR®qpcr Master Mix(Low Rox Premixed)、T7 RNAi Transciption Kit TR102、50×TAE、Loading Buffer、MiniBEST DNA Fragement Purification Kit Ver.4.0、DNA Marker 500、DNA Marker 2000、溴化乙锭溶液(EB)。
1.2 实验方法
1.2.1 PH3熏蒸
采用FAO[20]推荐的PH3发生装置并加以改进,PH3气体由10%磷化锌的硫酸反应制备获得,发生装置见图1。
在生物测定的基础上,得到YN、SZ种群的毒力回归方程:Y=-10.565+7.465X、Y=-47.249+12.146X,选择PH3的亚致死浓度LC30进行药剂处理,其中YN的LC30为23.44 μg/L;SZ的LC30为6 895 μg/L。具体操作如下:将羽化后1周龄成虫放入熏蒸瓶(各种群分别选取50头),用高真空硅脂把熏蒸瓶与玻璃旋塞密封。使用相应量程的气密性注射器抽取PH3气体,依次注入熏蒸瓶,轻轻摇匀后置于培养箱中密闭熏蒸。实验共设置6个胁迫时间点,分别为0、1、2、6、12、20 h,以无药剂处理作为空白对照。各处理完成后,选取存活的试虫立即放入液氮冷冻备用,实验共设置3个生物学重复。

图1 PH3气体发生装置
1.2.2 RNA提取及cDNA合成
选取羽化后1周龄的赤拟谷盗成虫以及PH3处理不同时间后仍存活的赤拟谷盗成虫,置于液氮中冷冻保存备用。按照试剂说明书用RNA easy提取上述样本的总RNA,每个种群均设3个生物学重复。用核酸浓度测定仪测定RNA的浓度和纯度,并通过琼脂糖凝胶电泳观察条带情况,以便进行后续试验。以上述mRNA为模板,依据反转录试剂说明书合成cDNA模板,置于-20 ℃保存。
1.2.3 引物设计
根据GenBank提供的赤拟谷盗UGT2B7和UGT2C1基因序列(登录号分别LOC100141953、LOC660846)信息,用在线设计软件Primer-Blast设计定量PCR引物,选择RPS18(登录号:XM_968539)与RPL13(登录号:XM_969211)作为定量PCR的内参基因[21]。定量PCR引物和dsRNA引物均由南京金斯瑞生物科技有限公司合成,其他详细信息见表1。

表1 mRNA表达分析及dsRNA合成所用引物
1.2.4 实时荧光定量检测
采用ChamQTM SYBR®qPCR Master Mix (Low Rox Premixed)试剂盒,使用ABI 7500 PCR系统(Applied Biosystems,USA)进行qPCR,每个种群均设3个生物学重复和3个技术重复。qPCR程序为:95 ℃预变性5 min,95 ℃变性10 s,60 ℃ 30 s,40个循环;熔解曲线程序为:95 ℃ 15 s、60 ℃ 1 min、95 ℃ 15 s。
1.2.5 dsRNA 的合成与注射
赤拟谷盗UGT2B7、UGT2C1以及和绿色荧光蛋白(GFP)的dsRNA特异性引物序列见表1。使用梯度PCR仪进行PCR扩增,反应体系为:10 μL Tap PCR Master Mix,0.5 μL 上游/下游引物,1 μL cDNA,加去离子水至20 μL,PCR程序为:94 ℃预变性5 min;94 ℃ 1 min,58 ℃ 1 min,72 ℃ 2 min,40个循环;72 ℃延伸1 min。产物用MiniBEST DNA Fragement Purification Kit Ver.4.0按照说明进行回收,然后参照T7 RNAi Transciption Kit TR102试剂盒说明书体外合成dsRNA。
选取赤拟谷盗活力良好的五龄幼虫为试虫。使用微量注射器将200 ng dsRNA注射入幼虫体内,对照组注射相等剂量的dsGFP,每组均注射足量幼虫。注射后置于培养箱中饲养,48 h后分别收集生理状况良好的赤拟谷盗并冻存于液氮中备用。采用qPCR方法测定注射靶标基因的dsRNA后的沉默效果,反应条件参见1.2.4。
1.2.6 赤拟谷盗PH3敏感性测定
选用赤拟谷盗一周龄成虫进行RNAi,靶标基因沉默后采用熏蒸法检测试虫对PH3的敏感性,以LC30作为PH3处理浓度(YN:23.44 μg/L;SZ:6 895 μg/L)。处理不同时间后观察试虫死亡情况并统计死亡率,轻触虫体不动为死亡。以注射dsGFP作对照组,每组试验3个重复,每个重复50头试虫。
1.2.7 数据处理与分析
使用2-ΔΔCt方法分析目的基因的相对表达量,试验结果用平均数±标准方差表示,运用SPSS 17.0软件的单因素方差分析(One-Way ANOV)中的Turkey式多重比较法,对赤拟谷盗UGT2B7和UGT2C1基因的相对表达量以及死亡率进行显著性差异分析(P<0.05表示显著性差异,P>0.05表示无显著性差异)。
2 结果与分析
2.1 UGT2B7和UGT2C1基因在赤拟谷盗敏感和抗性种群中的表达模式
赤拟谷盗UGT2B7和UGT2C1基因在抗性(SZ)种群中的表达量均高于敏感(YN)种群,二者在极高抗种群SZ中的表达量分别是敏感种群YN的2.70和5.90倍,并具有显著性差异(P<0.05)。
2.2 PH3胁迫下赤拟谷盗UGT2B7和UGT2C1基因的表达模式
不同时间梯度下,PH3胁迫对赤拟谷盗UGT2B7基因表达量影响见图2,PH3处理后UGT2B7的表达量在敏感(YN)和抗性种群(SZ)均出现不同程度的上调,两者的变化规律相似,且均在2 h达到峰值。PH3胁迫处理2 h时间段内(即基因表达量达到峰值时),敏感种群基因表达量和抗性种群基因表达量分别是未处理组的2.47倍和1.76倍,并且均与其他胁迫时间点基因相对表达量形成显著差异(P<0.05)。

注:柱形图表示平均数±SD;不同字母之间表示显著性差异(P<0.05);以0 h为对照组。图2 赤拟谷盗UGT2B7在PH3胁迫后的表达量变化
PH3胁迫后赤拟谷盗UGT2C1基因表达量变化见图3,结果显示,各个时间点无药剂处理组基因表达量与0 h无显著性差异(P>0.05),敏感种群经PH3处理不同时间后,UGT2C1基因相对表达量较对照组平均下降了约5.37倍,具有显著差异(P<0.05);该基因在胁迫1 h后,其相对表达量无显著性差异(P>0.05)。抗性种群经PH3处理不同时间后,UGT2C1基因相对表达量呈现不断上升趋势;处理20 h时的表达量相比未处理组高达8.75倍,存在显著差异(P<0.05)。PH3胁迫后该基因在敏感和抗性种群中的表达模式不同。
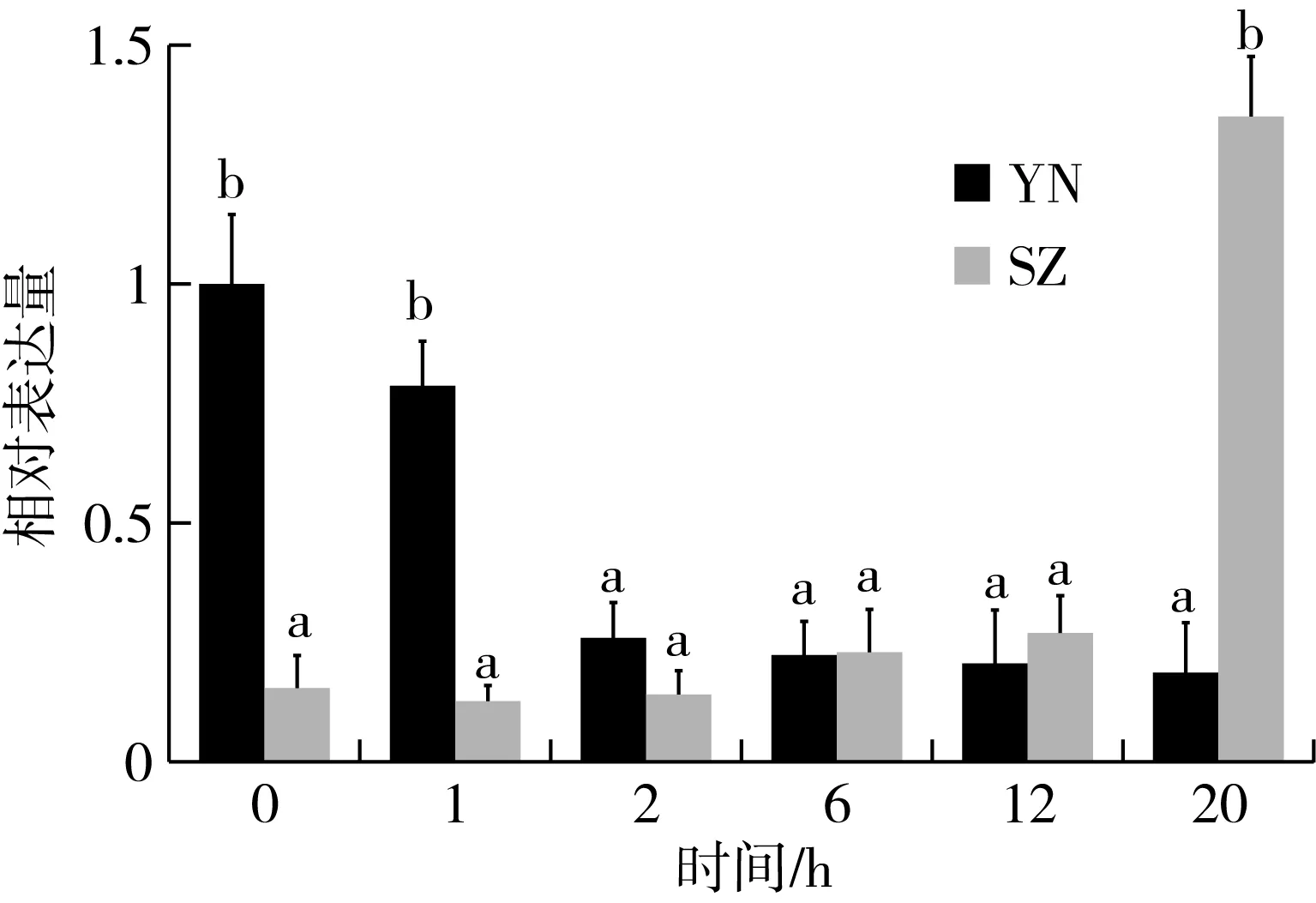
注:柱形图表示平均数±SD;不同字母之间表示显著性差异(P<0.05);以0 h为对照组。图3 赤拟谷盗UGT2C1在PH3胁迫后的表达量
2.3 UGT2B7和UGT2C1基因沉默对赤拟谷盗PH3敏感性的影响
为进一步解析赤拟谷盗UGT2B7和UGT2C1基因与PH3抗性形成的关系,利用RNA干扰技术分别沉默这两个基因,并检测其沉默效率,同时测定试虫PH3敏感性变化情况。结果显示,赤拟谷盗分别注射dsUGT2B7、dsUGT2C148 h后,与对照组相比,敏感种群和抗性种群的UGT2B7、UGT2C1mRNA表达水平显著降低,沉默效率分别是49.4%、41.1%和51.7%、47.6%。
分别沉默UGT2B7、UGT2C1基因后,以PH3处理敏感和抗性种群,分析赤拟谷盗对PH3的敏感性变化情况,结果表明,RNA干扰UGT2B7后,以PH3LC30处理敏感和抗性种群,赤拟谷盗死亡率分别增加27%、22%;RNA干扰UGT2C1后,以PH3LC30处理敏感和抗性种群,赤拟谷盗死亡率分别增加38%、31%。注射dsGFP后,试虫死亡率无显著性变化(P>0.05)(图4)。

注:柱形图表示平均数±SD;柱上的字母表示显著性差异(P<0.05);以dsGFP为对照组。图4 不同抗性种群赤拟谷盗UGT2B7、UGT2C1基因干扰后对PH3的敏感性检测
3 讨论
与一般化学农药抗性机理类似,PH3除通过呼吸作用进入虫体外,亦可通过扩散作用穿透表皮直接进入虫体[22]。Chaudhry等[23]利用放射性同位素(32PH3)标记的方法,通过提高昆虫抗性品系的熏蒸浓度,使两个品系达到相同的PH3摄入量,结果发现,抗性品系的死亡率显著低于敏感品系,说明昆虫的解毒作用也参与了PH3抗性的形成。UGTs 是一种广泛存在于动物、植物和微生物中的重要生物转化酶,可以催化活化糖供体中的糖基加到受体分子的糖苷配基上,产生可被有效排泄的水溶性物质,从而使毒物得到解毒和消除。本研究通过对UGT2B7和UGT2C1基因在不同PH3抗性种群赤拟谷盗中的定量分析,发现UGT2B7和UGT2C1基因在PH3抗性种群中表达量均呈上调趋势,抗性种群表达量显著高于敏感种群,暗示其与PH3抗性形成密切相关。Li等[24]发现,9个UGT基因在多抗小菜蛾品系中过量表达,且其中的UGT40V1、UGT45B1和UGT33AA4可以被5~7种杀虫剂诱导表达。UGT40V1、UGT45B1、UGT33AA4和UGT2B7和UGT2C1属于同一个基因家族,其功能可能相似,可能介导了昆虫的抗药性上调。为了进一步验证这两条基因是否介导赤拟谷盗PH3抗药性的形成,本研究对PH3敏感与抗性种群赤拟谷盗UGT2B7和UGT2C1基因在PH3胁迫前、后的表达量进行分析,结果表明,UGT2B7基因在敏感和抗性种群中均出现先升后降的应激反应,且均在2 h相对表达量达到峰值,相比未胁迫组显著上调,但是长时间胁迫后表达量下降,可能是昆虫产生了适应性调节,从而维持体内蛋白水平稳定。而UGT2C1基因的表达量,在敏感种群试虫中持续下调,抗性种群持续上调。在敏感种群中的持续下调这一趋势与实验前的预测略有差异,对于这一问题会在后续实验中对其做出进一步检测与分析;在抗性种群中表达量显著上调,胁迫20 h后该基因的表达量是对照组的8.75倍。据此推测,抗性种群赤拟谷盗在受到PH3胁迫后可能产生了应激反应等适应性变化,导致UGT2C1表达量在胁迫一定时间后迅速上升,以应对外界的药剂压力使赤拟谷盗对PH3的敏感性迅速增强,同时也验证了在赤拟谷盗抗性种群中UGT2C1表达量呈上调趋势这一结果。有报道表明茚虫威处理后甜菜夜蛾(SpodopteraExigua)6个UGT基因表达水平显著上调[25],硫丹处理后的斜纹夜蛾(SpodopteraLitura)UGT酶活性于24 h后显著升高[26]。Lee等[27]发现抗吡唑硫磷果蝇代谢速率明显高于敏感品系,并且通过荧光同位素14C标记法得出UGT只存在于微粒体酶液中,同时在抗性品系中UGT酶活性明显高于敏感品系。Kojima等[28]利用高通量转录组测序发现,除虫菊酯可诱导UGT表达量显著上升,同时经吡虫啉、啶虫脒和除虫脲筛选或者处理后,其体内的UGT的表达量明显提高,表明UGT与昆虫对杀虫剂的解毒代谢关系密切。综上所述,根据定量结果,我们认为UGT2B7和UGT2C1基因在赤拟谷盗PH3抗性产生中扮演了重要角色,同时发现,赤拟谷盗抗性种群在PH3胁迫时的表达模式也与相关研究结果相似。
为了进一步明确赤拟谷盗PH3抗性产生机理,采用RNA干扰实验,验证UGT2B7和UGT2C1基因在PH3抗性产生中所发挥的作用及功能。目前对于UGT家族基因的功能研究最早是在烟芽夜蛾(HeliothisVirescens)中开展,发现UGTs能增强其对有机磷杀虫剂甲基对硫磷的抗性[29]。王梦瑶[30]采用“叶碟吸收饲喂法 ”对朱砂叶螨(Tetranychuscinnabarinus)UGT201D3基因进行RNA干扰,研究表明AbR品系在处理后对阿维菌素的的敏感性上升。Li等[31]利用RNA干扰对UGT2B17表达进行沉默,研究其与小菜蛾对氯虫苯甲酰胺抗性的关系,结果表明,UGT2B17参与了氯虫苯甲酰胺的解毒作用,该基因的过表达在小菜蛾的抗氯虫苯甲酰胺中起着重要的作用。本研究对赤拟谷盗老熟幼虫进行RNA干扰,使UGT2B7和UGT2C1分别沉默,从而研究其与PH3抗性的关系,PH3敏感性实验结果表明,UGT2B7和UGT2C1基因沉默后,敏感和抗性种群的赤拟谷盗死亡率都显著增加,该结果证实UGT2B7和UGT2C1基因在赤拟谷盗PH3抗性形成过程中发挥作用,可能参与了赤拟谷盗对PH3的解毒代谢。
4 结论
UGT2B7和UGT2C1基因在抗性种群中的表达量均显著高于敏感种群(P<0.05)。敏感和抗性种群赤拟谷盗的UGT2B7和UGT2C1基因的表达量均随着PH3熏蒸时间的变化而变化,表明这两个基因可能在赤拟谷盗对PH3产生抗性的过程中起着重要的作用。UGT2B7、UGT2C1基因沉默后,赤拟谷盗对PH3的敏感性显著提高,进一步表明UGT2B7、UGT2C1基因可能参与赤拟谷盗对PH3的抗药性的形成。
