薄荷提取物对提高秀丽线虫应激抵抗能力的影响
2021-05-26马俊锋付学奇
周 琳, 马俊锋, 付学奇
(1. 首都师范大学 生命科学学院, 北京100048; 2. 吉林大学 生命科学学院, 长春130012)
薄荷分布广泛[1-5], 含有羟基肉桂酸和类黄酮等酚类化合物[6-7]. 薄荷可治疗呼吸系统疾病、 胃肠道疾病、 高血压、 糖尿病、 继发性闭经和炎症等[8-9]. 薄荷富含挥发油, 具有解痉、 减充血、 抗氧化和抗菌活性等作用[10-11]. 此外, 薄荷作为调味剂广泛应用于热茶和草药饮料中[12]. 活性氧(ROS)是有氧代谢的产物, 有一定毒性, 可产生病理作用. 在免疫应答和细胞信号转导中, ROS与核酸、 蛋白质和脂质等许多生物分子发生相互作用. 如果人体的ROS失衡, 可导致衰老、 发炎、 癌症等[13-15]. 由于ROS在细胞中有双重作用, 因此机体中抗氧化防御系统的存在至关重要. 该防御系统由超氧化物歧化酶(SOD)等抗氧化酶[16]、 内源性肽及食物来源的营养化合物等组成[17]. 随着年龄增长, 与抗氧化防御相关的体内机制逐渐受到损害, 因此人体可能积累一定的ROS, 导致衰老及与年龄有关的疾病发生[18].
秀丽线虫(Caenorhabditiselegans, 线虫)是一种用于抗逆性和抗衰老研究的优秀模型生物[19-20]. 线虫具有生命周期短、 易操作、 通体透明易观察、 细胞谱系完全确定等优点. 在基因组水平上, 线虫与人的同源性约为80%[21-22]. 目前, 研究人员已将线虫模型应用于药理学研究, 并发现了许多药物化合物与基因相互作用的关系[23]. 本文应用线虫模型分析薄荷提取物对其应激抵抗性的影响, 为人类疾病的治疗和预防提供理论依据.
1 材料和方法
1.1 化学试剂
胡桃醌、 DCFH-DA和迷迭香酸(C18H16O8, 质量分数>98%, HPLC级)购自上海源叶生物科技有限公司; 叠氮化钠购自北京化工厂. SOD活性检测试剂盒购自北京索莱宝生物科技有限公司; RNA提取试剂盒购自生工生物工程(上海)股份有限公司; 逆转录和qPCR试剂盒购自北京全式金生物有限公司.
1.2 薄荷提取物
薄荷购自吉林大药房, 用沸水提取获得水溶液. 将5 g薄荷研磨, 过14目筛, 然后加入50 mL去离子水, 煮沸20 min. 收集滤液, 再加入50 mL去离子水, 继续煮沸20 min. 上述步骤重复3次, 合并滤液, 蒸发或添加去离子水至50 mL, 残余的薄荷质量为3 g. 因此, 提取物的质量浓度为40 g/L. 用0.22 μm滤膜过滤, -80 ℃保存. 将迷迭香酸溶解于去离子水中, 制成500 μmol/L的储备溶液, 然后将其添加到线虫生长培养基(NGM)和Ecoil.OP50中至终浓度为200 μmol/L.
1.3 线虫株和培养基
线虫株均来自秀丽线虫遗传学中心(CGC): N2(野生型), CF1588 (daf-16(mu86) Ⅰ;daf-2(e1370) Ⅲ; muⅠs84), CF1038 (daf-16(mu86)Ⅰ), TJ356 (zⅠs356 [daf-16p∷daf-16a/b∷GFP+rol-6]), CF1553 (muⅠs84 [(pAD76)sod-3p∷GFP+rol-6]). 将线虫置于含有NGM(质量分数为1.7%的琼脂, 2.5 μg/mL蛋白胨, 50 mmol/L NaCl, 25 mmol/L K2HPO4, pH=6.0, 1 mmol/L MgSO4, 1 mmol/L CaCl2和5 μg/mL胆固醇)的培养皿中培养, 环境温度为20 ℃, 以Ecoil.OP50为食喂养. 薄荷培养基为在NGM中加入薄荷提取物至相应浓度, 在涂布时将薄荷提取物加入Ecoil.OP50中至相应浓度后进行涂布.
1.4 应激抵抗实验
将同期化后的线虫置于20 ℃ NGM/OP50上培养, 96 h后将其转移至薄荷培养基内继续培养, 48 h后用M9缓冲液(1 mmol/L MgSO4, 42 mmol/L Na2HPO4, 22 mmol/L KH2PO4, 85 mmol/L NaCl)收集线虫, 反复冲洗3次, 洗去线虫体表粘附的Ecoil.OP50, 然后将线虫转移至无Ecoil.OP50的NGM中. 分别给予线虫不同条件的外界刺激(紫外辐射、 绿脓杆菌感染、 35 ℃热应激)后, 将线虫转移回NGM/OP50并在20 ℃下培养; 胡桃醌氧化应激实验需将胡桃醌加入线虫液体培养基(0.01 mmol/L胆固醇, 100 mmol/L NaCl, 50 mmol/L K2HPO4, pH=6.0)中, 所有实验均至少重复3次.
1) 紫外辐射实验. 将线虫置于2个254 nm, 1 000 J/m2, 15 W紫外灯下8 min 20 s. 紫外照射后, 将线虫放回NGM/OP50中, 20 ℃培养, 每12 h观察一次存活情况, 每组n>60.
2) 绿脓杆菌感染实验. 当线虫培养144 h时, 将其转移到涂有绿脓杆菌PA14菌株的NGM/OP50上, 20 ℃培养, 每天观察一次存活情况. 绿脓杆菌培养基制备方法为将20 μL对数生长期绿脓杆菌菌液涂布在NGM/OP50上, 在20 ℃下干燥过夜后使用, 每组n>60.
3) 35 ℃热应激实验. 当线虫培养144 h时, 将其转移至35 ℃环境下培养, 每1 h观察一次存活情况, 每组n>70.
4) 胡桃醌氧化实验. 参照文献[24]方法, 当线虫培养144 h时转入96孔板, 每孔均包含200 μL液体培养基, 实验组加入胡桃醌至终浓度为200 μmol/L, 每孔放置1条线虫, 每1 h观察一次存活情况, 每组n>80.
1.5 ROS水平测定
当线虫孵化至第96 h, 将其随机分为5组. 第1,2组线虫继续在NGM/OP50培养基上培养, 第3,4,5组转移至不同浓度薄荷培养基上培养. 144 h后给予线虫紫外辐射刺激, 用200 μmol/L DCFH-DA收集线虫, 于20 ℃浸泡30 min后, 将其转移至含200 μL M9缓冲液黑色96孔板中, 每孔20条线虫. 用Infinite F200 Pro型酶标仪(瑞士Tecan公司产品; 激发波长485 nm, 发射波长535 nm)测量吸光度. ROS水平表征为相对第2组的平均吸光度, 将其相对荧光单位(RFU)的平均值设置为1以反映相对ROS水平, 实验至少重复3次.
1.6 SOD活性测定
紫外辐射后, 用500 μL M9缓冲液收集线虫, 每组500条. 然后用超声细胞破碎仪进行破碎, 并用SOD活性检测试剂盒测量SOD活性, 实验至少重复3次.
1.7 突变体线虫紫外辐射抵抗实验
用突变体线虫CF1588和CF1038进行紫外辐射抵抗实验[25], 实验方法与1.4相同.
1.8 DAF-16∷GFP细胞定位和SOD-3∷GFP表达量测定
用转基因线虫TJ356和CF1553进行实验, 紫外辐射后, 立即用100 mmol/L叠氮化钠将线虫固定在载玻片上. 用Olympus IX73型荧光显微镜(日本Olympus公司)观察DAF-16∷GFP细胞内定位情况和SOD-3∷GFP表达量.
1.9 实时定量PCR(qRT-PCR)
紫外辐射后, 用500 μL M9缓冲液收集线虫并反复冲洗3次, 每组300条. 用试剂盒(上海生工生物工程股份有限公司)提取总RNA, 并逆转录为cDNA(北京全式金生物有限公司), 用SYBR Green(北京全式金生物有限公司)和ABI 7500 qPCR仪(美国Applied Biosystems公司)进行qRT-PCR分析. 用ΔΔCt方法计算相对倍数变化, 以act-1基因为内参, 实验至少重复3次. qPCR引物如下:
daf-16,5′-TTTCCGTCCCCGAACTCAA-3′和5′-ATTCGCCAACCCATGATGG-3′;
sod-3,5′-AGCATCATGCCACCTACGTGA-3′和5′-CACCACCATTGAATTTCAGCG-3′;
hsp-12.6,5′-TGGCCACTTCAAAAGGGAG-3′和5′-CTCTTTTGGGAGGAAGTTATGG-3′;
hsp-16.1,5′-CCACTATTTCCGTCCAGCTC-3′和5′-TGGAGAGCCTCTGCAAACTG-3′;
hsp-16.49,5′-GTCAAATCTGCAATTTCGAATG-3′和5′-CAAAATTAATGGGAATAGAACGAG-3′.
1.10 运动状态检测
将线虫在20 ℃ NGM/OP50上培养72 h后, 转移至不同浓度薄荷培养基中, 每组100条. 在成虫的第10,12,14,16天观察线虫的运动状态. 将不经外界刺激即可自主运动的线虫归为A类, 经外界刺激后才能自主运动的线虫归为B类, 经外界刺激后也不能自主运动的线虫归为C类, 死亡线虫归为D类[26-27].
1.11 吞咽频率检测
将线虫在20 ℃ NGM/OP50上培养72 h后, 转移至不同浓度薄荷培养基中, 每组10条. 在成虫的第10,12,14,16天观察记录线虫1 min的吞咽次数[28].
1.12 寿命检测
将线虫在20 ℃ NGM/OP50上培养72 h后, 转移至不同浓度薄荷培养基中, 每组90条. 每天观察并记录线虫存活情况. 阴道破裂、 丢失、 贴壁的线虫不计入统计, 实验至少重复3次.
1.13 育雏数检测
将线虫在20 ℃ NGM/OP50上培养L4期后, 转移至不同浓度薄荷培养基中, 每组10条, 每个培养皿内1条. 每隔24 h将线虫转移至新培养基内, 直到停止产卵. 计算每条线虫的产卵孵化总数, 每组取平均值[29].
1.14 统计分析
用Prism 5软件(美国GraphPad Software公司)中的Kaplan-Meier生存测定法绘制生存曲线, 并通过log-rank (Mantel-cox) test进行数据分析. 其他数据用ANOVA进行统计分析, 结果表示为平均值±标准误差(SEM).p<0.05为有统计学意义, 无显著性差异的组标记为N(0.05≤p标记为N, 0.01≤p<0.05标记为*, 0.001≤p<0.01标记为**,p<0.001标记为***).
2 结果与讨论
2.1 薄荷提取物对线虫应激抵抗能力的影响
在紫外辐射抵抗实验中, 薄荷提取物处理后的线虫经紫外辐照后平均寿命超过80 h, 对照组的寿命约为56 h. 实验组线虫的半数存活时间(96 h)是对照组(48 h)的两倍. 与对照组相比, 用2.5,5,10 g/L薄荷提取物处理后的线虫平均存活时间分别增加了48%,45%,49%, 如图1(A)所示. 在绿脓杆菌抵抗实验中, 对照组线虫平均存活时间为(6.81±3.23)d, 用2.5,5,10 g/L薄荷提取物处理的线虫平均存活时间均延长, 分别为(8.11±2.91),(8.55±3.14),(8.97±2.58)d, 如图1(B)所示. 在35 ℃热应激抵抗实验中, 用10 g/L薄荷提取物处理的线虫平均存活时间为(6.19±1.80)h, 对照组线虫平均存活时间为(5.15±2.16)h, 与对照组相比出现显著差异, 如图1(C)所示. 在胡桃醌氧化实验中, 对照组线虫平均存活时间为(9.09±3.53)h(最长15 h), 用2.5,5,10 g/L薄荷提取物处理的线虫平均存活时间为(9.52±3.38)h(最长15 h), (9.17±4.09)h(最长16 h)和(10.36±3.48)h(最长15 h). 与对照组相比, 10 g/L薄荷提取物处理组线虫平均存活时间显著增加, 如图1(D)所示.
根据上述实验结果, 薄荷提取物使线虫对紫外辐射的抵抗性增强最明显. 因此, 本文以紫外辐射为应激源, 进一步分析薄荷提取物提高线虫紫外辐射应激抵抗能力的作用机制. 由于薄荷中水溶性成分主要为多酚类物质, 因此选择抗氧化剂活性成分迷迭香酸作为阳性对照[30]. 实验结果表明, 与对照组相比, 用200 μmol/L迷迭香酸处理的线虫具有抗紫外辐射的能力, 如图1(E)所示, 因此推测薄荷提取物中含有一些与迷迭香酸结构相似的多酚类物质在发挥作用.
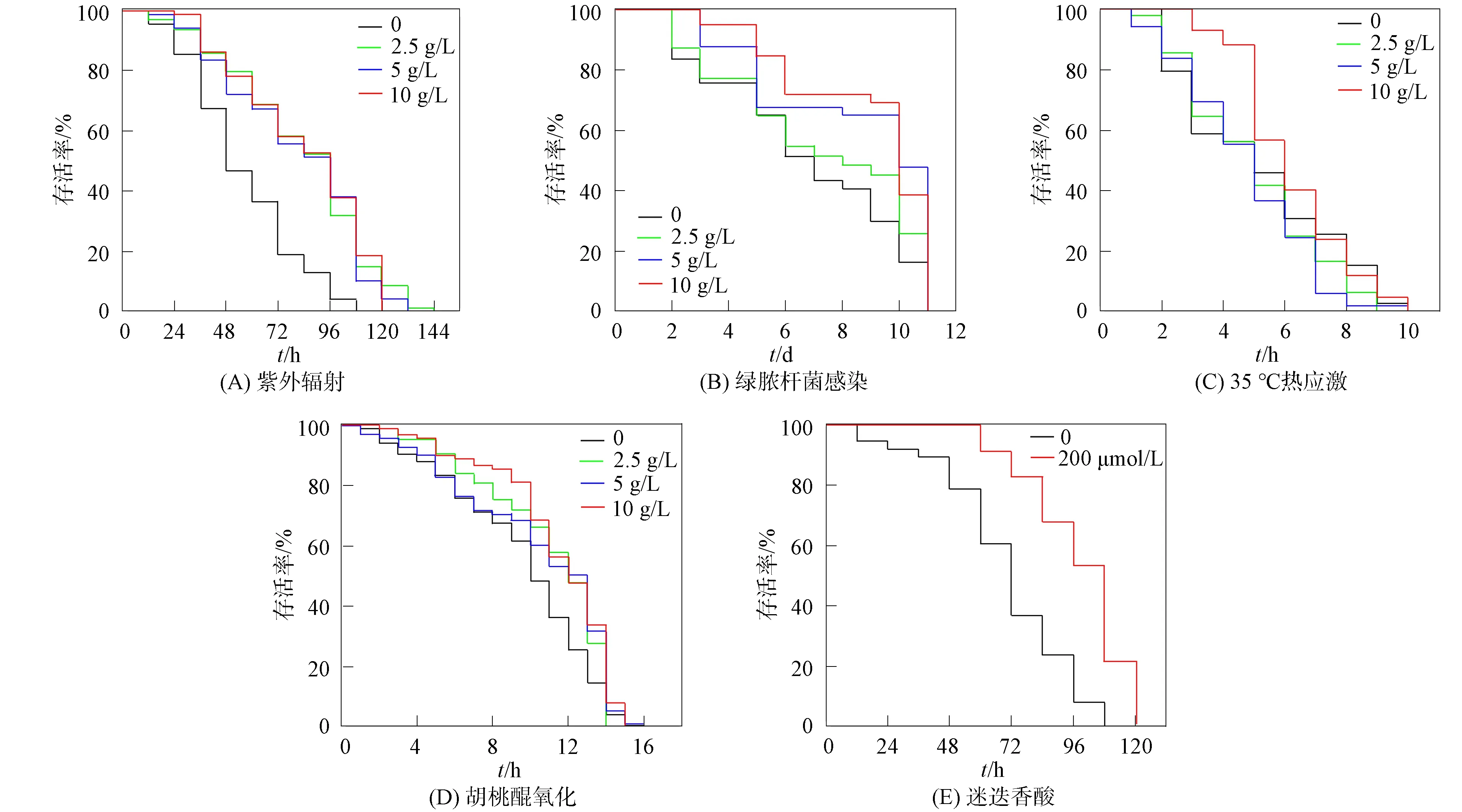
图1 薄荷提取物对线虫应激抵抗能力的影响
2.2 薄荷提取物对紫外辐射后线虫体内ROS水平和SOD活性的影响
为分析薄荷提取物提高线虫抗紫外辐射能力的原因, 本文首先检测了紫外辐射后线虫体内ROS含量和SOD活性. 当生物体受紫外辐射时, 过量ROS会打破机体稳态, 导致细胞内氧化应激反应, 进而加速细胞凋亡[31]. SOD是生物体中抗氧化酶系的重要组成部分, 可保护机体免受ROS侵害[32-33]. 图2为薄荷提取物对紫外辐射后线虫体内ROS水平和SOD活性的影响.

a. 0; b. 0+UV; C.2.5 g/L+UV; d. 5 g/L+UV; e. 10 g/L+UV.
由图2(A)可见, 与对照组相比, 实验组荧光强度明显降低, 用2.5,5,10 g/L的薄荷提取物处理线虫的ROS水平显著降低, 分别降至对照组的94.1%,86.7%,79.5%, 表明薄荷提取物有效减少了紫外辐射后线虫体内ROS的累积. 由图2(B)可见, 经紫外辐射后, 对照组线虫SOD活性为(3.668±0.392)RFU/mg, 用2.5,5,10 g/L薄荷提取物处理后, 线虫的SOD活性分别为(4.737±0.361),(5.302±0.279),6.299 RFU/mg. 在第1组中, 线虫仅在NGM/OP50上生长且不经紫外照射, 测得其SOD活性为(0.761±0.447)RFU/mg, 用于对照检查实验环境. 实验结果表明, 与对照组相比, 薄荷提取物可提高紫外辐射后线虫体内SOD活性.
2.3 薄荷提取物抗紫外辐射功能与胰岛素/IGF-1样信号通路的关系
由于daf-2和daf-16是胰岛素/IGF-1样信号通路中的关键基因, 因此以双突变体线虫CF1588和单突变体线虫CF1038为研究对象, 研究薄荷抗紫外辐射的作用机制, 结果如图3所示. 由图3可见, 与对照组相比, 薄荷提取物未提高这两种突变体的紫外辐射抵抗性. 因此, 薄荷提取物增强线虫紫外辐射抵抗性的作用可能与胰岛素/IGF-1样信号通路有关.

图3 薄荷提取物对突变体线虫抗紫外辐射能力的影响
2.4 薄荷提取物对紫外辐射后DAF-16细胞核定位和SOD-3表达的影响
以转基因线虫TJ356为研究对象, 研究薄荷提取物对线虫体内DAF-16细胞核定位的影响, 结果如图4所示. 将DAF-16∷GFP在细胞核内的位置分为3种: 细胞核、 细胞质和二者之间[34]. 由图4可见, 经紫外辐射后, 对照组线虫DAF-16主要定位于细胞质内, 实验组线虫体内DAF-16细胞核定位及细胞质核间的定位数量明显增多. 因此, 薄荷提取物可能是通过促进DAF-16向细胞核内转移增强其紫外辐射抵抗性.

图4 薄荷提取物对紫外辐射后线虫体内DAF-16向细胞核定位的促进作用
以转基因线虫CF1553为研究对象, 研究薄荷提取物对线虫体内SOD-3表达量的影响, 结果如图5所示. 由图5可见, 经紫外辐射后, 与对照组相比, 实验组线虫体内SOD-3表达量明显增多. 因此, 薄荷提取物可能是通过提供SOD-3的表达量增强其紫外辐射抵抗性. 图4和图5的数据统计结果分别如图6和图7所示.

图5 薄荷提取物对紫外辐射后线虫体内SOD-3表达量的影响
2.5 薄荷提取物对增加daf-16下游基因 mRNA水平表达量的影响
研究表明DAF-16可激活许多下游靶基因的表达, 包括sod-3,hsp-12.6,hsp-16.1和hsp-16.49等[35-37]. 为进一步探究薄荷提取物增强线虫紫外辐射抵抗性的作用机制, 本文检测了daf-16及其下游部分靶基因sod-3,hsp-12.6,hsp-16.1和hsp-16.49 mRNA水平表达量. 与对照组相比, 用10 g/L薄荷提取物处理线虫的sod-3,hsp-12.6,-hsp-16.1和hsp-16.49 mRNA水平表达量明显上升, 但daf-16的表达量无明显差异, 如图8所示. 表明薄荷提取物至少部分通过胰岛素/IGF-1样信号通路调控DAF-16的细胞内定位及其靶基因的表达量, 进而影响线虫的紫外辐射抵抗能力.

a. 0; b. 0+UV; c. 2.5 g/L+UV; d. 5 g/L+UV; e. 10 g/L+UV.

a. 0; b. 0+UV; c. 2.5 g/L+UV; d. 5 g/L+UV; e. 10 g/L+UV.

图8 薄荷提取物对紫外辐射后线虫体内应激相关基因表达量的影响
2.6 薄荷提取物对线虫运动能力和吞咽频率的影响
薄荷提取物对线虫运动能力的影响如图9所示. 由图9可见, 与对照组相比, 实验组线虫自主运动能力明显增强, 且呈剂量依赖性. 在第10天, 大多数线虫均能自主运动, 但实验组线虫运动更活跃. 在第12天, 实验组线虫明显具有较高的运动能力, A类和B类线虫的比例较高, 对照组线虫大多数为C类. 在第14天, 剂量依赖性对运动的影响更明显, 对照组线虫有79.4%为B类、 20.6%为C类, 实验组线虫大多数为A类或B类. 在第16天, 90.9%的对照组线虫为C类, 而50%以上的实验组线虫仍为A类.

图9 薄荷提取物对线虫运动能力的影响
薄荷提取物对成年线虫吞咽频率的影响如图10所示. 由图10可见, 与对照组相比, 实验组线虫吞咽频率明显增加. 在第10,12,14天, 实验组略高于对照组线虫的吞咽频率. 在第16天, 2.5,5,10 g/L薄荷提取物处理组分别高于对照组线虫吞咽频率64%,88%,109%, 有明显差异. 这些数据表明, 薄荷提取物可明显提高成年线虫的吞咽频率.

图10 薄荷提取物对线虫吞咽能力的影响
2.7 薄荷提取物对实验条件下线虫寿命和育雏数的影响
薄荷提取物对实验条件下线虫寿命和育雏数的影响如图11所示. 由图11(A)可见, 对照组线虫的平均寿命为(17.30±2.05)d (最长21 d). 用2.5,5,10 g/L薄荷提取物处理线虫的平均寿命分别为(17.13±3.07)d(最长21 d)、 (17.29±3.05)d(最长22 d)和(16.65±2.08)d(最长21 d). 因此, 薄荷提取物对线虫寿命无明显影响. 由图11(B)可见, 与对照组相比, 实验组线虫育雏数无明显变化, 表明薄荷提取物不损害其生育能力.
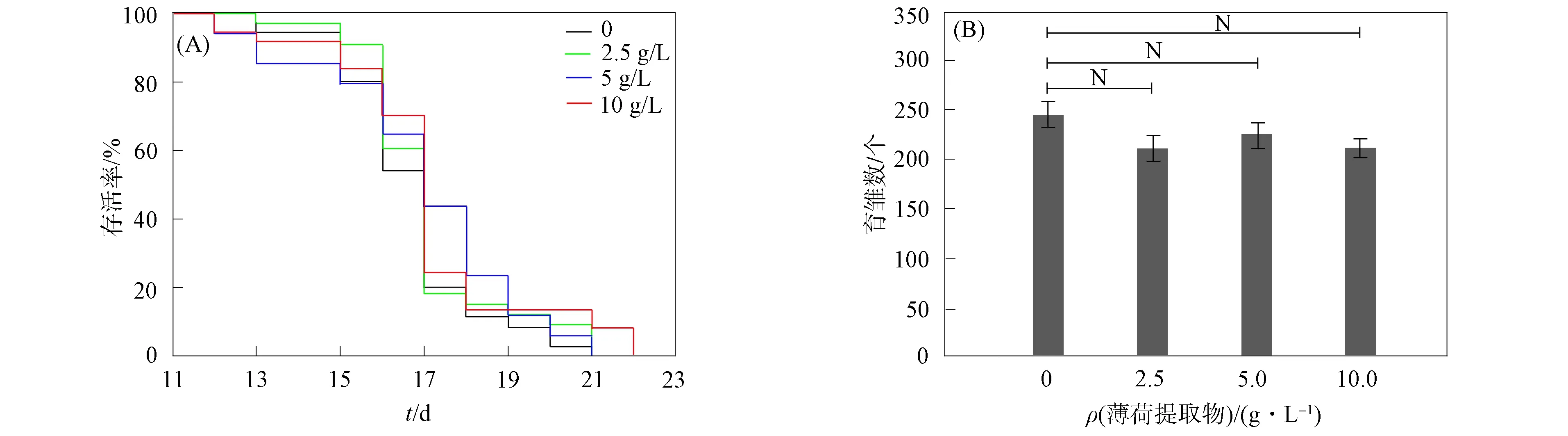
图11 实验条件下薄荷提取物对线虫寿命(A)和育雏数(B)的影响
综上所述, 本文研究了薄荷提取物对线虫抵抗多种应激能力的影响, 并以紫外辐射为应激源, 研究了薄荷提取物增强线虫紫外辐射抵抗性的作用机制. 实验结果表明: 薄荷提取物可减少线虫体内ROS积累并增强SOD活性; 薄荷提取物提高线虫紫外辐射抵抗能力与胰岛素/IGF-1样信号通路有关; 薄荷提取物增加了紫外辐射后DAF-16的细胞核定位和SOD-3表达量, 并增加了daf-16下游部分基因sod-3,hsp-12.6,hsp-16.1和hsp-16.49的mRNA水平表达量, 即薄荷提取物可通过DAF-16发挥抗紫外辐射作用; 薄荷提取物可改善线虫肌肉功能, 增强成年线虫的运动能力并增加其吞咽频率, 且在实验条件下, 薄荷提取物不损害线虫寿命和生育能力.
