水胁迫对辣椒(Capsicum annuum var.glabriusculum)叶片生长和气体交换的影响
2021-05-26MARTNEZACOSTALAGUNESESPINOZACASTELESTRADALARAVIVEROSTREJO
MARTÍNEZ-ACOSTA E ,LAGUNES-ESPINOZA L C *,CASTELÁN-ESTRADA M ,LARA-VIVEROS F ,TREJO C
(1. 墨西哥塔巴斯科州卡德纳斯塔巴斯科校区研究生院植物生理实验室, CP 86500 墨西哥塔巴斯科州; 2. 墨西哥伊达尔戈州圣弗朗西斯科马德罗旧金山理工大学, 42660 墨西哥伊达尔戈州; 3. 墨西哥墨西哥州特斯科科蒙蒂塞洛校区研究生院植物学系, CP 56230 墨西哥墨西哥州)
1 前言
近年来,全球降水模式不断变化,导致洪水和干旱气候日益频繁,其持续时间和强度各不相同,严重影响了农业生产和生物多样性[1]。这些极端气候变化产生的水分胁迫引起了植物形态和生理水平上的响应[2-3],削弱了植物的生长,使其产量下降[4-5]。这些影响造成的损害除了与植物生长发育过程中的土壤和环境因素相关,还取决于胁迫施加时的物候阶段、所涉及的物种、品种以及胁迫本身的强度和持续时间[1,6-7]。
一年生辣椒是辣椒的5个驯化种之一,其果实辛辣、营养价值高,形状、颜色和大小变化丰富多样[8-9],被广泛种植于世界各地。研究认为该物种对水分的盈亏、导致植物矮化的环境、叶面积、分枝数、光合色素含量、气体交换,以及单株的果实大小、果实数量等条件都十分敏感[10-12]。淹水条件下,不同品种的辣椒通过降低光合色素含量、气孔导度(gs)和蒸腾速率(E),同时提高水分利用效率(WUE)来抵御胁迫;不同物种光合作用速率存在差异,对胁迫的响应也各不相同[10,13]。一方面,水分亏缺胁迫会导致植物气孔关闭和叶肉电导率下降,另一方面,受水分亏缺影响,植物的叶面积减少,可截获光的面积减少,因此植物的光合速率和生物量的积累[6,14-15]受到了影响。Campos等[16]的研究结果表明中度至重度缺水通过影响辣椒的气孔导度来降低碳的同化作用,但其主要原因是质体醌到光系统Ⅰ(PSI)的电子传递链受到了损伤。同时还发现水分胁迫对根系生物量的积累也产生了抑制作用[17]。
从西北部的锡那罗亚州到东南部的塔巴斯科州,野生辣椒品种广泛分布于墨西哥各地,这里被认为是辣椒驯化的中心[8]。在这里,有研究发现部分辣椒种(C. annuumvar.glabriusculum)仍然以野生和半驯化状态存在,表现为分枝较多的草本灌木植物,具有较高的表型可塑性[18]。该物种被认为是辣椒野生种的祖先[19],是育种计划中的重要遗传资源。它广泛分布于中美洲、哥伦比亚和美国南部[20]。在很多地区辣椒都被当作调味品添加到菜肴中,因此市场对新鲜辣椒产品的需求量很大[18,21,27]。在墨西哥东南部的塔巴斯科州,辣椒(Capsicum annuumvar.glabriusculum)又被称为阿玛什托辣椒(amashito chili)。由于这个物种的种植业还没有发展到商业规模,因此当地的居民只能从家庭菜园、牧场或种植园里自然生长的辣椒种群中采集得到其果实。近年来降水模式发生变化,洪水与干旱季节交替出现,导致这一物种在全年热带潮湿的条件下生长,预计到2050年这一情况将会加剧[22]。气候等环境因素,以及其他因素包括种子的休眠状态、土地利用情况和农药的集约化施用等均是限制当地辣椒种群发展的主要因素[23-25]。由于当地的辣椒种植规模非常小,考虑其种植效益,通常选择催芽前处理来打破种子的休眠[25],目前已经有人开始研究辣椒在生长过程中对环境条件的响应。研究结果表明,在许多重要经济作物的栽培种中,水分胁迫对植物生长具有一定的影响,其中包括一年生辣椒(C. annuum)、浆果状辣椒(C. baccatum)、黄灯笼辣椒(C. chinense)、灌木状辣椒(C. frutescens)和绒毛辣椒(C. pubescens)5个辣椒栽培种。但是却很少关注当地重要的辣椒(Capsicum annuumvar.glabriusculum)种植品种在生长发育过程中对不同胁迫的响应。通过这类研究可以揭示该物种对不同胁迫的敏感程度,从而有助于优化辣椒多样性管理和小规模种植技术。对其他野生辣椒属植物的光合响应、酶活性和形态特征的研究表明,部分野生辣椒品种表现出对水分胁迫的耐受性[10]。基于此,本研究通过测定辣椒(C. annuumvar.glabriusculum)的光合特性、地上部分和根系生物量的积累来评价其生长过程中对持续淹水和水分亏缺的响应。
2 材料和方法
2.1 植物材料
2015年5月从墨西哥塔巴斯科州维曼吉约市德埃斯科瓦尔区(北纬17°43′26′,西经93°22′97′)的一个可可种植园里自然生长的野生群体中采集得到辣椒(C. annuumvar.glabriusculum)果实。从果实中提取种子,用蒸馏水洗涤,放在吸水纸上,室温下置于阴凉处(30 ℃)晾干。在进行温室试验之前,使用1%氯化四氮唑进行种子活力测试[26]。
2.2 试验设计
两个试验采取随机区组设计,各处理(淹水或缺水)使用因子排列。播种之前,使用500 ppm的赤霉酸(AG3)溶液将20 粒种子处理24 h,然后在发芽盘中播种,使用泥炭藓作为基质并每天灌溉。出苗后15 d,将幼苗移植到30 cm × 30 cm的育苗袋中,其中含有来自采集地的土壤、堆肥(牛粪和可可壳以及甘蔗滤饼)和蛭石(比例为10∶2∶1,v/v)组成的基质。基质的pH 值为 6,含有0.32 %的氮、5.80 %的有机物、有效磷含量为191.40 mg/kg、钾含量为2.34 mg/kg。为了在缺水处理中设置合适的水分含量,需要预先确定好基质的保水曲线。基质含水量为35.8%时等同于田间持水量,基质含水量为23.1%时达到永久萎蔫点。
分别在20、40、80和120 d时进行淹水处理。在每个时间间隔里,每个处理分别设置5个重复,每棵植株视为一个重复。在4个时间间隔里,每次淹水处理持续的时间分别为5 d和10 d。每次淹水处理结束时测量所有数据。在各淹水处理和时间间隔中将未淹水的植株作为对照。通过在基质表层设置2.5 cm厚的水层来实现淹水处理。为了保持淹水处理的一致性,每天通过加水来补偿育种袋中水分的损耗。
在40、80和120 d设置水分亏缺处理。研究期间,每个时间间隔里,水分亏缺处理下植株的灌水量分别为田间持水量的100 %(对照FC)、70%、50%和25%。用湿度计(Kelway Soil Tester,Japan)测定每个处理中的基质含水量,并根据需要每天加水进行调整。在每个时间间隔中,每一棵植株视为1个重复,每种处理都包含5个重复。
2.3 气体交换
在每个时间间隔期和重复处理中,于上午10:00 ~ 12:00,光照强度为400~600 μmol/m2/s,温度为30±0.5 ℃,相对湿度为60%~70%时,从每个处理中随机取3 片成熟的叶子,用便携式光合作用测定系统(LCi,ADC BioScientific,UK)测定其光合速率(PN)、蒸腾速率(E)和气孔导度(gs)。
2.4 光合色素
从不同时间间隔的每个处理的植物叶片中取出面积为1 cm2的圆盘,一式三份,置于装有5 mL N,N-二甲基甲酰胺的测定管中,在黑暗中放置24 h,然后使用分光光度计(UV-Vis Multiscan Go,Thermo Scientific, Finland)测定其在480、647和664 nm处的吸光度值。叶绿素(Chl)a和b、总叶绿素和类胡萝卜素的含量参照Wellburn[28](1994)的方法来计算。
2.5 生长状况和叶面面积
每次处理结束时,测量每株植株的高度(cm),并将样品分为叶、茎和根三部分。使用叶面积仪测定各时间间隔中不同处理下每个重复植株的总叶面积(LI-3100C, LI-COR BioSciences,Lincoln, NE,USA)。将样品放在60 ℃的高温空气烘箱中干燥(SHEL LAB,USA)以测定叶、茎和根的生物量的干重值。
2.6 相对含水量(RWC)
在水分亏缺(WD)处理中使用6个1 cm2的叶片圆盘测定得到该参数。将圆盘称重以获得鲜样质量(FM),再将其置于5 mL蒸馏水中,在5 ℃下放置24 h,用滤纸吸干多余的水分,称重以获得饱和质量(TM)。然后在60 ℃的高温空气烘箱(SHEL LAB,USA)中干燥24 h,以获得干物质重量(DM)。然后参照Thameur等[29]的方法来计算RWC:
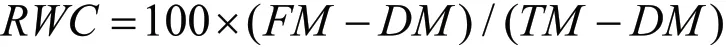
2.7 ABA
淹水处理后测定ABA的浓度,参照Khadri等[30]和Kishwar等[31]的方法。将新鲜的叶片材料(0.5 g)浸入5 mL的萃取溶剂中(80%甲醇+ 10 mg/L丁基羟基甲苯),在4 ℃条件下孵育1 h,然后离心(6800 x g, 15 min),收集上清液。用1 mL萃取溶剂再连续萃取沉淀物2次。然后将3次萃取所得的上清液混合均匀,并加入30 mg聚乙烯聚吡咯烷酮(PVPP),以消除可能干扰免疫测定的植物色素和其他非极性化合物。将所得的沉淀重悬于pH值为7.5且含有0.5 mL的缓冲液(25 mM Tris-HCl,100 mM NaCl, 1 mM MgCl2)中。使用激素ABA的特异性PGR-1检测试剂盒(PGR1-1KT, Sigma),通过免疫测定法(ELISA)对其进行定量。每孔加入等量的0.1 mL样品和0.1 mL示踪液,在4 ℃下孵育3 h。在此孵育过程中,样品中的ABA与连接在碱性磷酸酶上的示踪分子竞争性的结合固定在酶联免疫吸附试验板上的ABA特异性单克隆抗体。孵育结束时,0.1 mL PBSTween®溶液洗涤2次,加入0.2 mL底物溶液(对硝基苯基磷酸酯),在37℃条件下孵育60 min以产生酶促反应。用酶标仪在405 nm处读取吸光度值(UV-Vis Multiscan Go,Thermo Scientific,Finland),根据ABA标准曲线图进行定量(0~1 000 pmol/mL)。
2.8 统计分析
将两次独立试验获得的数据分别进行方差分析(ANOVA)。在此之前,采用安德森-达令(Anderson-Darling'stests)检验和列文检验(Levene'stests)对数据进行正态性和方差齐性检验;当假设被拒绝时,对数据进行约翰逊变换(Johnsontransformation)[32]。影响淹水试验的因素为淹水时间(0、5、10 d)和时间间隔(20、40、80、120 d)。至于水分亏缺处理,考虑的因素是胁迫处理(施加100%、70%、50%和25%田间持水量的水分)和时间间隔(40、80和120 d)。使用SAS[33]程序对数据进行均值测验(Tukey′ s means tests,P< 0.05)。
3 结果
淹水的影响:持续10 d的淹水处理显著影响了植株的生长特性和光合色素含量(表1,图1)。从结实期开始(120 d)连续淹水10 d,辣椒植株高度显著降低(27.2%)。同样,120 d时淹水处理10 d对植株总生物量、叶片和根系生物量的积累具有负效应(图1),但其茎生物量的积累不受淹水时间长短的影响(图1)。
从80 d开始,淹水处理10 d的辣椒植株叶面积出现显著差异(表1),下部的叶片开始黄化和脱落。在120 d时,观察到叶片的衰老和凋零,并且这一时期叶片的生物量减少了45.1%。在120 d时持续淹水处理10 d,植株的光合色素浓度也受到影响(表1),但连续淹水处理5 d并未对植物的生长特性和光合色素浓度产生显著的影响(表1)。

表 1 淹水处理下辣椒(Capsicum annuum var. glabriusculum)在移栽后不同时间点的株高、叶面积和光合色素含量

图1 辣椒(Capsicum annuum var. glabriusculum)在淹水处理下四个生长阶段中的地上部分总生物量(A)、叶片生物量(B)、茎生物量(C)、根生物量(D)
从20 d开始,淹水持续时间和时间间隔(DAT interval)均显著地影响了辣椒(C.annuumvar.glabriusculum)的光合特性(图2)。光合作用速率、蒸腾速率和气孔导度在淹水处理5 d后开始下降(分别为62.1%~87.1%、6.0%~77.7%和83.3%~91.6%),在120 d时接近于0。在120 d时淹水处理10 d,植株的光合特性完全被抑制。我们还观察到,气孔导度显著降低影响了CO2的吸收量,从而影响了光合作用的速率。
与未淹水处理的植株相比,随着气孔导度(gs)的降低,淹水处理的植株在40和80 d时脱落酸(ABA)浓度呈上升趋势(> 100%)(图3)。
缺水的影响:植物的株高在缺水处理80 d(高达36.5%)和120 d(高达51.5%)时显著降低。水分胁迫处理为70%的植株在80 d和120 d时,其总生物量、地上部分生物量和根系生物量也同样受到了的抑制作用。所有WD(水分亏缺)处理植株的叶片生物量从40 d开始均显著减少(高达50%)(图4)。由于水分亏缺的影响,叶面积和比叶面积在所有时间间隔中均显著减少(表2)。比叶面积的减少,表明叶片由于水分亏缺而增厚,这一现象在120 d时尤为明显。可以观察到从80 d开始,由于受到水分亏缺的影响,叶片的相对含水量RWC出现显著的差异(表2)。
在40 d时,25%水分胁迫处理下的植株PN(25.5%)较低。从40 d开始,随着植物可利用水分含量的降低,PN和E的速率显著降低(图5)。在所有水平的水分胁迫下,气孔导度均从40 d开始下降(图5)。在80和120 d,可利用水含量为70%、50%和25%的植株中气孔导度(gs)接近0,表明气孔关闭。在40 d时,植株水分利用效率(WUE)随着基质水分含量的降低而显著提高(图5),这可能是因为这个阶段的植株对胁迫的耐受力更高。

图2 辣椒(Capsicum annuum var. glabriusculum)在移栽后不同时间点以及不同淹水持续时间下的光合作用速率(PN)、蒸腾速率(E)和气孔导度(gs)

图3 辣椒(Capsicum annuum var. glabriusculum)在移栽后20、40和80d以及不同淹水持续时间下的ABA含量
4 讨论
辣椒(C. annuumvar.glabriusculum)生长在潮湿的墨西哥热带地区,这里高降水量(在潮湿季节每月最多可达500 mm)和低降水量(在干燥季节每月最多可达100 mm)交替出现,但是在这样的环境下,这一物种并没有表现出对水分胁迫具有更强的耐受性。两种胁迫(水淹和水分亏缺)均对辣椒(C. annuumvar.glabriusculum)的生长和光合特性产生了影响,主要集中在开花和结实阶段。在这些阶段中,正在形成的果实对同化物具有更大的需求,因此会加剧胁迫的效果,随着淹水时间的延长,导致叶片的衰老和脱落,对叶面积产生了一定的影响。已有文献记载植物经过水淹处理后的一般反应是叶片过早衰老和脱落,同时抑制新叶的形成和扩展[34]。对于植物而言,减少叶面积是在胁迫影响期间节省能量的一种策略,通过减少呼吸以保持尽可能低的新陈代谢[35]。在茄科植物中,水淹对植物营养生长的负面影响也与光合作用速率降低有关[36]。根系的损耗和根际的缺氧往往与植株发黄、营养不良、坏死和叶片脱落等现象有关[37]。本研究中经过淹水处理的辣椒植物在120 d时根系生物量减少,这可能是由于缺氧引起了植株活力和根系的损耗[2,42]。在这个阶段,我们观察到有不定根的产生,这可以减轻缺氧造成的胁迫,但不能弥补根系的损失。

图4 辣椒(Capsicum annuum var. glabriusculum)在移栽后不同时间点以及基质中可利用水分含量(100%、70%、50%和25%)不同时间地上部分生物量(A)、叶片生物量(B)、茎生物量(C)和根生物量(D)的变化
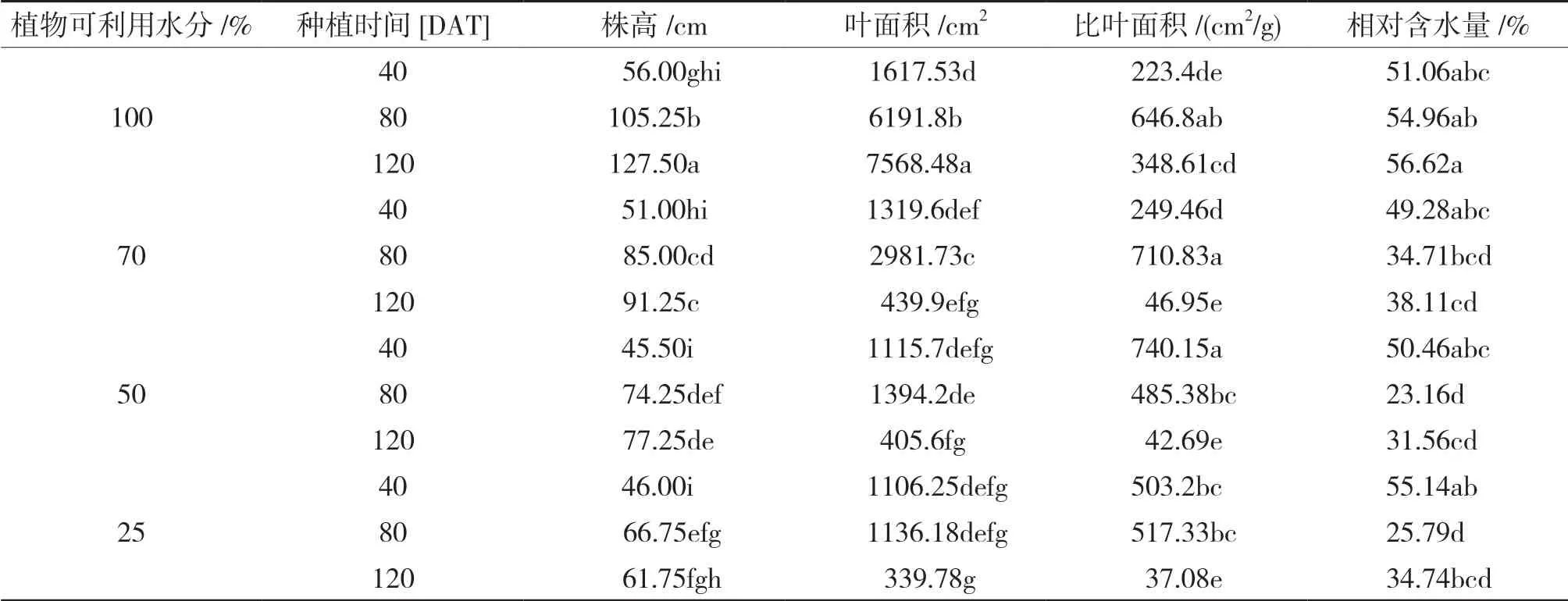
表 2 辣椒(Capsicum annuum var. glabriusculum)在移栽后40、80和120d时的株高、叶面积、比叶片面积和相对含水量

图5 辣椒(Capsicum annuum var. glabriusculum)在移栽后不同时间点以及基质中可利用水分含量分别为100%、70%、50%和25%时的光合作用速率(PN)、蒸腾速率(E)、气孔导度(gs)和水分利用效率(WUE)
在120 d(开花期)时,由于淹水10 d加速了叶片衰老,导致光合色素减少,表明该物种在这一阶段不能耐受超过5 d的淹水,而它在营养期却能够耐受。在其他种类的辣椒[10]中也观察到了这种由于淹水胁迫导致光合色素减少,光系统Ⅱ(PSⅡ)功能减弱,进而影响光合作用速率的现象[16]。辣椒(C. annuumvar.glabriusculum)主要在开花期对淹水十分敏感,尤其是当它生长在潮湿的热带环境中时,这种敏感性主要体现在持续淹水5 d和10 d时植株光合速率(PN)、蒸腾速率(E)和气孔导度(gs)显著降低。在其它茄科植物中,例如番茄,在淹水条件下气孔关闭,细胞内CO2的浓度降低,这可能是导致叶绿素荧光参数发生变化的原因[38]。在商业辣椒品种中,Ismail 和Davies[39]发现仅淹水24 h,植株的光合速率(PN)和气孔导度(gs)就开始下降,他们认为在这种情况下,根部信号的丢失可能是气孔关闭的原因。如本研究所提到的,前人关于辣椒的研究也表明淹水胁迫会导致叶片中脱落酸增加,气孔导度和叶片生长的减少[39]似乎也间接反映了这一结果。
辣椒(C. annuumvar.glabriusculum)对水分亏缺的响应表现为各个生长阶段的生物量和气体交换量的减少,在不同种类的辣椒中,轻度、中度和重度缺水均对植株的生物量有负面影响[11]。正如在一年生辣椒(C. annuum)、黄灯笼辣椒(C.chinense)和灌木状辣椒(C. frutescens)中所观察到的,这些生物量的减少可能是相对生长率(RGR)、叶面积扩展和根系生长变化[17]等降低的结果[40]。总叶面积的减少反映了RGR的减少和成熟叶片的衰老,因为已有研究表明,水分亏缺胁迫会加剧这两个过程[40-42]。水分亏缺的影响也反映在叶片的RWC中,在可利用水含量为70%的植株中,该指标从80 d(开花初期)就开始下降。在其他品种的辣椒中,水分亏缺对RWC的影响不仅表现在营养阶段,也表现在开花和结果阶段[40]。在植物可利用水含量为25%的植株中,光合作用和蒸腾速率从40 d开始下降,在可利用水含量为其他水平的植株中这两个指标从80 d开始下降。
从淹水的情况可以看出,辣椒(C. annuumvar.glabriusculum)在开花和结实阶段水分亏缺,导致它对胁迫十分敏感。研究表明,水分缺乏对气体交换的负面影响是由气孔关闭引起气孔导度(gs)降低,和/或光合代谢的变化,最终转化为营养生长和产量的降低。Okunlola等[40](2017)表明土壤含水量在40%~45%和30%~35%之间会显著影响辣椒植物的功能并降低其产量。
结论:在本项研究中,淹水胁迫对120 d的辣椒(C. annuumvar.glabriusculum)的营养生长产生了不良影响,影响了叶和根的生物量的积累以及光合色素的浓度。反而言之,光合速率(PN)、蒸腾速率(E)和气孔导度(gs)从20 d开始受到淹水的影响,其影响效应可以从120 d时辣椒地上部分生物量的积累情况看出。同样的,水分亏缺也对辣椒植株的营养生长产生了不良影响,影响其叶片、茎和根的生物量。而光合速率(PN)、蒸腾速率(E)和气孔导度(gs)也随着基质中植物可利用水含量的降低而降低。
由以上结果可知,水分过量或亏缺均会导致辣椒(C. annuumvar.glabriusculum)的生理发生变化,从而影响其在营养生长和生殖生长时期生物量的积累。一方面,气候变化导致降雨量发生急剧变化,可能会影响到当地辣椒种群的生存。另一方面,本试验得到的数据可以为制定该物种在湿热带环境条件下的栽培和管理策略提供借鉴意义。