细胞珠蛋白过表达对人肝细胞株LO-2脂质代谢的影响初探
2021-05-25刘诗俐王哲彦李珍王萍董文其
刘诗俐, 王哲彦, 李珍, 王萍, 董文其
(1.南方医科大学 检验与生物技术学院, 广东 广州 5100802; 2.中山大学附属第五医院 分子影像中心, 广东 珠海 519000)
非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)是引起许多慢性肝病的主要原因,全球的患病率约为24%,早期主要表现为非酒精性脂肪肝(nonalcoholic fatty liver,HAFL)[1].由于氧化应激、炎症、线粒体功能障碍等原因,NAFL将逐渐发展为非酒精性脂肪性肝炎(nonalcoholic steatohepatitis,NASH)、肝硬化,乃至发展为肝癌[2-3].细胞珠蛋白(cytoglobin,CYGB)是由日本学者Kawada在2001年研究大鼠肝星状细胞激活的分子机制时发现的一种新型球蛋白,最早被命名为肝星状激活蛋白(stellate cell activation-associated protein,STAP)[4].CYGB是人体内广泛表达的一种六配位蛋白,作为球蛋白家族的一员,CYGB具有一氧化氮双加氧酶活性,参与细胞内氧的储存和运输[5].既往研究表明,CYGB通过清除肝星状细胞内过多的活性氧及羟基自由基,保护DNA免遭损伤[6],具有抑制肝星状细胞激活与迁移的作用[7-9],而CYGB的缺乏会导致胆管结扎小鼠早期肝细胞损伤和炎症增强,促进肝纤维化的发生与发展[10].目前,已有大量证据表明CYGB会抑制NAFLD过程的发展,但CYGB对NAFLD早期肝细胞脂质沉积的影响及分子机制的研究较少,因此,本研究通过构建人肝细胞系LO-2细胞脂肪变性模型,探究CYGB对NAFLD早期脂质沉积的影响,初步发现LO-2细胞脂肪变性的过程中伴随炎症增强,而CYGB可能参与抑制LO-2细胞脂质生成和炎性因子表达的过程,通过抑制NF-κB信号通路,下调甘油三酯及总胆固醇水平,缓解脂质沉积.
1 材料与方法
1.1 实验材料
1.1.1 材料
人正常肝细胞LO-2由南方医科大学检验与生物技术学院生物治疗研究所李红卫教授馈赠,本实验室保存;人肝细胞株LO-2-GFP-CYGB及阴性对照组细胞株LO-2-GFP由本实验构建[11].
1.1.2 试剂与仪器
高糖DMEM培养基,胎牛血清及质量分数为0.25%胰蛋白酶溶液(含EDTA)购自GIBICO;L-谷氨酰胺,棕榈酸及油红O购自SIGMA;油酸购自上海麦克林生化科技有限公司;无脂肪酸牛血清白蛋白购自大连美伦生物技术有限公司;甘油三酯(TG)及总胆固醇(T-CHO)测试盒购自南京建成海浩生物科技有限公司;细胞总RNA提取试剂盒购自广州维德昕生物科技有限公司;PrimeScriptTMRT reagent Kit with gDNA Eraser试剂盒购自大连宝生物工程有限公司;2× SYBR Green qPCR Master Mix购自美国Bimake公司; Western裂解液、PMSF、PDTC、一抗稀释液、质量分数为4%的多聚甲醛及苏木素染色液购自上海碧云天生物技术有限公司;白介素-1β(interleukin-1β,IL-1β)兔多抗、白介素6(interleukin-6,IL-6)鼠单抗、肿瘤坏死因子α(tumor necrosis factorα,TNF-α)兔多抗、山羊抗兔及山羊抗鼠IgG二抗购自武汉三鹰生物技术有限公司;β-actin鼠单抗(8F10)购自成都正能生物有限责任公司;NF-κB P65兔单抗购自美国Cell Signaling Technology公司;NF-κB PP65兔单抗购自北京博奥森生物技术有限公司;PVDF膜购自Millipore公司.
细胞培养箱购自Thermo Fisher Scientific;倒置显微镜、垂直电泳槽及湿转转膜仪购自BIO-RAD;化学发光仪购自GE;酶标仪购自BIO-TEK.
1.2 实验方法
1.2.1 LO-2细胞分离和培养
人肝细胞株LO-2用含质量分数为10%胎牛血清的高糖DMEM培养基,置于37 ℃、含体积分数为5%的CO2培养箱培养,当细胞汇合率达到80%~90%时,使用含EDTA的胰酶消化3 min,以1∶3进行传代培养或冻存.
1.2.2 LO-2细胞脂肪变性模型构建
根据文献[12-13]的方法构建LO-2细胞脂肪变性模型.取19.04 μL油酸与3 mL浓度0.1 mol/L的NaOH溶液混合,置于75 ℃水浴锅皂化20 min,称取0.6 g无脂肪酸牛血清白蛋白溶解于3 mL PBS中,两者混合静止30 min后4 ℃保存,即配得浓度10 mmol/L的油酸储存液;称取0.030 72 g棕榈酸与3 mL浓度0.1 mol/L的NaOH溶液混合,置于75 ℃水浴锅皂化20 min,称取1.2 g无脂肪酸牛血清白蛋白完全溶解于3 mL PBS中,两者混合静止30 min后4 ℃保存,即配得浓度20 mmol/L的棕榈酸储存液.使用时棕榈酸储存液以体积比1∶200,油酸储存液以体积比1∶50加入细胞完全培养基,培养24 h后即为LO-2细胞脂肪变性模型.
1.2.3 油红O染色鉴定LO-2脂质沉积情况
③⑬⑰⑲㉒㉓㉔㉘ ㉝[加]威 廉 ·莱斯:《满足的限度 》,李永学译,商务印书馆 2016 年版,第 13 ~26、42、145、37、2、115、8、135、6 页。
以异丙醇溶解并配置质量分数为5%的油红O母液,使用时以油红O母液与去离子水按3∶2混匀即可.制作LO-2细胞爬片后高脂培养24 h,无菌PBS清洗干净后,用质量分数为4%的多聚甲醛固定10 min,无菌PBS清洗干净后用体积分数为60%异丙醇浸洗15 s后,油红O染色10 min,体积分数为60%的异丙醇分化10 s,去离子水洗净后苏木素染色液染色2 min,洗净甘油封片,倒置显微镜镜下观察拍照.
1.2.4 qRT-PCR检测脂质生成相关基因
使用细胞总RNA提取试剂盒提取细胞总RNA,根据PrimeScriptTMRT reagent Kitwith gDNA Eraser试剂盒说明书配置溶液,42 ℃ 10 min、37 ℃ 15 min、85 ℃ 5 s逆转录为cDNA,使用2× SYBR Green qPCR Master Mix配置成10 μL体系后进行QPCR,程序设定为95 ℃ 10 min,以95 ℃ 15 s,60 ℃ 30 s进行40个循环,经历1个溶解曲线循环(95 ℃ 15 s,60 ℃ 60 s,95 ℃ 15 s)即可.使用的引物委托北京擎科生物公司合成,序列见表1.

表1 引物序列Table 1 Primer sequences
1.2.5 细胞甘油三酯、总胆固醇水平测定
LO-2细胞高脂培养48 h后,用含质量分数为1%~2%的Triton裂解液冰上裂解30 min,BCA法测定蛋白浓度,根据测试盒的说明要求配置空白组、标准组及样本组,每组设立3个重复对照,混匀,37 ℃孵育10 min,波长510 nm,酶标仪测定各组吸光度值(D).根据公式计算甘油三酯或总胆固醇水平(mmol/g):
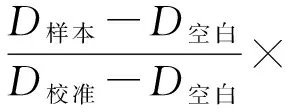
1.2.6 Western blot 检测NK-κB p65、PP65、IL-1β、IL-6及TNF-α表达水平
LO-2细胞高脂分别培养6 h、12 h、24 h和48 h收集,用含蛋白酶抑制剂和蛋白磷酸酶抑制剂裂解液冰上裂解30 min后提取蛋白,BCA法测定蛋白浓度,SDS-PAGE凝胶电泳后,转至PVDF膜后用含质量分数为5%脱脂奶粉的TBST封闭1 h,使用抗β-actin抗体与抗体稀释液以1∶5 000稀释,NF-κB p65、NF-κB PP65、IL-1β、IL-6及TNF-α抗体分别与抗体稀释液以1∶1 000稀释,4 ℃孵育过夜,TBST洗膜3次,每次10 min,再分别使用辣根过氧化物酶偶联的山羊抗鼠或山羊抗兔抗体孵育1 h后,TBST洗膜3次,每次10 min.ECL化学发光液显色发光,化学发光仪成像拍照.
1.3 统计学方法
SPSS 22.0软件分析实验数据.两组间比较采用独立样本t检验,多组间比较采用单因素方差分析.以P<0.05表示有统计学差异.
2 结果与分析
2.1 CYGB在过表达组与对照组中的表达水平
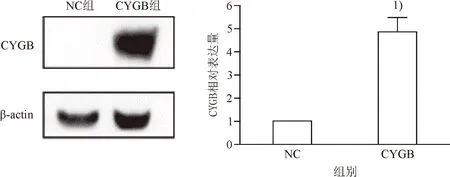
1)与NC组比较,P<0.051) Compared with the NC group, P<0.05
2.2 CYGB对脂变LO-2细胞脂质沉积的影响
LO-2细胞高脂培养24 h时,脂质沉积情况通过油红O染色显示(图2A).qRT-PCR结果显示,CYGB组中与脂质生成相关的基因ACACA、ACACB、FASN、ACSS1、ACSS2、ACSS3 mRNA相对表达量均低于NC组(P<0.05,图2B).CYGB组中甘油三酯及总胆固醇水平在高脂培养48 h时均低于NC组(P<0.05,图2C、D),以上结果说明CYGB在LO-2中过表达时下调细胞脂质水平,缓解细胞脂质沉积.
2.3 CYGB对LO-2细胞IL-1β、IL-6及TNF-α表达的影响
CYGB组与对照组经高脂培养6、12、24 h,Western blot测得Il-1β及IL-6的表达情况(图3A)及高脂培养0、12、24、48 h时测得TNF-α的表达情况(图3B),结果显示,过多的游离脂肪酸促进LO-2细胞IL-1β和TNF-α表达(P<0.05),CYGB抑制LO-2细胞IL-1β、IL-6及TNF-α的表达(P<0.05),说明L0-2细胞在脂肪变性过程中伴随炎性因子释放增强, 而CYGB在LO-2细胞中过表达时可能具有抑制炎症的作用.
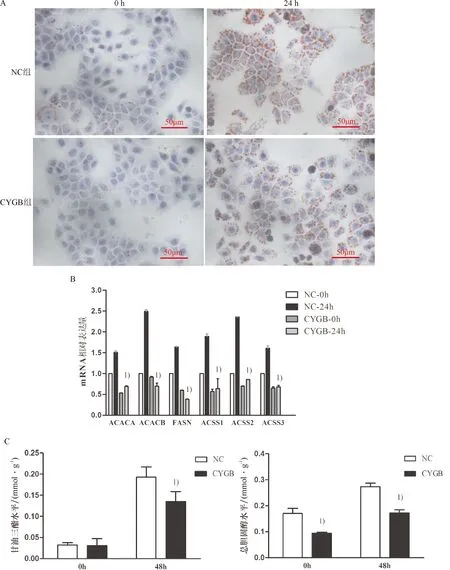
1)与NC组比较,P<0.05. A: CYGB组与NC组高脂培养24 h后油红O染色情况(400×).B:CYGB组与NC组高脂培养24 h后ACACA、ACACB、FASN、ACSS1、ACSS2、ACSS3 mRNA 表达情况.C: CYGB组与NC组高脂培养48 h后细胞内甘油三酯水平.D: CYGB组与NC组高脂培养48 h后细胞内胆固醇水平.
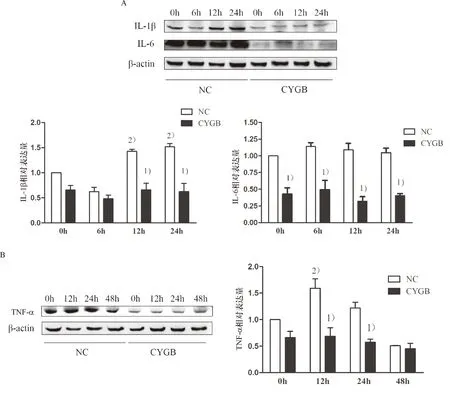
1)与NC组比较,P<0.05;2)与0 h比较,P<0.05. A:LO-2细胞在高脂刺激后IL-1β,IL-6的表达水平.B: LO-2细胞在高脂刺激后TNF-α的表达水平.
2.4 NF-κB通路对LO-2细胞甘油三酯、总胆固醇水平的影响
用含有不同浓度(0、60、90 μmol/L)的NF-κB抑制剂PDTC和高脂成分的培养液处理LO-2细胞48 h,结果显示,90 μmol/L PDTC可下调LO-2甘油三酯和总胆固醇水平(P<0.05,图4A、B).
2.5 CYGB对NF-κB通路的影响
高脂刺激24 h后,NF-κB通路激活,P65和P-P65表达增加,而CYGB组与NC组相比,NF-κB P65表达水平在24 h开始下调(P<0.05),P-P65 在48 h时下调(P<0.05,图5),表明过多的脂肪酸摄取激活LO-2细胞 NF-κB信号通路,而CYGB的过表达表现出抑制NF-κB通路的现象.
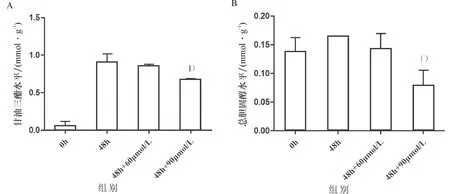
1)与高脂处理48 h相比,P<0.05. A:60、90 μmol/L浓度的PDTC对脂变LO-2细胞内甘油三酯水平的影响.B: 60、90 μmol/L浓度的PDTC对脂变LO-2细胞内总胆固醇水平的影响.
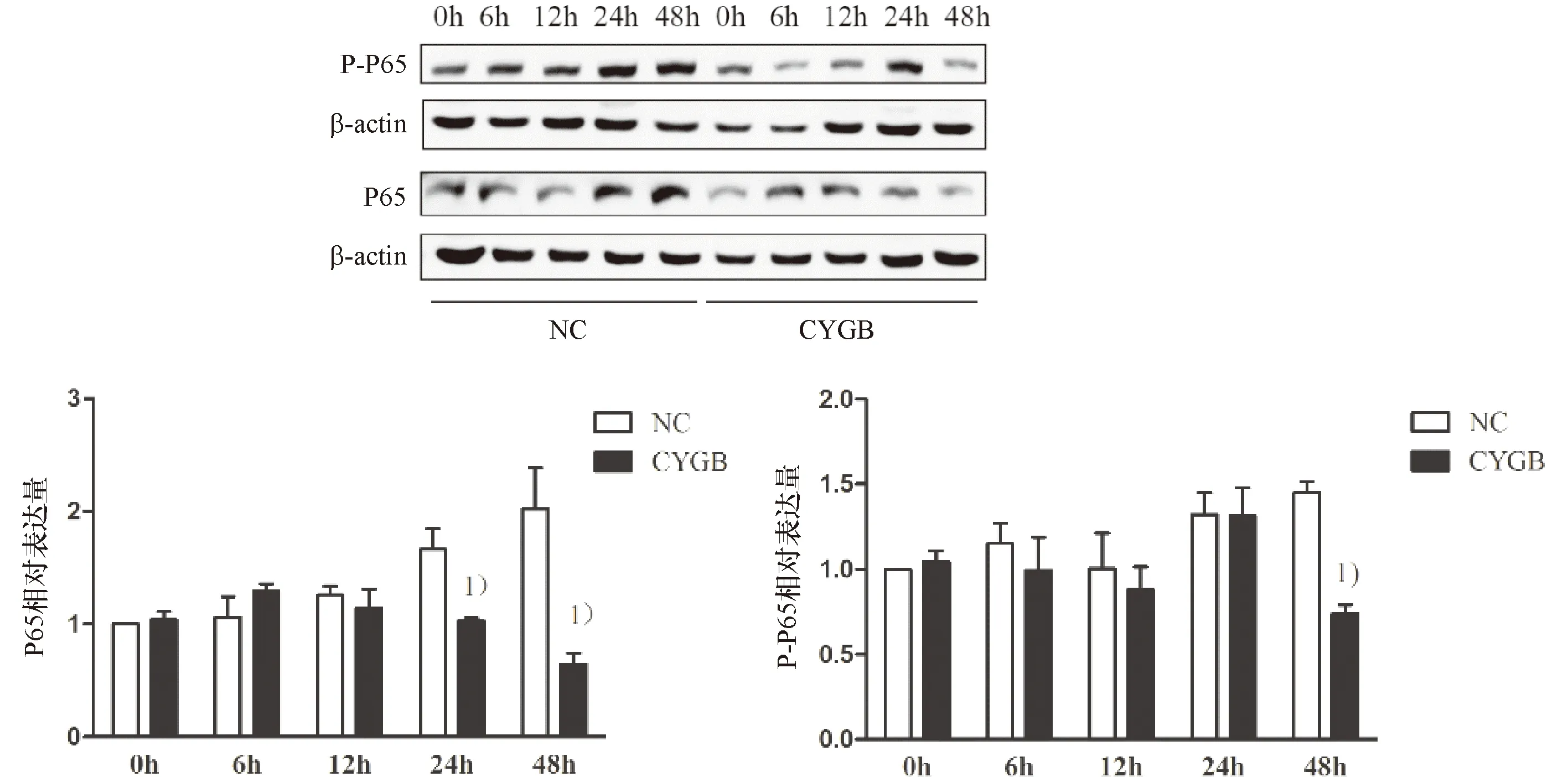
1)与NC组比较,P<0.05. 高脂培养后,LO-2细胞内NF-κB P65,P-P65表达水平.
3 讨论
NAFLD的早期主要表现为肝脏单纯性脂肪变性,而肝细胞损伤并伴随炎症增强,将逐渐发展为NASH,不仅增加了系统性血管内皮功能障碍和动脉粥样硬化的风险,还可能发展为肝硬化甚至是肝癌[14-15].尽管有诸多研究报道了NAFLD的发病机制和治疗策略,但NAFLD其中的分子机制与靶向治疗仍需进一步的研究.CYGB作为球蛋白家族的新成员,CYGB被认为具有一氧化氮双加氧酶活性,通过调控体内NO水平调节O2,参与抗氧化和低氧调节,具有抑制肿瘤的作用[5-6, 16-17].本实验室前期的研究结果发现,CYGB能显著改善大鼠肝纤维化,对大鼠酒精性脂肪肝、高血脂及动脉粥样硬化均具有一定的治疗作用[18-20].但是CYGB的作用靶点和分子机制还未完全清楚,因此,本研究构建了CYGB稳定过表达的人正常肝细胞株LO-2[11],来进一步探究CYGB对肝细胞功能和代谢的影响.
研究表明,CYGB通过清除细胞内过多的ROS及抗氧化应激等过程来抑制NAFLD的发展[6, 21].然而,关于CYGB对NAFLD早期肝细胞单纯性脂肪变性过程的影响与机制研究较少,因此,本研究通过高脂培养液培养LO-2细胞,来模拟NAFLD早期肝细胞脂肪变性的过程,探究CYGB对LO-2细胞脂质沉积的影响及分子机制.本研究发现,LO-2细胞通过不断摄取游离脂肪酸,促进脂质沉积过程,而在CYGB过表达组中,与脂质生成相关基因ACACA、ACACB、FASN、ACSS1、ACSS2、ACSS3的表达明显下调,细胞内甘油三酯及总胆固醇水平低于对照组,提示 CYGB缓解细胞内脂质沉积的原因可能是通过抑制细胞脂质合成过程完成的.
既往研究表明,在胆汁淤积性肝病中,CYGB敲除后的小鼠与野生型小鼠相比,肝脏中NO代谢物和氧化应激水平增加,进一步增强早期炎症和肝细胞损伤[10];在NASH小鼠模型中,CYGB敲除小鼠出现了明显的炎症和纤维化,最终发展成肝癌[22].在本研究中,过多的脂肪酸摄取会促进LO-2细胞IL-1β、TNF-α的释放,进一步诱导炎症的发生,而CYGB过表达组中IL-1β、IL-6及TNF-α水平均低于对照组,提示在LO-2细胞脂肪变性过程中伴随炎症的发生,而CYGB可能通过抑制炎症而帮助减缓LO-2细胞脂肪变性.
核转录因子κB(nuclear factor kappa B,NF-κB)家族参与免疫反应、炎症和癌症的调节[23].有研究表明,NF-κB参与并促进肝细胞脂肪酸摄取过程[24],参与肝纤维化的形成,促进细胞脂质沉积,抑制NF-κB信号通路,明显改善了小鼠肝纤维化[25].有临床研究发现,在临床肝癌患者的组织样本中,NF-κB表达水平明显上调[26],与本实验研究结果一致,在LO-2细胞脂肪变性过程中,NF-κB信号通路激活,而通过抑制NF-κB通路,LO-2细胞内甘油三酯和总胆固醇水平降低,缓解脂质沉积.结合以上研究,提示在NAFLD早期肝细胞脂肪变性过程中,大量游离脂肪酸激活NF-κB通路,而NF-κB通路的激活可能会进一步诱导脂质沉积.另外,本研究发现,CYGB过表达组在高脂处理24 h后出现抑制NF-κB信号通路的现象,通过抑制NF-κB通路,脂质沉积得到缓解,说明CYGB可能通过抑制NF-κB通路来缓解LO-2细胞脂质沉积.此外,由于本研究是基于CYGB稳定过表达的LO-2细胞株进行研究的,与人正常肝细胞株LO-2的基因表达与代谢功能可能会有所差异,因此,关于CYGB对NAFLD早期脂质代谢的影响需要更多的探索与深入研究.
综上所述,本研究通过构建人正常肝细胞LO-2脂肪变性模型,探究CYGB对NAFLD早期脂质沉积的影响及分子机制,初步发现过多的游离脂肪酸摄取诱导LO-2细胞脂质沉积,诱导NF-κB信号通路激活,伴随炎症反应增强,而CYGB可能抑制炎性因子表达,通过抑制NF-κB信号通路,下调甘油三酯及总胆固醇水平,缓解LO-2脂质沉积.本研究初步发现CYGB缓解LO-2脂质沉积的分子机制并为NAFLD早期治疗提供了理论依据.
