淫羊藿素对不同p53分型顺铂耐药卵巢癌细胞株周期阻滞作用的研究
2021-05-25郑少烈李若玢高绿芬高雪松李囡王晓玉
郑少烈, 李若玢, 高绿芬, 高雪松, 李囡, 王晓玉
(暨南大学 附属第一医院 妇产科, 广东 广州 510632)
卵巢癌的复发耐药问题,一直是影响患者生存期及生活质量的主要原因.细胞周期阻滞能够促进突变DNA的修复以及异常细胞分裂的逆转,为人体恶性肿瘤的重要监控机制之一.p53在调控细胞周期阻滞过程中发挥着十分重要的作用,肿瘤耐药的产生与p53功能的失调关系密切.淫羊藿素(ICT)作为传统补益中药,具有抗癌谱广、逆转化疗耐药、调节免疫力等特点.本实验通过建立细胞周期同步化模型,研究淫羊藿素影响不同p53分型顺铂耐药卵巢癌细胞株周期阻滞的作用途径及机制,为复发耐药性卵巢癌治疗药物的研发提供新思路.
1 材料与方法
1.1 实验细胞
三株p53不同分型人卵巢癌细胞株p53野生型C13*、p53变异型A2780cp、p53缺失型SKOV3,由渥太华大学细胞与分子医学系Tsang Ben教授课题组馈赠[1-2],储存于暨南大学附属第一医院中心实验室.
1.2 主要试剂
淫羊藿素购自广州杰特伟生物有限公司,胸腺嘧啶核苷酸(TdR)购自Sigma公司,PRMI-1640培养基、质量分数为0.25%胰酶/质量分数为0.02%EDTA、青-链霉素、胎牛血清均购自GIBCO公司,二甲基亚砜(DMSO)、碘化丙啶(PI)、吐温20(Tween-20)均购自Sigma公司,甲醇、无水乙醇均购自广州化学制剂厂,苯甲基磺酰氟(PMSF)、RIPA裂解液、ECL 发光试剂盒、SDS-PAGE 凝胶配制试剂盒、BCA蛋白浓度测定试剂盒、SDS 上样缓冲液、anti-GADPH(鼠单克隆抗体)、二抗(抗兔或抗鼠)、一抗二抗去除液(强碱性)均购自碧云天生物技术公司,anti-CyclinE(兔多克隆抗体)、anti-CyclinB1(鼠单克隆抗体)、Anti-CHK1(鼠单克隆抗体)、Anti-p53(鼠单克隆抗体)均购自Santa Cruz公司.
1.3 主要方法
1.3.1 采用TdR双阻滞法进行细胞周期同步化
(1)于6孔细胞培养板中接种SKOV3、C13*、A2780cp细胞悬液,以2.5×105/孔接种,培养箱中过夜.
(2)取TdR粉100 mg溶解于10 mL PBS,0.22 μm无菌滤器过滤,完全培养液稀释成浓度为2.0 mmol/L.待细胞贴壁后,PBS反复清洗2次,加浓度为2.0 mmol/L TdR完全培养液培养T阻滞.吸出含TdR完全培养液,PBS清洗3次,加入完全培养液继续培养T释放,后加浓度为2.0 mmol/L TdR完全培养液处理细胞T阻滞小时.
(3)去除TdR后,每隔4 h收集1孔细胞,PBS清洗后消化吹打细胞,1 000 r/min离心5 min,弃上清,4 ℃ PBS洗涤吹打,1 000 r/min离心5 min,去上清加200 μL 4 ℃ PBS重悬,再加2 mL -20 ℃体积分数为75%乙醇反复吹打,4 ℃过夜,-20 ℃保存.
(4)取固定好的细胞,2 000 r/min离心,去上清,加1 mL PBS混匀,1 000 r/min离心去上清,加入50 mg/mL PI,1 g/L RNase,质量分数为0.1% TritonX-100,避光室温孵育15 min,40 μm滤网过滤后上机进行流式细胞周期检测.
1.3.2 淫羊藿素对同步化卵巢癌细胞株周期的阻滞作用
(1)6孔板中接种SKOV3、C13*、A2780cp细胞株,每孔2.5×105个细胞,培养过夜.
(2)进行细胞同步化,待第2次去除TdR后,加入20 μmol/L淫羊藿素进行培养,共分为7个组(表1).
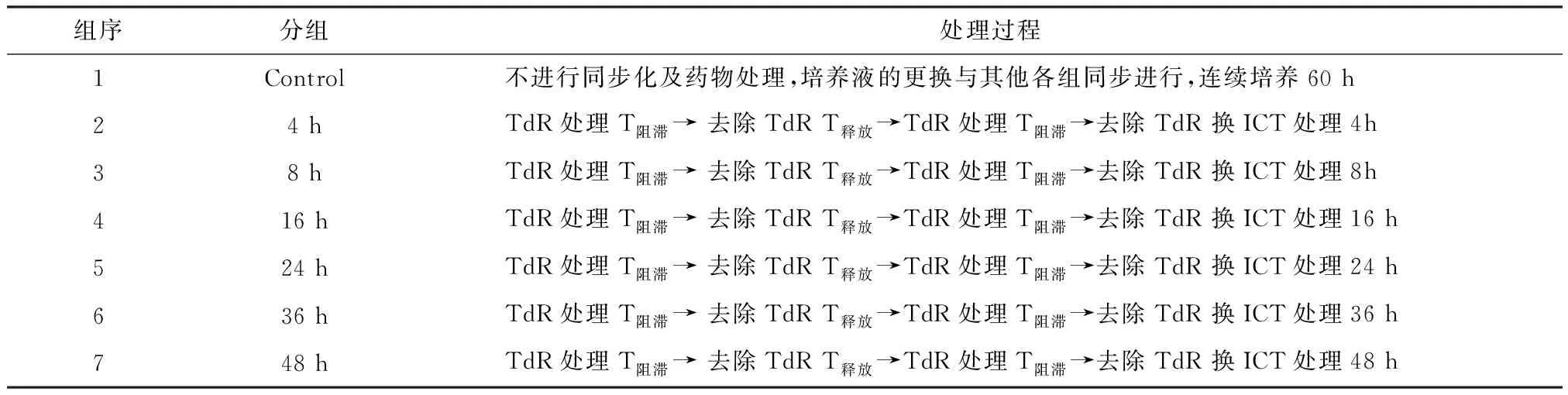
表1 7个不同分组细胞加药处理Table 1 Seven different groups of cells were treated with different time
(3)收集各组细胞,进行细胞固定及周期检测.
1.3.3 Western blot检测CyclinE及CyclinB1蛋白表达水平
(1)将SKOV3、C13*、A2780cp细胞株以2.5×105/孔接种于6孔细胞培养板中培养过夜.
(2)细胞同步化,待第2次去除TdR后,加入浓度为20 μmol/L淫羊藿素进行培养,共分为5个组(表2).
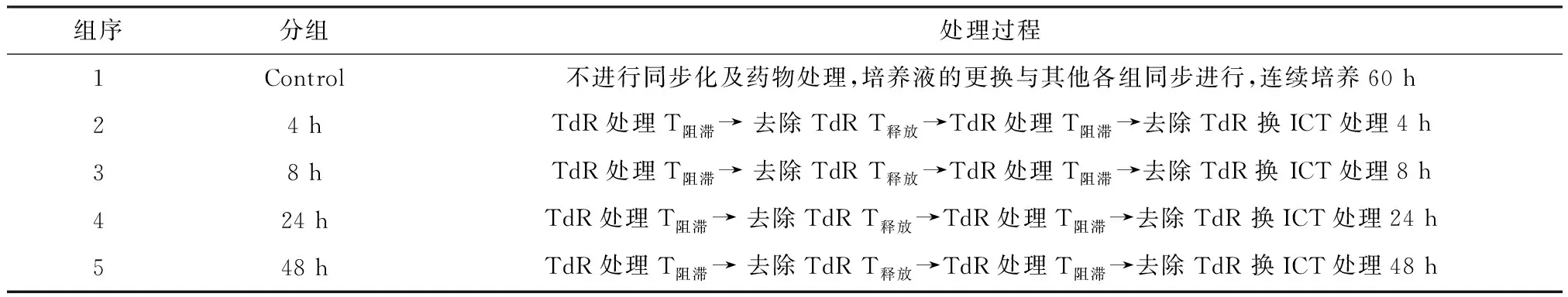
表2 5个不同分组细胞分组加药处理Table 2 Five different groups of cells were treated with different time
(3)SKOV3、C13*、A2780cp细胞株进行药物处理后,弃去培养液,4℃PBS洗涤2次,吸尽液体,置于冰上.
(4)每孔加质量分数为1%PMSF的RIPA裂解液100 μL,冰上裂解10 min,细胞刮刮下,继续裂解10 min,转移到1.5 mL EP管中,4 ℃下12 000 r/min离心10 min,取上清备用.
(5)用BCA蛋白测定试剂盒检测总蛋白.
(6)用含质量分数为1%PMSF细胞裂解液将所有蛋白配成相同浓度,加入样本体积量1/4的SDS-PAGE 5× loading buffer,混匀后于100 ℃煮沸5 min备用或-80 ℃保存.
(7)配置SDS-PAGE凝胶,电泳,转膜,封闭,抗体孵育及显色.
1.3.4 Western blot检测p53及CHK1蛋白表达水平
将SKOV3、C13*、A2780cp细胞收集后以2.5×105/孔接种于6孔细胞培养板中,置于细胞培养箱中培养过夜.细胞同步化,按照1.3.3步骤进行Western blot检测,anti-p53、anti-CHK1(稀释比例为1∶1 000),分为6组(表3).

表3 6个不同分组细胞加药处理24 hTable 3 Cells in different groups were treated with drugs for 24 hours
1.4 统计学分析
2 结果
2.1 TdR双阻滞法细胞周期同步化结果
(1)对顺铂耐药性卵巢癌C13*细胞株进行同步化处理,在解除第2次TdR阻滞后各个时段周期分布情况见表4,图1.TdR去除后0、20及24 h的G1期百分比高于control组及其他各时间段组,差异均具有统计学意义(P<0.05);TdR去除后4、8 h的S期百分比高于control组及其他各时间段组(P<0.05);TdR去除后8、12及16 h的G2期百分比高于control组及其他各时间段组(P<0.05).
表4 C13*细胞株同步化后各时段细胞各周期时相百分比
1)与control组相比,P<0.05
(2)顺铂耐药性卵巢癌A2780cp细胞株同步化处理结果见表5,图2.TdR去除后0、16及20 h的G1期百分比高于control组及其他各时间段组,差异均有统计学意义(P<0.05);TdR去除后4、8及24 h的S期百分比高于control组及其他各时间段组(P<0.05);TdR去除后8、12 h的G2期百分比高于control组及其他各时间段组(P<0.05).
表5 A2780cp细胞株同步化后各时段细胞各周期时相百分比
1)与control组相比,P<0.05;
(3)顺铂耐药性卵巢癌SKOV3细胞株同步化处理结果见表6,图3.TdR去除后0、24、28及32 h的G1期百分比高于control组及其他各时间段组,差异均有统计学意义(P<0.05);TdR去除后4、8、12及36 h的S期百分比高于control组及其他各时间段组(P<0.05);TdR去除后12、16及20 h的G2期百分比高于control组及其他各时间段组(P<0.05).
表6 SKOV3细胞同步化后各时段细胞各周期时相百分比

1)与control组相比,P<0.05
2.2 淫羊藿素对同步化顺铂耐药性卵巢癌细胞株周期阻滞作用
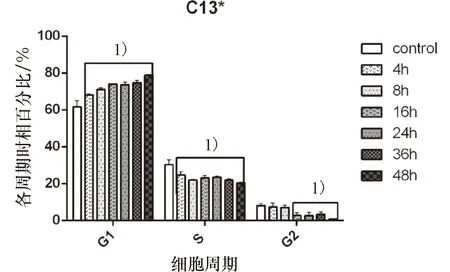
(1)淫羊藿素在最低有效抑制浓度20 μmol/L下对耐药性卵巢癌C13*细胞株分别作用4、8、16、24、36及48 h各周期时相分布情况见表7,图4.淫羊藿素作用细胞4 h起G1期百分比即开始升高,并随作用时间延长而升高,48 h达到峰值,与control组差异均具有统计学意义(P<0.05);S期及G2期百分比随作用时间延长而降低(P<0.05).
表7 淫羊藿素作用同步化后C13*细胞株各周期时相百分比
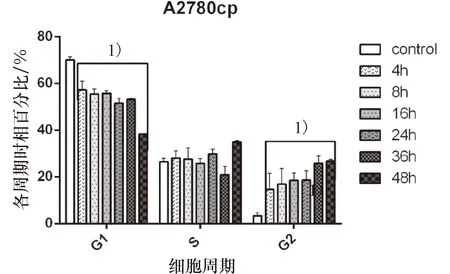
(2)淫羊藿素在最低有效抑制浓度20 μmol/L下对耐药性卵巢癌A2780cp细胞株分别作用4、8、16、24、36及48 h各周期时相分布情况见表8及图5.淫羊藿素作用细胞4 h起G2期百分比即开始升高,并随作用时间延长而升高,48 h达到峰值,与control组差异均具有统计学意义(P<0.05);G1期百分比随作用时间延长而降低(P<0.05).
1)与control组相比,P<0.05
表8 淫羊藿素作用同步化A2780cp细胞株各周期时相百分比
(3)淫羊藿素在最低有效抑制浓度20 μmol/L下对耐药性卵巢癌SKOV3细胞株分别作用4、8、16、24、36及48 h各周期时相分布情况见表9,图6.淫羊藿素作用细胞4 h起G2期百分比即开始升高,并随作用时间延长而升高,48 h达到峰值,与control组差异均具有统计学意义(P<0.05);G1期百分比随作用时间延长而降低,差异具有统计学意义(P<0.05).
2.3 淫羊霍素对顺铂耐药性卵巢癌细胞株CyclinE及CyclinB1蛋白表达的影响
Western-blot检测经过不同时间淫羊藿素处理后,C13*、A2780cp、SKOV3细胞株的CyclinE及CyclinB1蛋白表达水平变化,采用ImageJ软件测量各组条带灰度值,并以目标蛋白与对应内参蛋白灰度比值进行归一化校正,结果如下.
1)与control组相比,P<0.05
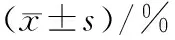
表9 淫羊藿素作用同步化SKOV3细胞株各周期时相百分比
1)与control组相比,P<0.05
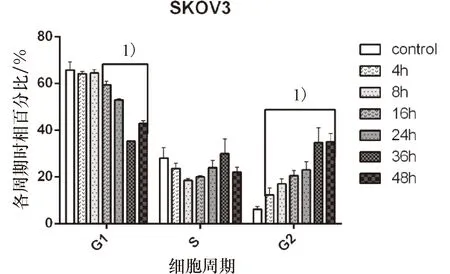
(1)淫羊藿素作用C13*细胞株能够显著降低Cyclin E蛋白的表达水平,4、8、12及24 h与control组相比差异有统计学意义(P<0.05);另外,随作用时间延长下调效果呈下降趋势,但各组间差异无统计学意义(P>0.05);Cyclin B1蛋白的表达水平各组间无明显差异(P>0.05,图7).
1)与control组相比,P<0.05
(2)淫羊藿素作用A2780cp细胞株能够显著降低Cyclin B1蛋白的表达水平,4、8、12及24 h与control组相比差异有统计学意义(P<0.05);另外,随作用时间延长下调效果呈下降趋势,各组间差异具有统计学意义(P<0.05),Cyclin E蛋白的表达水平各组间无明显差异(P>0.05,图8).
(3)淫羊藿素作用SKOV3细胞株能够显著降低Cyclin B1蛋白的表达水平,8、12及24 h与control组相比差异有统计学意义(P<0.05);随作用时间延长下调效果呈下降趋势,而组间差异无统计学意义(P>0.05);Cyclin E蛋白的表达水平各组间无明显统计学差异(P>0.05,图9).
2.4 淫羊霍素对顺铂耐药性卵巢癌细胞株p53及CHK1蛋白表达的影响
Western-blot检测经过24 h浓度为20 μmol/L淫羊藿素处理后,C13*、A2780cp、SKOV3细胞株p53及CHK1蛋白表达水平均变化.淫羊藿素能够上调C13*细胞株p53及CHK1蛋白表达,对于A2780cp、SKOV3细胞株仅能上调CHK1表达,与未经淫羊藿素处理组差异具有统计学意义(P<0.05,图10).
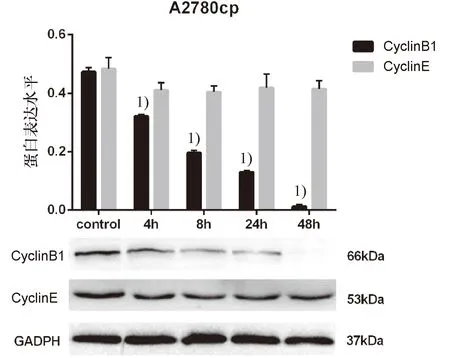
1)与control组相比,P<0.05

1)与control组相比,P<0.05
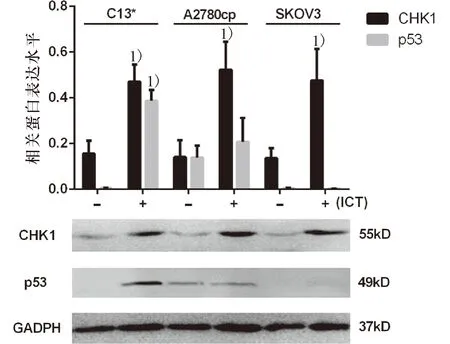
1)与control组相比,P<0.05
3 讨论
卵巢癌是致命的妇科恶性肿瘤.手术和化学疗法是卵巢癌的主要治疗方法[3].铂类化合物是治疗卵巢癌的一线化疗药物,但绝大多数患者治疗后会复发并对其产生耐药性[4].
化疗耐药的发生机制多样,包括肿瘤药物运输率降低、DNA修复效应增强以及机体对DNA损伤耐受等[5].药物毒性产生的DNA损伤在p53突变或缺失的细胞中不能经过p53途径诱导细胞发生周期阻滞及凋亡,是化疗耐药产生的最常见原因.突变p53能够与p63、p73、SP-1等蛋白结合,促进癌细胞的侵袭及转移[6].此外,突变型p53也可以激活SREBP,NF-Y,VDR,ETS2或NRF2等蛋白功能,促进活性氧的积累及癌细胞的无限增殖[7-8].突变p53还能诱导细胞进行程序性重排和扩增,分化成具有无限分裂能力的多能干细胞,促进恶性肿瘤形成[9-10].
Stevens等[11]研究发现,黄酮类的化合物能够引起多种细胞发生细胞周期阻滞.Huang等[12]认为淫羊藿素能够通过上调pRb、p27Kip1和p16Ink4a,下调磷酸化的pRb、Cyclin D1、CDK4等蛋白的表达引起胰腺癌PC-3细胞株发生G1期阻滞以及剂量依赖性的G2/M阻滞.
从同步化后的细胞各周期比例结果来看,3株细胞的各期峰值均表现为G1期最高,S期较低,G2期最低.分析其原因可能是G1期时长最长,S期较短,G2期最短,收集细胞的间隔时间固定为每4 h一次,因而时间跨度较大的G1期获取峰值的几率最高,而较短的S及G2期的收集时间点可能刚好错过对应的峰值出现时间点.另外,同步化处理在细胞进入指数增长期后方可进行,此时的细胞密度已经接近40%~50%,而整个同步化培养时间较长,接近1.5个细胞倍增时长,在同步化处理的后期细胞密度较大,培养液中的营养物质可能只够维持正常细胞的生长,限制了DNA复制及细胞分裂的进行,因而S期及G2期峰值较低,在实验过程中,本小组尝试在同步化过程中给予足量的培养液,在一定程度上提高了S及G2期的峰值水平.此外,不排除部分细胞在TdR阻滞解除后周期运转未能恢复,仍停滞在G1/S的边界处,导致G1的峰值增高.
本研究结果提示,淫羊藿素能够诱导顺铂耐药卵巢癌细胞发生周期阻滞,阻滞类型与p53分型有一定相关性.其中,p53野生型C13*细胞株发生G1期阻滞(表7,图4),p53变异型A2780cp细胞株(表8,图5)及p53缺失型SKOV3细胞株(表9,图6)发生G2期阻滞,周期阻滞效果具有明显的时间依赖性.
DNA损伤可通过激活细胞周期G1/S及G2/M两个检查点来对周期阻滞进行调控[13].相关研究发现,野生型p53主要对G1/S检查点发挥调控作用,而对G2/M检查点也能够发挥一定的调控作用[14-15].p53介导的细胞周期阻滞通路下游的调控蛋白主要包括周期蛋白(Cyclins)、周期蛋白依赖性激酶(CDKs)、周期蛋白依赖性激酶抑制因子(CKI).Cyclin E及Cyclin B1蛋白分别是细胞周期的关键调控蛋白,分别担任着G1/S期及G2/M关卡检测点的作用,其表达水平的降低直接会导致细胞难以越过关卡,发生周期阻滞现象,进而抑制细胞增殖[16].
为了解淫羊藿素对周期调控蛋白的影响与p53、周期阻滞及凋亡之间的关系,本文检测G1/S及G2/M关卡调控蛋白CyclinE、CyclinB1的蛋白表达水平,进一步探讨淫羊藿素介导不同p53分型顺铂耐药卵巢癌细胞发生周期阻滞所依赖的调控途径.Western blot实验数据显示,淫羊藿素能够促进p53野生型C13*细胞株p53蛋白激活,并伴随CyclinE蛋白表达下调(P<0.05),提示淫羊藿素可以通过下调CyclinE蛋白使得p53野生型顺铂耐药卵巢癌细胞DNA复制无法通过G1/S关卡,发生G1期的周期阻滞.Du[1]等研究发现,野生型p53卵巢癌细胞能够通过p53途径介导细胞发生G1期阻滞,而p53缺失型的卵巢癌细胞则还可以通过CHK1途径介导细胞发生G2期阻滞.本研究发现,p53变异型A2780cp及p53缺失型SKOV3细胞株的p53并无明显激活(P>0.05),反而出现CHK1蛋白表达增强,并伴随CyclinB1蛋白下调现象(P<0.05).由此推测,p53变异及缺失型顺铂耐药卵巢癌细胞可通过CHK1途径下调CyclinB1将细胞阻断在G2/M关卡,发生G2期周期阻滞,与流式细胞技术的检测结果一致.
综上,淫羊藿素对于不同p53分型的耐药卵巢癌细胞均能通过不同途径发挥周期阻滞作用,融合其作为补益中药在提高免疫力方面的优势,可以为临床上复发性耐药卵巢癌的治疗提供新思路.
