猪伪狂犬病病毒山西株的分离鉴定及遗传变异分析
2021-05-24牛志红任建乐王喜珍张卫兵赵宇军宁官保田文霞
牛志红,任建乐,王喜珍,张卫兵,张 鼎,赵宇军,宁官保,田文霞
(山西农业大学动物医学学院,山西太谷030801)
伪狂犬病(Pseudorabies,PR)是由伪狂犬病病毒(Pseudorabies virus,PRV)引起的多种家畜及野生动物共患的以奇痒、化脓性脑炎等神经症状为主的急性接触性传染病[1]。PRV 为疱疹病毒科、α- 疱疹病毒亚科、水痘病毒属的病毒成员[2-3]。该病毒可引起母猪流产、产木乃伊胎、仔猪死亡等临床症状,给养猪业造成了严重的经济损失[4]。
自20 世纪70 年代末,我国引进匈牙利Bartha-K61 疫苗,并开始在猪场进行免疫,利用通过使用标记疫苗和各自的配套诊断性检测区分感染与疫苗接种动物DIVA 策略,使我国的猪伪狂犬病疫情逐步得到控制[5-6],但从2011 年开始多个免疫Bartha-K61 疫苗的猪群相继暴发由PRV 变异株引起的PR,随后从河南、河北、山东等地蔓延至全国[3],并且PRV 变异株可引起人的呼吸功能障碍和脑炎等症状,成为潜在的人畜共患病原[7]。有研究表明,PRV 变异株基因组呈现较大的变异,对不同日龄的猪均有较强的致病性,其中,gE的变异在一定程度上可导致PRV 变异株致病力增强[8];变异株gC的变异是引起Bartha-K61 血清中和能力降低的关键因子,并且gB、gC和gD变异均可导致Bartha-K61为宿主提供免疫保护能力下降[9-10]。另外,自2019 年以来多份最新研究发现,PRV 发生了新的重组变异,PRV 变异株可与Bartha-K61 的gB和gC基因产生重组,形成新的重组变异株,可致病毒的致病性发生相应的改变,并且新的重组变异将可能加速PRV 在不同物种间的传播[11-13]。
为调查山西省猪伪狂犬病病毒流行及其变异情况,本研究对2019 年采集的山西省部分规模猪场的4 346 份猪血清及964 份猪疑似病料进行血清学gB及gE抗体及病原学检测分析,并对PRV分离株的gC和gE基因进行遗传变异分析,以期为山西省PRV 的防控和净化提供相关理论依据。
1 材料和方法
1.1 材料
非洲绿猴肾细胞(Vero-E6)由中国科学院微生物研究所馈赠;SX1801 和SX802 毒株均为山西农业大学生物制品实验室保存。
1.2 试剂与仪器
gB-ELISA 检测试剂盒、gE-ELISA 检测试剂盒,均购自美国爱德士(IDEXX)公司;病毒DNA/RNA提取试剂盒,购自天根生化有限科技公司;猪伪狂犬病病毒实时荧光PCR 试剂盒,购自湖南国测生物科技有限公司;DMEM、FBS,购自赛默飞世尔科技有限公司;FITC 标记的羊抗鼠IgG、胰蛋白酶-EDTA 消化液、青霉素- 链霉素- 两性霉素混合液、去离子水,均购自索莱宝科技有限公司;PreMix Taq 酶,购自大连宝日生物技术有限公司。
QuantStudio6 实时荧光定量PCR 仪,购自美国ABI 公司;徕卡倒置显微镜,购自德国徕卡公司;PCR 扩增仪,购自德国Eppendorf 公司;DYY-8C 型电泳仪,购自北京市六一仪器厂;SYNGENE 全自动凝胶成像分析仪,购自美国SYNGENE 公司。
1.3 方法
1.3.1 样本的采集与处理 2019 年1—12 月在山西省6 个gE基因缺失苗免疫猪场,采集不同生长阶段的健康猪新鲜血清,共4 346 份,置于-20 ℃备用。采集猪场疑似病猪的全血、脐带、淋巴结、脑及胎儿胎衣等组织,共964 份,一部分加入液氮碾磨成组织粉末用于qPCR 检测,剩余部分置于-80 ℃保存。
1.3.2 血清及病原检测 利用PRVgE-ELISA、PRVgB-ELISA 抗体试剂盒对采集的血清样本进行gE、gB抗体检测,具体操作和判定根据说明书进行。采用病毒DNA/RNA 提取试剂盒对组织样品进行PRV 基因组提取,然后使用猪伪狂犬病毒实时荧光PCR 试剂盒进行qPCR,具体操作及结果判定根据说明书进行。
1.3.3 引物的设计与合成 参考Ea 株(GenBank登录号KU315430.1)基因序列,利用Primer 5.0 软件设计特异性并合成针对gC和gE的特异性引物(表1)。引物由武汉天一辉远生物科技有限公司合成。
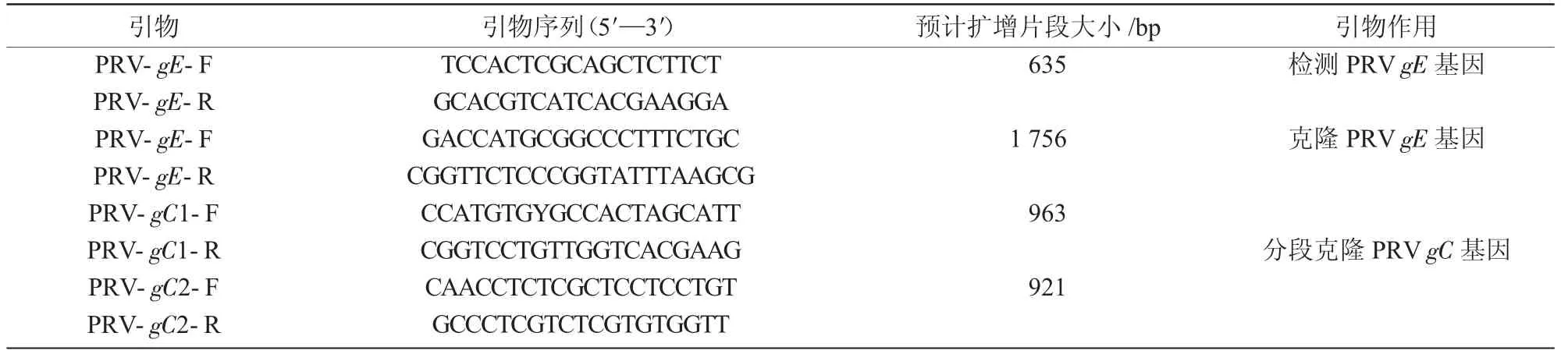
表1 PRV 引物序列
1.3.4 病毒基因组的提取及PCR 鉴定 取50 mg阳性病料反复冻融3 次,置于组织碾磨器中碾成匀浆液,取200 μL 匀浆液按照病毒基因组DNA/RNA提取试剂盒说明书提取DNA。利用gE检测引物进行PCR 扩增,1%琼脂糖凝胶电泳检测PCR 产物,阳性PCR 产物送至武汉天一辉远生物科技有限公司进行测序鉴定。
1.3.5 病毒分离培养 将PCR 鉴定为阳性的组织匀浆液离心取上清,0.22 μL 滤器过滤除菌后,取500 μL 接种于单层Vero 细胞,同时设置正常细胞对照,置于37 ℃、5%CO2培养箱吸附1 h 后,弃上清加入含2%胎牛血清的DMEM细胞维持液,每日观察细胞,待细胞出现明显的细胞病变效应(CPE),且细胞病变达到80%时,收取病液,若无病变则继续盲传,持续盲传3 代无病变则视为阴性。
1.3.6 病毒IFA 鉴定 将病毒分离株接种单层Vero 细胞,同时设置阳性对照(SX1801 与SX1802)及正常细胞对照,感染36 h 出现明显的CPE 时,弃上清,PBS 洗涤3 次,以预冷的无水乙醇4 ℃固定30 min,弃上清,PBS 洗涤3 次,以抗PRV 的gB鼠源单克隆抗体(1∶2 000)为一抗,37 ℃孵育1 h,PBS 洗涤3 次;以FITC 标记的羊抗鼠IgG(1∶200)为二抗,37 ℃孵育1 h,PBS 洗涤3 次,于倒置荧光显微镜下观察结果。
1.3.7 PRV 分离株gC、gE基因遗传变异分析 提取病毒DNA,利用表1 中的gC、gE基因克隆引物进行PCR 扩增,将PCR 产物送至武汉天一辉远生物科技有限公司进行测序,利用生物学分析软件DNAStar 7.1、MEGA 5.0 将分离株与近年来山西农业大学动物医学学院生物制品实验室分离鉴定(SX1801 与SX1802) 的及GenBank 中已登录的PRV 参考毒株gC和gE核苷酸和氨基酸序列进行比对,分析分离株的序列特征。
2 结果与分析
2.1 血清学及病原学检测

表2 血清学检测结果
将2019 年收集的山西省6 个不同猪场免疫猪群的血清,进行伪狂犬gE、gB抗体检测。检测结果表明(表2),临汾市A 猪场、朔州市A 猪场、朔州市B猪场、汾阳市A 猪场、吕梁市A 猪场、吕梁市B 猪场gE阳性率分别为0、0、18.2%、6.3%、3.5%、39.5%;gB阳性率分别为100%、95.6%、98.5%、95.5%、98.5%、97.6%。此次调查共检测血清样品4 346 份,其中,PRVgE抗体阳性率为11.3%,gB阳性率平均为97.6%,有4 个猪场为PRVgE抗体阳性猪场。
2019 年随机收集山西省4 个不同猪场的部分免疫猪群的全血、胎儿胎衣、脐带、淋巴结、脑等器官组织,共964 份样本,经qPCR 扩增检测显示(表3),仅朔州市B 猪场发现2 例PRV 感染病例,猪场病原检出率为1.79%。其中,汾阳市A 猪场、吕梁市A 猪场、吕梁市B 猪场阳性病例个数均为0。综合血清学和病原学结果显示,尽管个别猪场中的gE抗体阳性率较高,但猪场的病原检出率较低,总体病原检出率仅为0.21%。
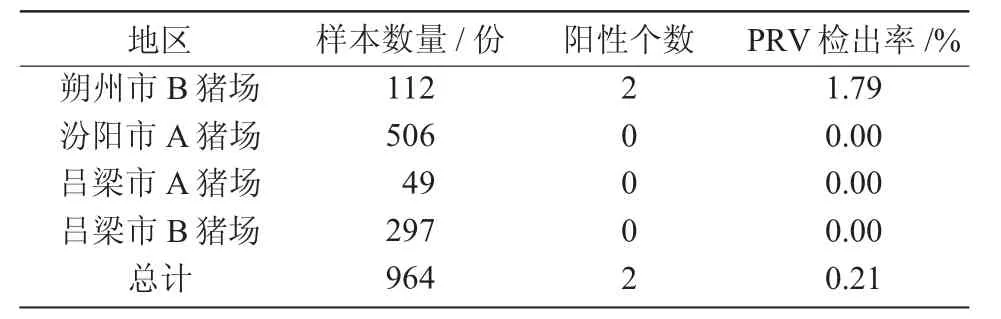
表3 qPCR 检测结果
2.2 组织病料PCR 扩增
将qPCR 检测为PRV 阳性的2 份组织病料研磨后,提取病毒基因组,利用gE检测引物进行PCR扩增。由图1 可知,PCR 扩增产物经琼脂糖凝胶电泳后条带单一,大小为635 bp,与预期结果一致。
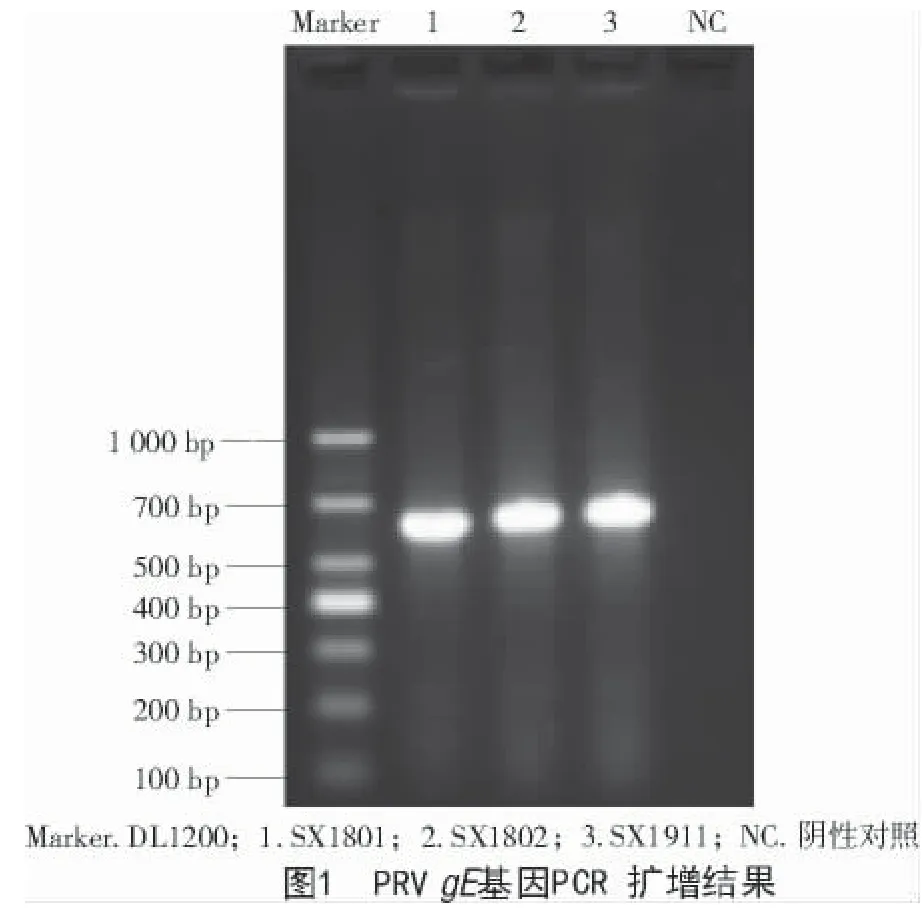
2.3 PRV 的分离及IFA 鉴定
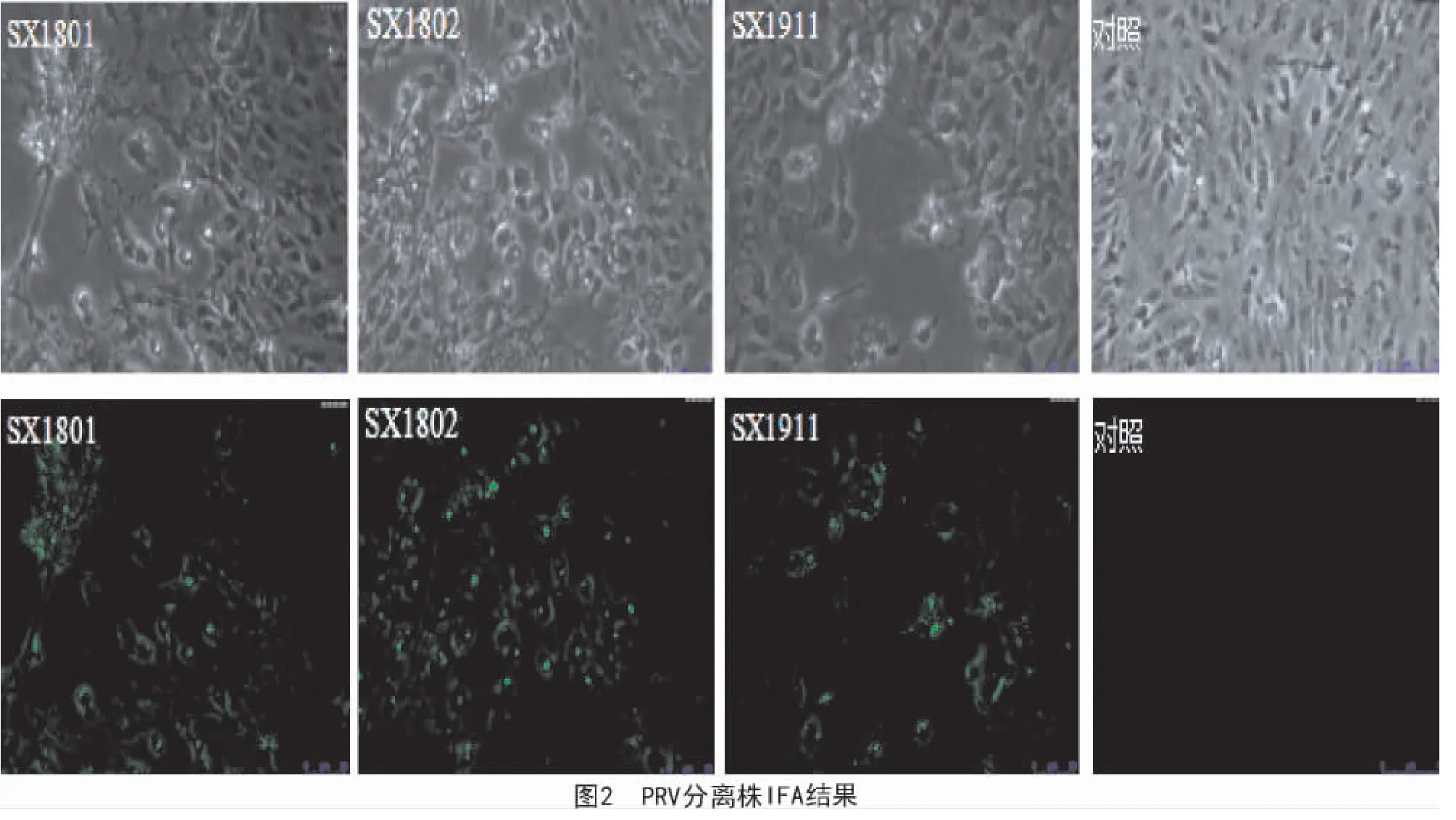
将2 份PRV 阳性组织的匀浆液过滤除菌后,分别接种于单层Vero 细胞,48 h 后,其中1 份阳性样品可致Vero 细胞产生固缩、变圆和脱落等疑似PRV的CPE 现象,并将该分离毒株命名为SX1911。以PRVgB单克隆抗体为一抗,FITC 标记的羊抗鼠IgG 为二抗,对分离病毒株进行IFA 鉴定,结果显示(图2),分离株SX1911 与阳性对照组(2018 年分离株SX1801与SX1802)IFA 检测均出现特异性绿色荧光。
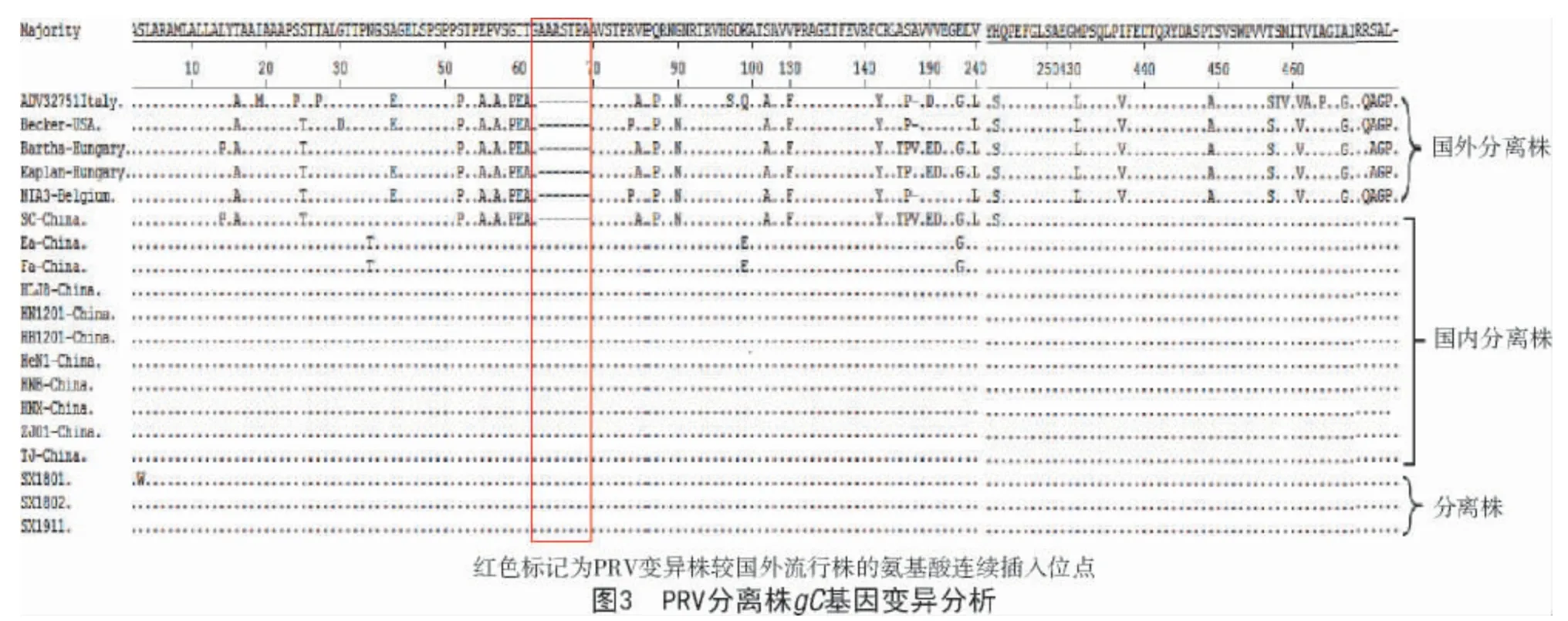
2.4 PRV 分离株gC 基因遗传变异分析
PCR 扩增分离株SX1911gE、gC全基因测序和拼接后分别得到1 740、1 464 bp 的完整的开放阅读框。通过3 株山西PRV 分离株(SX1911、SX1801 和SX1802)的gC全长基因核苷酸及氨基酸序列与GenBank 登录的17 株PRV 参考株同源性分析显示(表4),3 株PRV 分离株与国外毒株(Kaplan、Becker 等毒株) 核苷酸和氨基酸相似性分别为94.9%~96.3%和90.4%~93.9%;与国内经典株(SC、Ea 等)核苷酸与氨基酸相似性分别为96.8%~99.7%和94.3%~99.2%;与国内2011 年以后分离的毒株核苷酸与氨基酸相似性均为99.8%~100%;分离株间的核苷酸与氨基酸相似性分别为99.9%~100%和99.8%~100%。

表4 核苷酸和氨基酸的相似性分析 %
针对3 株PRV 变异株gC氨基酸序列进行分析表明,相较于国外流行株(Kaplan、Bartha 等),绝大部分PRV 变异株存在多个变异位点:在63—69 位氨基酸连续插入AASTPA7 个氨基酸,在43位点E→A(除Bartha 株外),在431 位点L→M,在130437 位点F→V,在449 位点V→A,在457 位点S→T,在461 位点V→T,在467 位点G→A,在142 位点Y→C,在190、191 位点均发生2 个氨基酸位点变异ED→VV(除Becker 和ADV32711Italy 株外),在243 位点S→H,在485—487 位点AGP→SAL。3 株山西PRV 分离株除SX1801 在3 位点发生一个氨基酸位点突变S→W 外,其他氨基酸变异位点均与国内早期分离的变异株相同(图3)。
基于gC基因进行遗传演化分析结果表明(图4),国外毒株Becker、NAI3 等毒株属于基因Ⅰ型,国内PRV 毒株为基因Ⅱ型。基因Ⅱ型病毒形成2 个独立的亚分支,其中,国内变异株为一个单独的亚分支,而国内经典毒株分别形成不同独立的亚分支。经典毒株Fa、Ea 等毒株与变异株亲缘关系近,而SC 株与变异株亲缘关系较远。本试验研究的3 株PRV分离株与2011 年以后分离的PRV 国内变异株位于基因Ⅱ型的同一亚分支,且高度同源。

2.5 PRV 分离株gE 基因遗传变异分析
针对SX1911、SX1801 和SX1802 株的gE全长基因核苷酸及氨基酸序列与GenBank 登录的16 株PRV 参考株进行了同源性分析。结果显示(表4),3 株山西PRV 分离株与国外毒株(Becker、Kaplan等毒株)核苷酸和氨基酸同源性分别为97.9%~98.2%和94.5%~95.0%;与国内经典株(SC、Ea 等)核苷酸同源性均为99.7%,氨基酸同源性为98.4%~98.6%;与国内2011 年以后分离的毒株核苷酸与氨基酸同源性分别为99.8%~100%和98.4%~99.8%;分离株之间的核苷酸与氨基酸同源性分别为99.9%~100%和99.7%~99.8%。
基于gE蛋白氨基酸序列比对显示,与国外毒株相比,国内PRV 分离株gE基因均存在17 个氨基酸突变位点。除此之外,与经典株相比,国内PRV 变异株在55 氨基酸位点均存在突变位点D→G,在497 氨基酸位点插入一个天冬氨酸。与国内外经典株相比,变异株(除TJ 外)均在449 氨基酸位点发生突变:V→I,与此同时,大多数变异株(除HLJB、TJ、SX1911 外)在511 氨基酸位点也发生突变:G→S(图5)。

gE基因遗传演化与gC相一致,如图6所示,国内PRV 毒株与国外毒株处于2 个不同的分支,国外PRV 毒株属于基因Ⅰ型,国内PRV 毒株属于基因Ⅱ型。国内分离株具有共同的起源,但Ea、Fa、SC 等经典株毒株处于基因Ⅱ型的一个亚分支,2011 年以后的PRV 分离株位于基因Ⅱ型的另一个亚分支,说明国内流行的变异株亲缘性较近。本试验研究的3 株PRV 分离株与国内流行株HB1201等分离株处于同一亚分支,同源性较高。

3 结论与讨论
自2011 年以来,PRV 变异株给我国的养猪业造成了巨大的经济损失,由于PRV 变异株的致病机制尚未完全明确,并且疫苗Bartha-K61 不能提供完全的免疫保护,但目前通过DIVA 策略仍是防控和净化PRV 感染的重要措施。因此,本研究通过对山西省部分地区PRV 流行及变异情况分析发现,山西部分规模猪场仍存在PRV 野毒感染,并且呈现不同程度的gE抗体阳性;成功分离到1 株PRV 变异株,命名为SX1911;遗传变异分析表明,分离株SX1911 与实验室已保存毒株均属于变异毒株。该研究可为山西省的PRV 流行情况及疫病防控提供相关科学依据。
猪伪狂犬病在山西省部分地区仍广泛流行。2019 年对山西省部分地区的免疫猪场所采血清样品进行了血清学检测。结果表明,PRV 感染猪场的阳性率高达66.67%,大部分猪场血清样品gE抗体阳性率在3.5%~39.5%,但仍有部分gE抗体阴性猪场存在,推测规模化猪场之间的防控措施以及生产管理水平的不同可能是影响PRV 感染率差异的原因之一。宁慧波等[14]通过对2019 年山西地区猪伪狂犬病的gE抗体调查结果显示,感染猪场阳性率达71.43%,血清样品gE阳性率达到52.16%,略高于河北和内蒙古,但低于北京。与此同时,陈驰等[15]研究发现,2018—2019 年江苏、河南和江西3 个省猪场gE阳性率达到71.7%~88.24%,且样品gE抗体阳性率分别为38.44%、63.28%和30.48%。由此表明,目前山西省部分地区猪场PRV 感染情况与全国水平大致相同,仍然广泛流行。本研究在所采样猪场中的血清学结果显示,PRVgE抗体阳性率较高,但qPCR 仅检出2 例阳性病例,其原因可能与组织样本容量和种类较少,或病毒转为潜伏感染有关。已有研究发现,部分猪场虽然受到PRV 变异毒株的感染,但无明显的临床症状,表现为种猪群gE抗体转阳或阳性率升高[16];同时PRV 野毒的检出率跟采样季节有关系,殷鑫欢等[17]研究发现,PRV的检出率在夏季(1.5%)和秋季(1.6%)明显比春季(9.1%)和秋季(33.0%)低。这些数据表明,目前山西及国内其他省份仍然面临着严峻的猪伪狂犬病防控压力,因此,猪场应适度优化免疫程序,降低猪伪狂犬病的临床发病率,加强生物安全措施,防止病毒的传入和传播,逐步净化猪伪狂犬病[18]。
山西PRV 流行毒株仍为变异株。本研究针对新分离毒株SX1911 与山西农业大学生物制品实验室已保存的SX1801 和SX1802 的gC和gE基因遗传变异分析发现,3 个毒株均与目前国内流行的毒株一致,位于基因Ⅱ型的同一个亚分支,属于变异株。进一步序列比对发现,相比于欧美毒株,3 个毒株的gC在第63 位点存在1 个AAASTPA 连续7 个氨基酸插入,这个位点的插入均与目前国内流行的毒株相一致。PRV 糖蛋白gC是能够诱导机体产生中和抗体的重要免疫原,并且已有研究证明,gC变异是引起抗Bartha-K61 血清中和变异株的关键因素[10];进一步分析发现,gC的变异主要存在于N 端的13-243 aa,其N 端存在介导PRV 与靶细胞的吸附的肝素结合域(heparin-bindingdomains,HBDs)[19],因此,gC的变异可能影响PRV 与靶细胞的吸附能力。最新研究表明,目前多株已分离的PRV 毒株基因发现重组变异,其中,变异株可与疫苗株Bartha-K61 的gC基因发生重组[11],但是在本研究中并未发现重组,SX1911、SX1801 和SX1802 这3 株病毒的其他基因是否能够产生重组变异,需要全基因测序进一步分析。gE是决定PRV 的毒力的因子之一,且gE变异可部分增强变异株的致病性。本研究发现,与国外株相比,所有国内分离株均具有17 个氨基酸突变位点,与孙颖等[20]的研究结果一致;所有变异株gE在48 和497 氨基酸位点均插入一个天冬氨酸;赵鸿远等[21]研究认为,该突变可作为PRV 变异株诊断的分子特征。除此之外,大部分变异株还有个别氨基酸位点突变,这些变异可能是PRV 逐步进化形成独立亚分支的原因。
本次流行病学调查反映了山西省部分地区PRV 流行情况,结果表明,PRV 仍然在山西省广泛流行,流行毒株为变异株;血清学结果显示,疫苗免疫后可产生高水平抗体,但仍可被PRV 野毒感染,提示应从当前PRV 流行变异株中选取合适的毒株研发疫苗,同时优化管理程序为净化PRV 提供高效防控措施。
