陆地棉转录因子GhAHL4 基因的克隆及表达分析
2021-05-24刘萌萌韩立军刘宝玲薛金爱李润植
刘萌萌,韩立军,刘宝玲,薛金爱,李润植
(山西农业大学分子农业与生物能源研究所,山西太谷030801)
转录因子(Transcription factors)通过与真核生物基因启动子区顺式作用元件相互作用激活或者抑制相关基因的表达,从而调控植物生长发育。其本质上是一种蛋白质,由4 个部分组成,包括DNA结合区、转录调控区、核定位信号区以及寡聚化位点[1]。含有AT-hook 基序的AHL(AT-Hook Motif Nuclear Localized)转录因子最初是在哺乳动物非组蛋白的染色体高移动群蛋白HMG-I/Y 中发现的[2],现已在多种植物中的DNA 结合蛋白中鉴定到同源序列。植物AHL 蛋白家族成员含有1 个或2 个AT-hook 基序及PPC/DUF296 保守结构域,能改变染色质结构并调节基因表达[3]。其中,AT-hook 基序以精氨酸- 甘氨酸- 精氨酸- 脯氨酸(RGRP)为保守残基[4],是一种新的DNA 结合蛋白基序与DNA发生特异性识别[5-6],而PPC 结构域在AHL 蛋白的细胞核定位中发挥重要作用[7]。AHL 蛋白既可以彼此之间,也可以与其他转录因子相互作用共同调节植物新陈代谢[8]。
有研究发现,拟南芥和水稻2 个模式植物中AHL基因家族主要参与调控植物开花、根系活力及其生长发育以及下胚轴的伸长生长等形态建成过程,如拟南芥中超表达AHL27基因[9],可抑制开花基因FT的表达,同时促进FLC 的表达,进而延迟拟南芥在长日和短日条件下的开花时间;在种子萌发过程中,AtAHL4基因表达抑制编码TAG 脂酶和β- 氧化相关基因SDP1、DALL5、KAT5的表达,从而调控植物体内TAG 的降解[10];AtAHL18通过调节根尖分生组织的活动、侧根的起始和出苗来参与根系结构的调节[11];AtAHL27/29基因能够抑制光照下幼苗的下胚轴伸长[12]。此外,AHL 在植物非生物胁迫反应中发挥着重要的作用。例如,水稻OsAHL1基因的过表达可显著提高水稻的抗旱性[13];玉米全基因组鉴定表明,ZmAHLs主要调节植物的花粉发育、干旱响应、衰老和创伤响应过程[14]。含有AT-hook motif 基序的GhAT1 蛋白,能够特异性结合棉花FSltp4基因的启动子,抑制FSltp4基因的表达,从而使棉纤维的生长受到严重影响[15]。由此可见,不同植物的AHL 及其成员所行使的生物学功能不同,目前仅有少数AHL 蛋白被发现,这个家族的其他成员仍有待进一步研究。
棉花(Gossypium hirsutum)种植规模较大,棉籽油作为棉花生产的副产品,是植物油的来源之一,同时也是制备生物柴油的天然原料。然而,在农业生产中,环境胁迫通常会导致细胞损伤,从而使得棉花的生长和产量受到严重限制[16]。为了适应环境因素的变化,植物自身能够形成一些机制抵御逆境胁迫。在逆境条件下,植物可感知非生物胁迫信号产生防御调控机制以应对外界不良环境。
为进一步解析棉花抵御非生物胁迫的AHL 表达模式,本研究以冀丰1271 棉花品种为材料,克隆陆地棉GhAHL4基因,采用生物信息学工具分析其编码蛋白理化性质,用RT-qPCR 分析该基因在盐胁迫处理下的表达模式,旨在为深入解析棉花GhAHL4基因的生物学功能提供科学参考,并为培育抗非生物胁迫能力强的棉花新品种提供理论依据。
1 材料和方法
1.1 试验材料
陆地棉冀丰1271 种子、大肠杆菌DH5α 菌株、pMD18-T 载体均由山西农业大学分子农业与生物能源研究所提供。供试陆地棉材料于2020 年春种植于山西农业大学农作站试验田。
1.2 陆地棉AHL4 基因克隆
根据已报道的拟南芥AtAHL4基因的蛋白序列,利用BlastP 搜索棉花基因组数据库CottonFGD(https://cottonfgd.org/),筛选棉花AHL4候选同源基因,结合转录组和各种胁迫处理表达谱数据,最终鉴定获得在非生物胁迫中上调表达的GhAHL4基因,并下载其基因序列。
使用Plant Total RNA Kit 提取棉花叶片的总RNA,使用ABM 公司的反转录试剂盒5×All-In-One MasterMix(with AccuRT Genomic DNA Removal Kit)反转录成cDNA,克隆陆地棉GhAHL4基因。以棉花叶片cDNA 为模板,采用天根公司的高保真酶Pfu DNA Polymerase 进行PCR 反应。20 μL 反应体系:10×Pfu Buffer 2 μL、dNTP Mix(2.5 mmol/L)1.6 μL、Pfu DNAPolymerase0.5 μL、上下游引物(表1)各0.5 μL、cDNA 模板2 μL、RNase-free H2O 12.9 μL。PCR 反应程序为:94 ℃预变性5 min;94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸30 s,30 个循环;72 ℃终延伸10 min。PCR 产物经1%琼脂糖凝胶电泳后,割胶回收目的条带,然后连接到pMD18-T 载体上,转化至大肠杆菌DH5α 感受态细胞,筛选阳性克隆后送上海生工有限公司测序。

表1 引物序列
1.3 陆地棉GhAHL4 基因的生物信息学分析
经ProParam(https://web.expasy.org/protparam/)分析陆地棉GhAHL4 编码氨基酸的数目、蛋白的分子质量以及理论等电点、脂肪系数及稳定性等理化性质;利用TMHMM 2.0(http://www.cbs.dtu.dk/services/TMHMM/)和SignalP 3.0(http://www.cbs.dtu.dk/services/SignalP-3.0/)对氨基酸序列进行跨膜及信号肽分析;用在线分析工具LocTree 3(https://rostlab.org/services/loctree3/) 预测亚细胞定位。采用SPOMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=/NPSA/npsa_sopma.html)在线分析软件预测蛋白质二级结构;通过SWISS-MODEL(https://swissmodel.expasy.org/interactive)对GhAHL4 蛋白的三级结构进行同源建模分析;运用在线分析软件Plant CARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)对转录起始位点上游长度为2 000 bp 启动子的序列进行分析,并对顺式作用元件在GSDS 2.0 进行可视化体现;利用基因结构显示系统GSDS 分析GhAHL4 基因外显子、内含子数量,绘制基因结构图;用ClustalX 和GeneDOC 软件进行多序列比对,并分析其保守结构域;基于邻接法(neighbor-joining,NJ)采用MEGA 7.0 构建无根系统发育树。
1.4 陆地棉GhAHL4 基因表达分析
利用CottonFGD(https://cottonfgd.org/)下载陆地棉GhAHL4 的转录组数据,通过构建Heatmap 图综合分析该基因的表达情况。
冀丰1271 号种子脱绒后直接播种于灭菌蛭石中,待幼苗长至2 片真叶时,选取长势一致的幼苗,将根部的蛭石经流水冲洗干净,快速置于吸水纸上吸干,将棉苗的根部浸入200 mmol/L NaCl 溶液中,置于(25±2)℃培养箱,连续光照条件下生长,分别于0、1、3、6、12、24、48、72 h 采集真叶叶片,提取总RNA,反转录合成cDNA,以棉花histone 基因作为内参,使用TaKaRa 公司的TB GreenTMPremix Ex TaqTMⅡ荧光定量PCR 试剂盒进行RT-qPCR。反应总体系为10 μL:TB Green Premix Ex Taq II 5 μL、上下游引物(表1)各0.4 μL、cDNA 模板0.8 μL、RNasefree H2O 3.4 μL。反应程序为:95 ℃5 min;95 ℃5 s,58 ℃30 s,72 ℃30 s,40 个循环。用2-ΔΔCt法进行基因的相对表达量分析[17]。每个样品设置3 个生物学重复。
2 结果与分析
2.1 陆地棉GhAHL4 基因的克隆及其编码蛋白的理化性质分析
根据已报道的拟南芥AtAHL4基因的蛋白序列,利用BlastP 搜索棉花基因组数据库CottonFGD,筛选棉花AHL4同源基因,结果发现,该基因在A亚组、D 亚组均有拷贝,结合转录组和各种胁迫处理表达谱数据,发现只有D 亚组GhAHL4差异表达显著,最终鉴定获得在非生物胁迫中上调表达的GhAHL4基因。以冀丰1271 陆地棉叶片的cDNA为模板,克隆到GhAHL4基因cDNA 全长为984 bp(图1),与基因组所注释的该基因编码序列存在部分碱基差异,但蛋白序列一致。
理化性质分析表明,GhAHL4基因编码327 个氨基酸,理论等电点为9.44,分子质量约33.74 ku,不稳定系数为50.1,脂肪系数为68.56,亲水性系数为-0.353,据此推测,GhAHL4 蛋白为不稳定亲水性蛋白质[18-19]。亚细胞定位预测结果显示,其定位于细胞核中,预测可信度为84,无信号肽和跨膜结构,属于一种非分泌型蛋白。
2.2 陆地棉GhAHL4 基因的结构分析
采用SOPMA 在线预测GhAHL4 的二级结构,结果显示(图2),GhAHL4 蛋白结构以无规则卷曲(Random coil)和延伸链(Extended strand)为主,分别占68.20%和23.85%。通过在线软件SWISS-MODEL对GhAHL4 蛋白的三维结构进行预测分析与同源建模,以2dt4.1.A[8]蛋白(a plant-and prokaryote-conserved(PPC)protein inPyrococcus horikoshii)为模板,该蛋白与棉花GhAHL4 蛋白氨基酸序列相似性为29%,包含3 个GOL 配体(图3)。

利用GSDS 2.0 在线检测GhAHL4基因结构发现,该基因含有5 个外显子、4 个内含子(图4)。
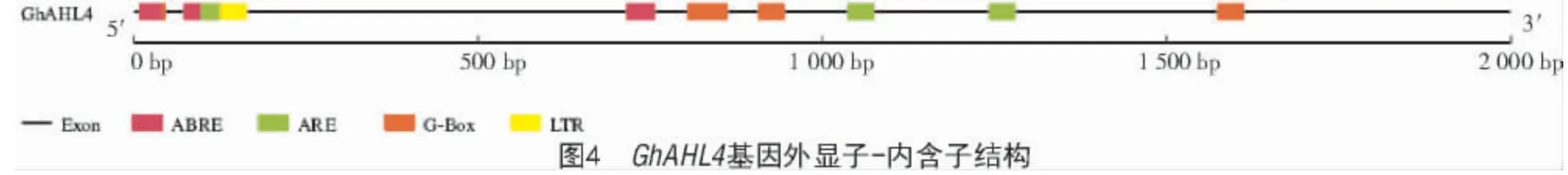
为探究该基因是否可能受逆境胁迫调控,进一步分析GhAHL4基因上游启动子序列,结果显示(图5),GhAHL4基因启动子含有多个参与植物响应非生物胁迫的顺式作用元件,响应脱落酸胁迫的ABRE 元件、响应光反应的G-box 及低温响应元件LTR。

2.3 陆地棉GhAHL4 蛋白的序列比对和进化分析


多序列比对显示,GhAHL4 蛋白与木槿HsAHL4(KAE8694315.1)、榴莲DzAHL4(XP_022719610.1)、蓖麻RcAHL4(XP_002509630.1)、大豆GmAHL4(XP_003525779.1) 的同源蛋白的序列相似性分别为86.54%、84.89%、75.45%和73.09%(图6)。为了明确陆地棉GhAHL4 与其他植物AHL 蛋白的系统发育的关系,利用MEGA 7.0 软件对GhAHL4 和其他植物AHL 蛋白进行序列比对,并构建进化树,进化分析结果表明(图7),GhAHL4 除与亚洲棉GaAHL蛋白外,与木槿HsAHL4(KAE8694315.1)的亲缘关系最近。
2.4 GhAHL4 在不同组织和非生物胁迫下的表达模式分析
陆地棉GhAHL4在不同组织及不同胁迫中的表达情况如图8 所示,该基因在根中表达量最低,在雄蕊中高表达;冷胁迫及干旱胁迫处理3 h 时GhAHL4基因表达量最高,之后随着胁迫时间的延长表达量呈下降趋势,而在盐胁迫条件下该基因的表达量在12 h 内持续升高。

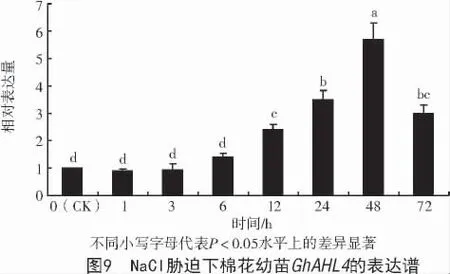
为进一步分析GhAHL4基因在盐胁迫下的表达模式,用200 mmol/L NaCl 胁迫处理2 片真叶的棉花幼苗,探究胁迫处理0、1、3、6、12、24、48、72 h时的GhAHL4差异表达,结果显示,处理0~3 h 棉花GhAHL4基因的表达量没有发生显著变化;在处理6~48 h 时间内,其表达量呈上升趋势,48 h 时表达量最高,约为CK 的6 倍,且二者间差异达显著水平(P<0.05);处理48 h 后,表达量开始下调(图9)。表明棉花GhAHL4基因参与棉花幼苗对盐胁迫的应答。
3 结论与讨论
AHL 蛋白作为一类DNA 结合蛋白,在植物的生长发育过程中起着重要的调控作用。目前,在花生[20]、番茄[21]以及模式植物拟南芥[22-23]和水稻[24]中有关AHL 蛋白的研究较为深入。棉花作为我国重要的经济作物之一,有关其AHL蛋白功能研究鲜见报道。本研究克隆了陆地棉GhAHL4基因,含有5 个外显子和4 个内含子,而大豆GmAHL4基因却不含内含子[25],由此可见,不同AHL基因的结构存在很大的差异。编码蛋白定位于细胞核内,这与前人研究AHL 蛋白大多定位于细胞核的结果基本一致[15],且包含3 个GOL 配体(三羟基糖醇,作为碳水化合物和脂质代谢的中间产物),可能参与脂肪酸生物合成。多序列比对结果显示,陆地棉GhAHL4蛋白存在AT-hook 结构域的保守残基KKKRGRP,这与拟南芥AtAHLs 蛋白结构一致[4],可能通过与下游靶基因的DNA 结合从而参与其表达调控。系统发育分析表明,GhAHL4 蛋白与同科的亚洲棉及木槿聚为一支,因为陆地棉与亚洲棉及木槿同为锦葵科植物,这也与经典植物分类的结论一致。
GhAHL4基因上游启动子包含了与光响应有关的元件G-box、赤霉素应答元件GAREAT、脱落酸应答相关元件ABRE 等,以及低温响应元件LTR,这与毛果杨PtrAHL6、PtrAHL18、PtrAHL24启动子中含有脱落酸响应及低温响应等顺式作用元件结构相似[26]。不同胁迫下基因表达模式进一步表明,GhAHL4可能参与逆境环境胁迫应答。RT-qPCR结果显示,NaCl 胁迫下GhAHL4基因表达量上调,这与丁丽雪等[21]在番茄中发现的部分AHL基因受盐胁迫诱导结果相似,而OsAHL1的过表达增强了对盐胁迫的耐受性[13]。表达量在48 h 内持续升高预示着该基因参与棉花幼苗盐胁迫应答,基因过表达可能增强了棉花对逆境的适应性,因此可作为棉花抗逆机制研究和棉花抗逆遗传改良的候选目的基因。但GhAHL4基因具体如何介导棉花抵御盐胁迫等逆境应答的调控网路还有待进一步论证。
本研究以拟南芥AtAHL4 蛋白序列为参考序列,鉴定得到了棉花GhAHL4基因,通过生物信息学技术分析了基因结构和编码蛋白结构及理化特性,通过RT-qPCR 基因表达分析发现,GhAHL4基因的表达受盐胁迫的诱导,结果为进一步阐明棉花GhAHL4基因的生物学功能以及基因工程育种研究奠定了基础。
