人工合成微生物组的构建与应用
2021-05-22徐昭勇胡海洋许平唐鸿志
徐昭勇,胡海洋,许平,唐鸿志
(上海交通大学生命科学技术学院,微生物代谢国家重点实验室,上海 200240)
随着基因组学和系统生物学的兴起,科学家开始用严格的工程学对细胞的生物行为进行改造与控制,由此衍生出了新的研究领域称为合成生物学[1]。随着合成生物学的快速发展,越来越多的科学家不再局限于将多个基因模块进行组装从而实现特定的生物功能,转而开始对不同的微生物菌株进行整合[2-7],依据相互作用、空间协调、菌群稳定和生物遏制等原则,人工创建可以满足特定需求的稳定的微生物群落,这些群落被称为人工合成微生物组[8-9]。人工合成微生物组的迅速发展,对于理解并操纵天然群落,揭示群落稳定互作的分子机制具有重要意义[10-13]。同时,由于人工合成微生物组可以稳定地执行复杂的任务,该领域的研究也为合成生物学在工业和环境修复方面的应用开拓了新的方向[14]。
1 构建合成微生物组的原则
构建人工合成微生物组有四个关键原则:①相互作用;②空间协调;③菌群稳定;④生物遏制。遵循这四大原则构建的合成微生物组,才能实现高效稳定安全地运行。
1.1 相互作用
自然界的生物之间存在着广泛且多样的相互作用,微生物之间也存在着复杂的互作网络,时刻在进行相互竞争和资源交换[15]。但是不同的菌种间的互作程度和依赖程度不一样,会造成微生物组的表型不同。合理利用菌群的代谢相互作用(例如分配必需营养物质、调整代谢路径等)将有利于使资源的利用率最大化,完成所需要的任务[16-20]。
1.2 空间协调
尽管天然环境中许多微生物之间存在互作关系,但不同的微生物之间存在空间界限,同种类的菌株通常聚集在一起形成一个菌落,而其他菌株则聚集形成其他菌落。在空间上散落分布的不同菌落通常会在系统中产生资源利用率不同的局部亚菌群,从而增强了局部的相互作用,避免全局性的系统崩溃。所以在构建人工微生物组的时候应该考虑到不同微生物之间的空间协调,提高微生物组的环境适应力[21-22]。
1.3 菌群稳定
人工微生物组的工程应用具有一定的挑战性,可能会遇到环境变化以及菌群竞争的挑战,所以在构建时需要考虑人工微生物组在环境中的长期稳定性,制定相应的互作策略来加强各个菌种之间的合作[12,23-26]。另外,微生物的基因可能会发生突变,从而导致功能的丧失,给微生物组的工程应用造成困难,所以设计时应该避免使用突变率较高的基因,并优化代谢路径,使微生物组能够在长时间内维持菌群的功能[19,27-29]。
1.4 生物遏制
如果在开放环境中应用人工微生物组,则需要对微生物组的细胞数量增长进行精准的调控,利用营养缺陷或致死开关确保微生物组的菌群密度和功能处于一个理想的状态[30]。此外,还应该确保工程菌中人工构建的基因不会释放到环境中而造成自然生态系统的破坏,产生意想不到的负面后果,所以需要有特定的机制来降解工程基因线路[31-35]。
2 构建合成微生物组的策略
2.1 营养互补
在构建合成微生物组时,可以通过人为设计菌株之间的营养互补,从而较为方便地实现互养、共生的目的[36-40]。最常见的方法,是通过基因敲除,使不同菌株之间可以交叉提供必需的营养物质。例如,敲除某种氨基酸的合成基因,不同菌株就可以通过交叉提供生命活动所必需的氨基酸来控制菌群组成和生长速率[41-46]。通过调节相关基因的表达与相应氨基酸的产出,可以调节代谢物的交换速率并控制微生物的生长速率和菌株比例[41]。2014 年Church 和Wang 等[45]的研究指出,生物合成成本更高的氨基酸(包括蛋氨酸、赖氨酸、异亮氨酸、精氨酸等)会对个体带来更大的代谢负担。实现这类氨基酸的互补,可以有效减少个体的代谢负担,更有利于菌株之间的交叉供养,支持整个合成微生物组的协同生长。因此,通过高合成成本氨基酸的互补策略构建的微生物组,比通过低合成成本氨基酸的互补策略构建的微生物组,有更强的协同作用。除此以外,通过氨基酸和核苷酸之间的互补(如腺嘌呤和赖氨酸的互补)[47],以及代谢中间产物的互相供给(如乳酸和甲酸的互相供给)来构建人工菌群[48],也被证明可以实现类似的效果,为营养互补的设计策略提供了更加灵活的执行方案。
2.2 代谢途径分割
目前,合成生物学技术已经可以通过单一的底盘细胞实现复杂的生物功能,但是有时仍然会存在效率低下的问题。效率低下的原因非常复杂,涉及到细胞活动的各个方面。部分情况下是由于人工设计的代谢途径负担过重,超过了单一细胞的承载上限,出现了负反馈抑制,导致合成细胞催化效率低下。而如果将其中某些代谢步骤交由另一种兼容性更高的微生物来进行,则可以有效减轻单一菌种的代谢负担,提高最终的转化效率[49-52]。例如2017 年宋浩和元英进教授课题组[49]将一条微生物产电的代谢通路分配到3 种不同的菌株中,由3 株菌共同完成产电功能。最终,单位原料的产电效率提高了55.7%,并且稳定发电的时间更长。除此以外,由于不同菌株之间存在代谢系统的差异,在单一的底盘细胞中整合多宿主来源的代谢元件时,很难实现目标化合物的完全降解至三羧酸循环或产出需要的化合物,往往需要多个菌种或者细菌-真菌的联合微生物组才能完成目标,因此将代谢途径在不同菌株中进行整合是一种构建微生物组有潜力的选择[53-56]。
2.3 解除生长抑制
在微生物应用于实际生产或修复的研究中,菌株出现生长抑制是很常见的现象。例如,某个关键代谢节点成为整条代谢途径中的限速步骤,由于这种限速步骤的反应速度较慢,会导致相应代谢中间产物的积累,从而对整条途径的代谢速率产生影响[55,57]。如果积累的中间代谢产物本身对菌株具有毒性,则随着代谢物浓度的升高对细胞的抑制作用会越来越强,最终导致整体的代谢严重受阻[58-59]。针对这类限速步骤,目前比较常见的解决方案是引入其他对此类中间代谢产物代谢较快的菌株,帮助及时转化中间产物,从而促进整体反应的进行。2003 年Gilbert等[57]针对大肠杆菌SD2(Escherichia coli SD2)降解对硫磷时会积累中间产物对硝基苯酚的问题,通过引入恶臭假单胞菌KT2440 pSB337(Pseudomonas putida KT2440 pSB337),降解对硝基苯酚,从而有效防止其在培养物中的积累,增大反应速率。Muller 等[58]于2019 年的研究发现,在利用脱硫酸盐橡菌(Desulfatiglans anilini)降解苯胺时会产生危害菌株生长的中间代谢产物硫化氢,通过引入消耗硫化物的光养细菌桃红荚硫菌(Thiocapsa roseopersicina)可以去除硫化氢对D.anilini的抑制作用。
2.4 降低突变率
合成微生物组的稳定性除了菌群层面的稳定,还需要考虑基因组层面的稳定,避免经过人工编辑的基因发生突变导致菌群设计功能的丢失[60]。降低突变率有三种方法:第一种是降低表达量,高表达的遗传线路会给菌株带来较大的代谢负荷,造成细胞适应性降低,如果不需要较高的表达水平,使用低拷贝或中等拷贝质粒将有助于稳定性的提高;第二种是避免重复序列,如果遗传线路具有较高的代谢负荷而且在高拷贝质粒上又有重复序列时,重复序列之间的基因容易在对数生长期丢失,因此在设计复杂的遗传线路时,需要在微生物组中适当提高终止子的种类,避免出现重复的序列;第三个是使用诱导型启动子,与非诱导型基因线路相比,诱导型基因线路的代谢负荷更低、更稳定,并且诱导型启动子可以通过微调实现对基因表达的有效控制[61]。
3 构建合成微生物组方法
合成微生物组通常有两种设计方式,分别是“自下而上”的方法和“自上而下”的方法。其中“自下而上”的方法是指通过理性设计,构建微生物之间的人工代谢网络来完成所需的任务;而“自上而下”的方法则是针对所需要执行的生物功能,通过调整筛选条件,获得符合要求的功能菌株[62-64]。在确认了设计方式之后,即可按照上述策略,用改造或筛选得到的功能菌株构建出初始的合成微生物组(图1)。
3.1 “自下而上”的方法
“自下而上”的方法需要明确微生物的代谢路径,对功能基因元件进行筛选和改造,并将其整合到合适的菌株中。菌株可从自然界筛选得到,也可通过对模式微生物进行改造从而得到满足特殊的功能需求的菌株。基因元件可以来自已报道的元件库,也可以自行筛选获取。针对合成微生物组所需要执行的特定生物功能,根据现有的微生物代谢库,查明其代谢通路,明确代谢通路中涉及的基因,在不同宿主中筛选相关的基因元件,整合到合适的底盘微生物中,使其具备相应的功能[65-66]。例如Lorenzo 等[65]于2013 年将E. coli 的乙酸激酶基因(ackA)和耐氧运动发酵单胞菌(Zymomonas mobilis)的丙酮酸脱羧酶基因(pdc)和乙醇脱氢酶II 基因(adhB)敲入P.putida,使其能够无氧降解1,3-二氯-1-丙烯。
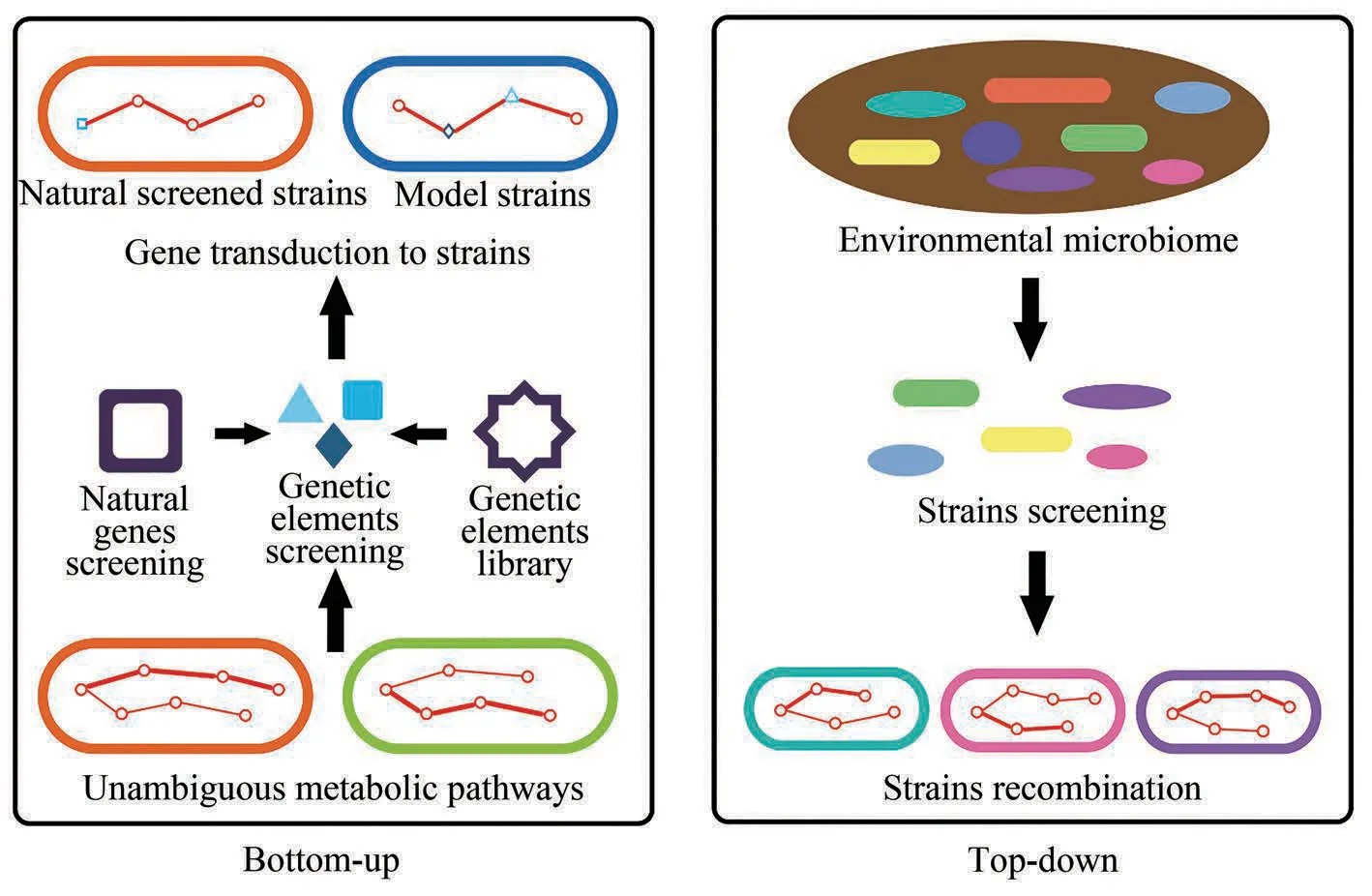
图1 合成微生物组的构建步骤及方法Fig.1 Steps and methods for constructing synthetic microbial consortia
3.2 “自上而下”的方法
“自上而下”的方法相比于前一种方法会更加直接。针对所需要执行的生物功能,可以控制环境条件筛选获得不同的功能菌株,比较这些菌株的代谢能力,依据功能进行分类和组合,最终得到一个最小但能发挥较大作用的微生物组[67-71]。例如,对于纤维素这类非单一性物质,或者其他目前难降解的物质的降解,从自然界直接筛选降解微生物时往往会分离出多种微生物。2018 年Salles等[72]在富集木质纤维素降解菌时,共筛选出18种降解菌株,这些菌株之间存在互作关系,通过微生物的鉴定可以将它们按特性进行重组。最终得到包含5种菌株的最小微生物组,能够有效降解木质纤维素。
4 合成微生物组的应用
4.1 微生物生产
合成微生物组目前已经广泛应用于微生物生产和微生物修复领域[73-74]。在生产领域常见于生物能源、化工产品和药物的生产[75-79]。其中,生物能源包括沼气、氢气等清洁能源,还可以利用合成微生物组直接进行生物发电;化工产品主要用来大量生产异丙醇、异丁醇等;在生物药物的合成领域,利用合成微生物组可以高效合成紫杉醇的前体物质氧化紫杉烷等高价值产品(表1)。
4.1.1 生物能源
生物能源具有可再生、污染小的特点,被认为是绿色能源,是21 世纪能源开发和环境保护的重点研究对象。Calusinska 等[80]于2012 年分别利用4 种单独的纯梭状杆菌菌株(Clostridium ssp.)和由它们共同组成的人工合成的微生物组进行氢气生产,比较它们氢气的产量和生成速率,每种菌株都能够利用葡萄糖和淀粉作为碳源有效产生氢气。结果表明底物消耗量相同时单菌株和微生物组的氢气产量之间没有明显差距,但微生物组产生氢气的速率远远高于纯菌株。同时,微生物组能够完全消耗淀粉而不需任何预处理,但纯菌株丁酸梭菌(Clostridium butyricum)或巴氏梭菌(Clostridium pasteurianum)只能部分消耗淀粉,底物利用不彻底。苏海佳教授课题组[48]于2019年通过营养互补构建了一套能以淀粉为碳源产生氢气的微生物组。首先,蜡样芽孢杆菌A1(Bacillus cereus A1)通过代谢淀粉产生乳酸,而泡囊短波单胞菌B1(Brevundimonas naejangsanensis B1)能利用乳酸作为碳源产生氢气,同时在代谢乳酸的过程中会产生甲酸,甲酸作为电子介体又可以被B.cereus A1利用来加快氢气的产生。
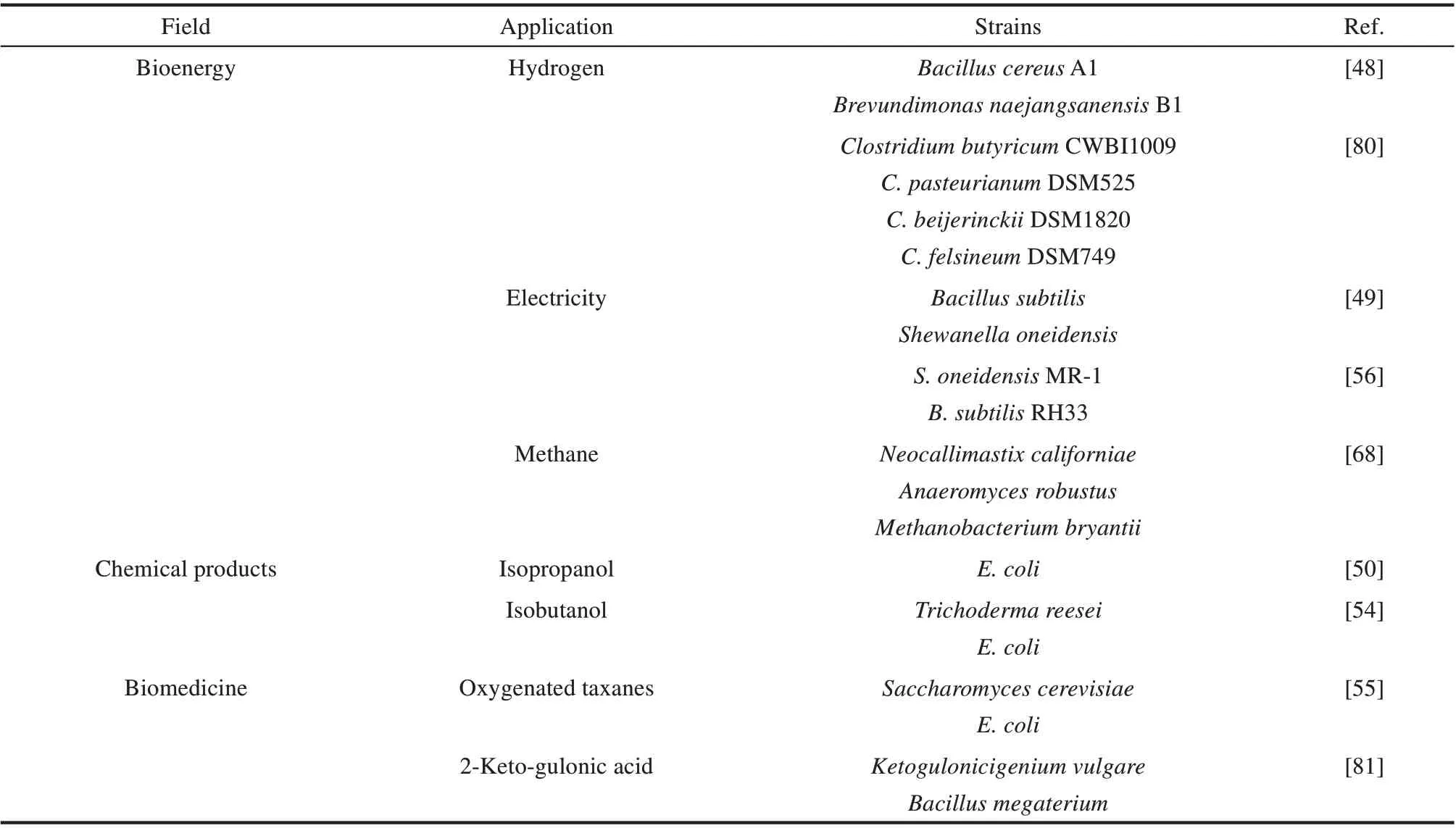
表1 合成微生物组在生物生产方面的应用Tab.1 Applications of synthetic microbial consortia in biosynthesis
Malley 等[68]于2019 年基于“自上而下”的富集方法,筛选得到可以降解木质素的菌株来构建能够产生沼气的微生物组。微生物组的沼气产量比单菌株高出75%~190%,发酵速率高出140%~210%。另外,该研究基于这些菌株采用“自下而上”的方案构建了几种合成的微生物组,将新美鞭 菌(Neocallimastix californiae) 和 厌 氧 鞭 菌(Anaeromyces robustus)与产甲烷菌株反刍甲烷杆菌(Methanobacterium bryantii)相互配对,虽然菌株之间也存在相互作用,但产气速率及底物降解速率并没有得到明显提升,而且稳定性比天然筛选的微生物组更差。
除了生产生物能源以外,利用微生物组直接进行生物发电也逐渐成为研究热点。宋浩和元英进教授课题组[49]于2017 年将E.coli-Lac 进行工程改造,敲除了丙酮酸代谢旁路的pflB基因后能够提高丙酮酸转化为乳酸的量,为发电菌株提供足够的碳源,同时在系统中引入枯草芽孢杆菌(Bacillus subtilis)为发电菌株提供大量核黄素。发电菌株铁还原细菌(Shewanella oneidensis)以乳酸作为碳源并将乳酸氧化为乙酸盐提供电能,可以保证550 mV 电能的稳定输出。同时,产生的乙酸盐可以反过来为E. coli 和B. subtilis 提供营养物质。 Chen 等[56]于2017 年 则 构 建 了 一 个 由S.oneidensis MR-1和B.subtilis RH33组成的合成微生物组进行发电,后者可以为前者提供高浓度的核黄素,大大提高生物发电能力,该微生物燃料电池能够稳定地循环运行500 h以上。
4.1.2 化工产品
异丁醇、异丙醇等需求量大的化工产品除了用传统的物理化学方法提炼,利用微生物发酵生产得到了越来越广泛的应用。Lin 等[54]于2013 年开发了一个合成真菌-细菌菌群,该菌群利用木质纤维素为底物进行生物降解产生异丁醇。首先利用里氏木霉(Trichoderma reesei)产生纤维素酶,将纤维素水解为可溶性寡糖,然后寡糖通过其细胞壁表面的β-葡萄糖苷酶进一步被水解为葡萄糖,最后葡萄糖被E.coli发酵生成异丁醇。研究证明微晶纤维素、膨化氨纤维和预处理过的玉米秸秆均可以以这样的方法直接转化为异丁醇,滴度最高达1.88 g/L,产率最高达理论最大值的62%。
Hanai等[50]于2019年将酶生产菌株和异丙醇生产菌株耦联,生产酶的E.coli在生长过程中产生β-葡萄糖苷酶并逐渐积累,并在外源诱导物异丙基-β-D-硫代半乳糖苷(isopropyl-β-D-thiogalactopyranoside,IPTG)和四环素以及内源信号分子N-酰基高丝氨酸内酯(N-acyl homoserine lactones,AHL)的联合作用下发生裂解,释放出β-葡萄糖苷酶,将环境中的纤维二糖转化为葡萄糖,合成异丙醇的E.coli则利用葡萄糖发酵生产异丙醇。微生物之间的耦联使得每个菌株表达蛋白质的负担和其他代谢负担大大减小,纤维二糖的糖化效率和异丙醇的生产效率得以显著提高。
4.1.3 药物
用生物合成的方法来生产药物,很大程度上解决了一些天然药物产量低的问题,能大幅降低生产成本。目前在工业上已经开始使用人工微生物群落进行维生素C 的前体2-酮古洛糖酸(2-ketogulonic acid,2-KGA)的生产,由普通生酮基古洛酸菌(Ketogulonicigenium vulgare)和巨大芽孢杆菌(Bacillus megaterium)参与完成。元英进教授课题组[81]于2011 年的分析表明,B.megaterium 可以为K.vulgare 提供其生长所必需的物质(如嘌呤核苷酸)合成的前体。此外,生物进行有氧呼吸时会产生反应性氧胁迫(reactive oxygen stress,ROS),产生ROS 的物质如超氧阴离子、过氧化氢和羟基自由基等,可以攻击DNA,导致DNA 链断裂和点突变。而B. megaterium 在芽孢形成过程中为K.vulgare 提供诸如嘌呤等基本成分,能够增强K.vulgare 能量的产生并促进其生长和代谢,帮助其抵抗ROS。
Stephanopoulos 等[55]于2015 年将紫杉醇前体(氧化紫杉烷)的合成途径分为两个模块来生产,分别在E. coli 和酿酒酵母(Saccharomyces cerevisiae)中表达,这两者都不能单独产生氧化紫杉烷。但是通过设计两者之间的互作联系,可以在同一生物反应器中实现二者稳定的共培养:E. coli TaxE1 利用木糖生长产生乙酸盐,为S. cerevisiae TaxS1 的生长提供唯一碳源,同时S.cerevisiae TaxS1 利用E.coli TaxE1 代谢产生的紫杉二烯(taxadiene)合成氧化紫杉烷(oxygenated taxanes)。
4.2 微生物修复
合成微生物组在生物修复领域也有着广泛的应用,目前已经在BTEX[苯(benzene)、甲苯(toluene)、乙苯(ethylbenzene)、二甲苯(xylenes),统称为BTEX]、卤代苯族化合物、塑料等这类难降解、污染大的石油及其衍生产品的降解方面展示出了很好的应用前景[82-85]。而在农业生产领域,微生物组降解农药的潜力也被逐步挖掘出来(表2)。
4.2.1 石油及其衍生产品的降解
石油及其衍生产品极大地促进了现代工业的发展,同时带来了严重的污染。因此,解决石油及其衍生产品(如烷烃、芳香烃、卤代烃、塑料等)所引起的污染,是各国研究者关注的重点。唐鸿志教授课题组[86]于2020 年从被石油污染的土壤中筛选得到能够降解石油的微生物组,由无色杆菌P3(Achromobacter sp. P3)、鞘氨醇单胞菌P10(Sphingobium sp. P10)和根瘤菌P14(Rhizobium sp. P14)组成,并根据最小值算法计算各菌株之间的最优构成比例,按比例与已报道的石油降解微生物组PDM 混合,降解效率提高了34.8%,5天内石油的总降解率达到78.9%。
Nagarajan 等[87]于2014 年基于不同菌株对不同单环芳族化合物进行生物降解的能力,选择了P.putida F1 和斯氏假单胞菌OX1(P.stutzeri OX1)两种菌株来组建合成微生物组。这两种菌株都能以苯和甲苯为底物生长,此外,P. putida F1 和P. stutzeri OX1 还分别表现出对于乙苯和邻二甲苯的降解能力,因此合成的微生物组具备更广谱的BTEX降解能力。
D.anilini可以在完全缺氧的条件下降解有毒的芳香族化合物苯胺,但是,D.anilini降解苯胺会积累中间产物硫化物,而硫化物浓度的增加,会抑制细胞的生长,在20 mmol/L 的硫化物浓度下就能表现出完全抑制的作用。针对这一问题,Mullera等[58]于2019年引入硫化物代谢细菌T.roseopersicina进行共培养。与每天仅消耗0.006 mmol/L 苯胺的D. anilini 菌株纯培养相比,共培养微生物组的苯胺降解速率显著提高到0.016 mmol/(L·d)。
苯族化合物难降解,卤代苯族化合物降解的难度更大。Katayama等[53]于2015年通过构建厌氧菌的微生物组实现了2,4,6-三溴苯酚(2,4,6-tribromophenol,2,4,6-TBP)的矿化。脱卤素杆菌FTH1(Dehalobacter sp.FTH1)具有还原性脱溴的能力,将2,4,6-TBP脱溴转化为苯酚,在这个过程中Clostridium sp. Ma13 通过发酵葡萄糖为Dehalobacter sp.FTH1 提供氢,最后在脱硫酸盐橡菌DS菌株(Desulfatiglans parachlorophenolica DS)的参与下将苯酚矿化为CO2。
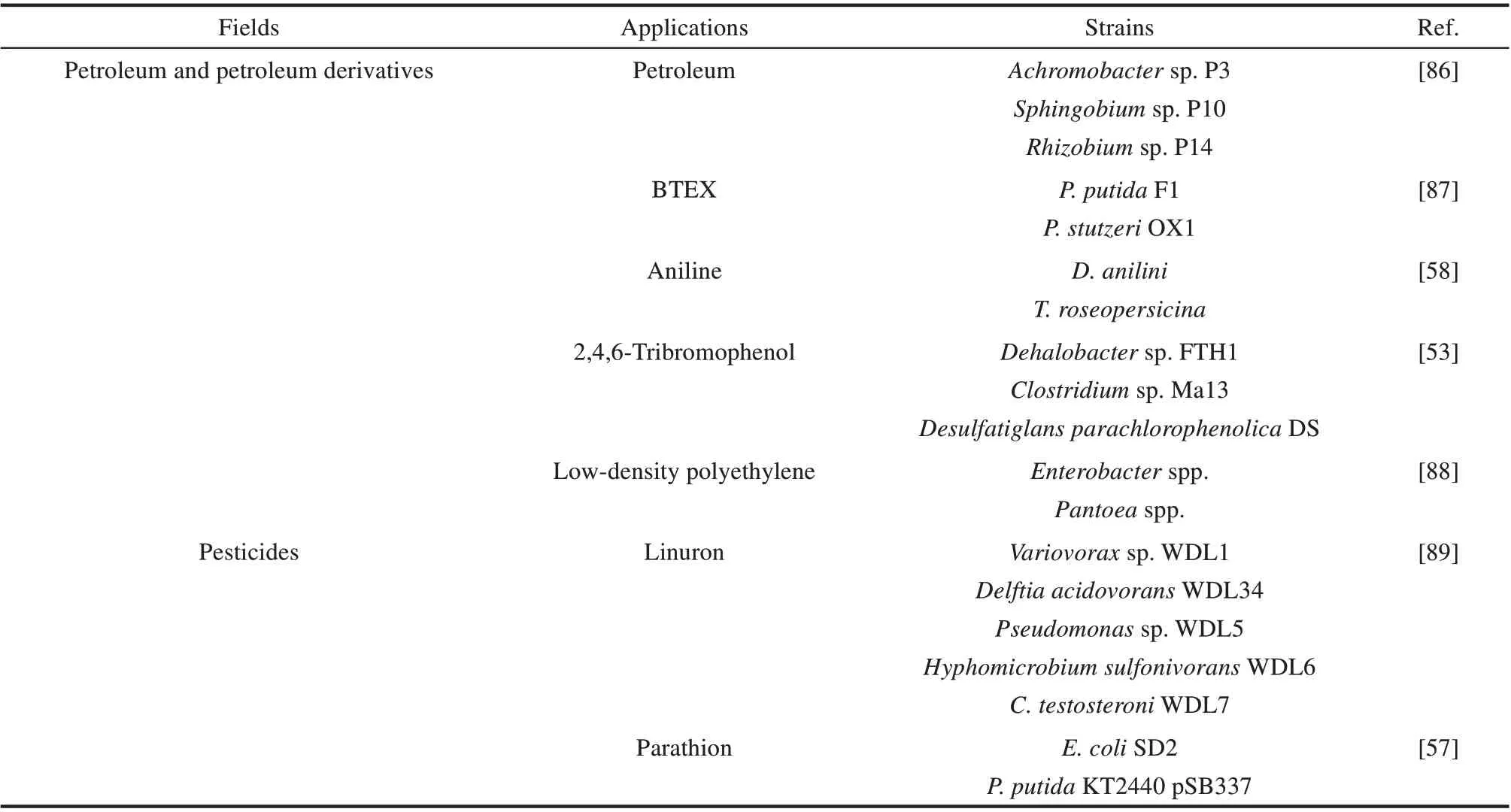
表2 合成微生物组在生物修复方面的应用Tab.2 Applications of synthetic microbial consortia in bioremediation
Skariyachan等[88]于2016年从塑料垃圾加工区筛选出两株降解塑料的菌株,分别是阴沟肠杆菌属(Enterobacter spp.)和泛菌属(Pantoea spp.),以此构建的微生物组能够降解低密度聚乙烯(lowdensity polyethylene,LDPE)薄膜及颗粒。该微生物组能够利用LDPE 作为碳源,在45°C 和pH 8.5的条件下生长, 效果比微生物保存中心(Microbial Type Culture Collection,MTCC)的三株菌株P. putida MTCC 2445、P. stutzeri MTCC 2643和B.subtilis MTCC 9447 的单菌或由这三株菌株组合成的菌群的降解效果更好。
4.2.2 农药的降解
除草剂、杀虫剂等农药的使用为现代农业带来了很大的增产效益,但随着农药的过度使用,其在环境中的残留以及对人、动物带来的危害正变得愈发严重。Top 等[89]2003 年直接从降解除草剂利谷隆(Linuron)的培养物中分离出三种菌株,即贪噬菌WDL1(Variovorax sp. WDL1)、食酸戴尔福特菌WDL34(Delftia acidovorans WDL34)和假单胞菌WDL5(Pseudomonas sp.WDL5)。同时,从利谷隆降解的潜在中间产物如N,O-二甲基羟胺(N,O-dimethylhydroxylamine,N,O-DMHA)和3,4-二氯苯胺(3,4-dichloroaniline,3,4-DCA)的培养物中又分离出2 种菌株,伯氏节杆菌WDL6(Hyphomicrobium sulfonivorans WDL6)和睾丸酮丛毛单胞菌WDL7(Comamonas testosteroni WDL7)。在这五个菌株中,只有Variovorax sp.WDL1能够利用利谷隆作为唯一的能量来源,Variovorax sp.WDL1首先将利谷隆转化为3,4-DCA,同时产生N,O-DMHA。D.acidovorans WDL34 和C. testosteroni WDL7 在 降解3,4-DCA的同时,保护Variovorax sp.WDL1免受3,4-DCA积累而带来的细胞毒性胁迫。N,O-DMHA最终可以被H.sulfonivorans WDL6有效吸收。
在杀虫剂污染的修复研究方面,Gilbert 等[57]于2003 年构建了由两种工程微生物组成的微生物组,对有机磷酸酯杀虫剂对硫磷进行生物降解。含有对硫磷水解酶基因的E.coli SD2,能够将对硫磷代谢为对硝基苯酚,然而对硝基苯酚的积累会对菌株自身的生长及对硫磷的降解产生不利影响,引入含有编码对硝基苯酚矿化基因的菌株P.putida KT2440 pSB337来降解积累的对硝基苯酚,由此实现对硫磷的完全矿化。
5 总结与展望
与单一微生物相比,合成微生物组表现出了独特的优势,例如能明显降低菌株的代谢负担,弥补单一菌株自身的缺陷,并且能够为多元化基因表达提供平台,适应更复杂的应用场景[90-94]。构建合成微生物组分为“自下而上”和“自上而下”两种方法,遵循4个基本原则,即:①相互作用,保证菌群中每种菌株的相互作用能够使整体资源利用率最大化;②空间协调,保证菌群中每个局部的菌落之间相互协调;③菌群稳定,保证合成微生物组能在环境中维持长时间的稳定状态;④生物遏制,保证人工菌群及人工构建的基因不会泄漏至开放环境中。现在比较普遍的构建策略有4种,分别是:①营养互补,通过在一个菌群中设计不同的营养缺陷型菌株,互相提供特定的必需营养物,实现不同菌株之间的稳定共生;②代谢途径分割,将一条代谢途径分割至不同的菌株当中,实现代谢耦合,减轻单一菌种的代谢负担,可以有效提高催化效率;③解除生长抑制,微生物在代谢某些化合物时产生的中间代谢产物会抑制微生物的生长,引入其他微生物来消耗这类中间代谢产物,可有效解除生长抑制;④降低突变率,维持合成微生物组长期稳定的重要方法是降低突变率,维持基因的稳定,从而维持功能的稳定。
随着合成生物学和微生物组学的快速发展并深度融合,合成微生物组已经成为现在微生物研究领域的热点,由此开发的各种生物合成平台、生物治理平台在实际应用方面,都具有广阔的发展前景[73,95-99]。目前已经有研究将合成微生物组应用于微生物生产、微生物修复等领域。在微生物生产领域,可以利用合成微生物组生产氢气、甲烷等能源物质,异丁醇、异丙醇等化工产品,以及2-酮古洛糖酸、氧化紫杉烷等药物。在微生物修复领域,利用合成微生物组降解石油、BTEX、苯胺、卤代苯、农药等污染物,可以扩大用于环境修复的微生物的底物谱,提高降解效率,使微生物能够更广泛地应用于环境修复中。
虽然合成微生物组已经有了不少应用,但是目前合成微生物组还存在一些亟待解决的问题。第一是需要开发适于进行正交遗传线路操作的底盘菌株,这些底盘菌株需要在具备特定合成/降解功能的基础上,具备良好的兼容性与稳定性,且易于进行遗传操作,有明确的基因组图谱,理想情况下还需具备新陈代谢模型。新底盘菌株的开发必定会推动合成微生物组研究在相关领域的应用[100]。第二,多种污染物构成的复合污染比单一污染物更为复杂,这给原位生物修复工作带来了严峻的挑战,因此,原位修复领域的合成微生物组设计需要朝着多种污染并行处理的方向发展[101]。第三,计算生物学推动了合成微生物组的发展,在重构菌群,解析菌种之间的相互关系方面有了一定的应用。但是,依然存在很多问题,例如无法准确预测群落演替、复杂菌群内部的相互作用模型不准确等,今后还需要针对这些问题进行解决[75]。合成微生物组正在成为微生物研究领域、合成生物学领域的一个新的研究热点,随着我们对各个微生物性质了解的深入,合成微生物组研究将会迎来更大的突破。
符号说明
AHL——N-酰基高丝氨酸内酯(N-acyl homoserine lactones)
3,4-DCA——3,4-二氯苯胺(3,4-dichloroaniline)
N,O-DMHA—N,O-二甲基羟胺(N,O-dimethylhydroxylamine)
IPTG— 异丙基-β-D-1-硫代半乳糖苷(isopropyl-β-D-thiogalactopyranoside)
2-KGA——2-酮古洛糖酸(2-keto-gulonic acid)
LDPE— 低密度聚乙烯(low-density polyethylene)
MTCC— 微生物保存中心(Microbial Type Culture Collection)
ROS——反应性氧胁迫(reactive oxygen stress)
