合成生物制造进展
2021-05-22张媛媛曾艳王钦宏
张媛媛,曾艳,王钦宏
(1 中国科学院天津工业生物技术研究所,中国科学院系统微生物工程重点实验室,天津 300308;2 中国科学院科技促进发展局,北京 100864)
合成生物学是对生物体进行有目标的设计、改造乃至重新合成,甚至创建赋予非自然功能的“人造生命”[1-2]。合成生物学融合了生物学、工程学、物理学、化学、计算机等学科,具有重大的科学与技术价值[3]。合成生物学颠覆了传统生命科学以定性描述、探索发现为主的研究范式,逐步建立了定量预测、可控再造为主的科学范式。以合成生物作为核心工具建立的新一代颠覆性生物技术,有望为破解人类社会面临的资源短缺、能源供给、健康安全、生态环境等领域重大挑战提供完整全新解决方案[4]。
合成生物制造是以合成生物为工具,利用淀粉、纤维素、二氧化碳等可再生碳资源为原料,进行化学品、药品、食品、生物能源、生物材料等物质加工与合成的生产方式(图1),具有清洁、高效、可再生等特点,能够减少工业经济对生态环境的影响,有望彻底变革未来医药、食品、能源、材料、农业等传统模式,重塑碳基物质文明发展模式[5-6]。世界经济合作组织发表的报告表明合成生物制造可以降低工业过程能耗、物耗,减少废物排放与空气、水及土壤污染,以及大幅度降低生产成本,提升产业竞争力[7]。例如基础化学品的一个典型案例是1,3-丙二醇合成生物制造,与石油路线相比,CO2减排63%,原料成本下降37%,能耗减少30%,成功创造了一个化纤原料摆脱石油价格体系的范例。根据经济规模潜力分析,所有的有机化学品理论上都可以通过合成生物制造来生产。合成生物可实现自然生物不能合成或者合成效率很低的石油化工产品的生物制造路线,促进二氧化碳的减排和转化利用,构建出工业经济发展的可再生原料路线,推进物质财富的绿色增长。

图1 合成生物制造示意图Fig.1 Schematic diagram for synthetic biomanufacturing
随着传统制造业所依赖的土地、水和化石燃料等资源日益稀少,以人造生命为载体有效利用生物质资源的合成生物制造为制造业转型发展提供了新的解决方案,促使世界主要经济体高度关注和加快部署。美国国家研究理事会于2015 年发布《生物学工业化路线图:加速化学品的先进制造》,提出了未来“生物合成与生物工程的化学品制造达到化学合成与化学工程生产的水平”的发展愿景,并制定了发展和整合原料、微生物底盘与代谢途径开发、发酵以及加工等多个领域的路线图目标;在这一规划指导下,美国能源部、农业部、国防部等持续在生物化学品、生物燃料的生物制造领域投入巨资开展研发项目,启动敏捷生物铸造厂(Agile BioFoundry,ABF)联盟计划,并于2020 年新建生物工业制造和设计生态系统(BioMADE),推动美国非医药类生物工业制造业的发展。欧盟在2013 年发布首个生物基行业《战略创新与研究议程》,2019 年制定《面向生物经济的欧洲化学工业路线图》,提出在2030 年将生物基产品或可再生原料替代份额增加到25%的发展目标;并通过生物基产业联盟计划持续资助生物制造产品的研发和行业发展。英国于2018 年制定发布《至2030 年国家生物经济战略》,着力发展合成生物学研究的转化与应用,建立和完善合成生物技术产业创新网络式布局,推动国家工业战略的实施。日本发布《生物战略2019》,提出到2030 年建成“世界最先进的生物经济社会”,并围绕生物制造技术发展等重要主题制定了《生物战略2020》的基本措施。
近年来,合成生物制造发展迅速,并相继在各个领域取得了令人瞩目的重大成果,这些进展的取得离不开合成生物关键科学问题的深入研究与突破。预计未来十年,石油化工、煤化工产品的35%可被生物制造产品替代,成为可再生产品,对能源、材料、化工等领域产生广泛影响;包括牛奶、食糖、油脂、天然产物等农业产品一旦实现工业生物制造将产生巨大的颠覆性影响,其全球经济规模也十分可观,可以达到数十万亿美元。目前,通过合成生物制造,已经成功实现了一批大宗发酵产品、可再生化学与聚合材料、精细与医药化学品、天然产物、未来农产品等重大产品的生物制造,一氧化碳、甲醇以及二氧化碳等一碳原料利用方面也不断取得进展。本文将就相关进展进行简要综述和讨论。
1 大宗发酵产品生物制造
我国是生物发酵规模最大的国家,其中大宗发酵产品年产量近3000 万吨,年产值超过2400亿元[8],如果将发酵食品涵盖在内,年产值将达到1.2 万亿左右。发酵产品,尤其是氨基酸、有机酸、抗生素、维生素、微生物多糖等大宗发酵产品的生物制造,取决于核心菌种性能与技术的先进性。高性能菌种可以实现更高的转化率、产品浓度和生产强度,从而在激烈的产业竞争中占据主动。合成生物学的发展大大提升了菌种设计改造能力,不仅可以获得自主知识产权的新菌种,而且显著提高原料利用能力和转化效率等技术指标。
1.1 有机酸
有机酸作为一类重要的大宗发酵产品,广泛应用于化工、食品、医药等领域。目前,有柠檬酸、葡萄糖酸、苹果酸、衣康酸、富马酸、丙酮酸、丙酸等20 多种有机酸可以采用发酵法进行规模化生物制造[9-10]。尽管很多有机酸品种已经产业化数十年,各生产企业仍然不断提出提升菌种生产能力、优化生产工艺等要求,以进一步降低生产成本,应对激烈的市场竞争。合成生物学的发展为进一步优化改造生产菌种提供重要机遇。例如,年产量超过175 万吨的柠檬酸是最重要的有机酸品种之一,目前利用合成生物学改造的菌种发酵浓度可以超过220 g/L,对底物的转化率可以接近100%[11-13]。改造过程包括调整菌种内源代谢途径、引入底物转化利用关键酶、调控产物转运等,从而提升菌种底物利用率、降低副产物残留、减弱产物反馈抑制以及培养基组分简化。苹果酸由于其特有的口感,有望代替柠檬酸成为新的酸味剂,但是目前高的生产成本限制了这个应用;近年来,通过合成生物学设计构建的新菌种不断出现,大幅度提升了苹果酸发酵生产能力,生产成本也不断下降[14];通过设计合成与优化改造的嗜热毁丝霉菌可直接将葡萄糖甚至木质纤维素转化为L-苹果酸,其产量超过180 g/L[15],相关研究成果正在推进万吨级产业化应用。衣康酸也是一种重要有机酸产品,尽管与柠檬酸生产有类似的代谢途径,但是衣康酸的发酵水平一般在85 g/L[16],远远低于柠檬酸发酵200 g/L 以上的水平;通过调控糖酵解途径、提升产物转运能力、阻断草酸等副产物形成并结合锰离子调节等过程优化,衣康酸的发酵水平可以提高到130 g/L[17],为大幅度降低生产成本奠定了基础。
1.2 氨基酸
氨基酸同样是一大类重要的大宗发酵产品,通过多种合成生物学技术的应用也为氨基酸生物制造迎来新的发展,不仅赖氨酸、谷氨酸、苏氨酸、蛋氨酸等大品种的生产水平在提升,甲硫氨酸、丙氨酸、精氨酸等新品种生产能力和规模也在快速发展[18-19]。利用代谢工程以及合成生物学工具,成功创制新一代赖氨酸生产菌种,转化率超过75%,居世界领先地位,显著提升了产业水平[20-21]。针对化学法生产甲硫氨酸所需的绝大部分原料和中间体均为有毒物质,甲硫氨酸生物制造越来越受重视,目前发酵加化学转化的两步法已经实现了产业应用,成本接近了化学合成的产品,但是直接发酵生产甲硫氨酸还在进一步研发中[22]。通过解除精氨酸代谢调控、降低糖酵解途径流量以及提高精氨酸合成限速步骤反应速率等一系列设计改造得到新菌种,L-精氨酸产量达到92.5 g/L,为产业应用奠定了重要基础[23]。
1.3 抗生素
抗生素的生产离不开生物制造,特别是青霉素、头孢菌素、红霉素等也属于大宗发酵产品。以青霉素、头孢菌素为代表的β-内酰胺从发现到现在已经有70 多年历史了,尽管早期主要靠随机诱变来提升生产水平,但是近年来利用代谢工程、合成生物学还在持续不断地改造菌种,提升生物制造水平。与70 年前刚发现时相比,青霉素的生产水平提升了10 万[24-25]。放线菌是生产抗生素的重要菌种,通过多组学解析与基因组水平代谢模型计算、前体物供给的理性设计、调控基因与元件改造解除反馈抑制、抗性基因过表达等合成生物学技术,有效地提升了放线菌生产红霉素、阿维菌素、阿霉素、泰乐菌素、FK506等一大批抗生素的生产制造水平[26-28],为保障人类健康提供了重要技术支撑。同时通过途径的合成与组装、底盘细胞选择与改造,合成生物学也为新型抗生素的合成制造提供了新机遇[29],刚刚获得我国一类新药证书的可利霉素就是采用合成生物学技术研制生产的新抗生素的典型案例[30]。
1.4 维生素
合成生物学的发展也促进了维生素的生物制造水平提升,包括众多B族维生素在内的不同种类维生素可以完全从头生物合成,或者结合化学转化的部分生物合成,技术水平也不断得到提升[31-32]。两步法生物制造维生素C是我国生物技术领域里程碑式的重大成果,通过以氧化葡萄糖酸杆菌(“小菌”)和假单胞杆菌(“大菌”)两种菌的生物氧化代替化学氧化,形成全新工艺路线;然而这种总共需要3种菌实现的工艺影响因素较多,难以精确控制,构建新菌种实现一步发酵生产是目前努力的方向[33]。维生素B3(烟酰胺)是重要维生素品种之一,是食品饲料行业不可或缺的重要产品,目前全球年产量6万吨左右,产值约25 亿元;通过设计改造来源于锰氧化橙单胞菌的腈水合酶,开发了基于反馈补料的高密度发酵产酶和两次投酶连续补料清水酶催化3-氰基吡啶的水合反应新技术[34],突破维生素B3生产原料3-氰基吡啶制造的技术瓶颈,实现了维生素B3/吡啶产品链的市场适应性和安全洁净规模化生产。维生素B12是一种含有金属钴的复杂有机分子,广泛应用在药品、饲料和食品等领域;利用合成生物学手段,通过在大肠杆菌中进行从头人工途径的设计,最终得到了生产维生素B12的细胞工厂,发酵周期缩短为20~24 h,为生产维生素B12的工业菌株奠定了基础[35]。
2 可再生化学品与聚合材料合成生物制造
利用非粮淀粉、木质纤维素等可再生原料生产可再生化学品与生物基材料可以解决化石能源短缺等问题,满足经济社会绿色、可持续发展需要[36]。生物制造化学品与材料可以大幅减少原材料和能源消耗,大幅降低操作成本[37-38]。美国DuPont公司与Genencor公司合作,最早开发1,3-丙二醇生物制造技术,产量为135 g/L,葡萄糖转化率为51%,生产强度达3.5 g/(L·h),建成了年产4.5万吨基于1,3-丙二醇的生物聚酯PTT炼制工厂,该生物路线相比石化路线能耗降低40%,温室气体排放减少20%,成为战略新兴产业的一个典范[39]。近年来,随着合成生物学的发展,人们对细胞代谢和调控认识的不断深入,技术手段不断进步,通过优化改造、从头设计合成高效生产菌种,大大提高了可再生化学品与聚合材料的生产能力与效率[40-41]。
2.1 可再生化学品
丁二酸可以用来合成丁二酸丁二醇酯(PBS)、尼龙54等生物基材料。通过遗传改造和代谢进化,构建出高效生产丁二酸的大肠杆菌细胞工厂,丁二酸产量达125 g/L;在此基础上,又将丁二酸合成途径分为若干个功能模块进行改造提升,最终获得丁二酸生产速率和产量提升的新菌种[42-43];利用新菌种已建成2万吨全球最大规模生产线,与石化路线相比成本下降20%,二氧化碳减排90%。戊二胺又名尸胺,是一种生物胺类,在化学纤维、纺织等多个领域有着重要的应用;通过蛋白质工程手段获得了耐受高温、高pH 且具有高活性的赖氨酸脱羧酶突变体,构建和优化酶的生产工艺和赖氨酸生物催化工艺,利用该酶进行戊二胺生产,1 t 发酵罐6 h 内可以获得>200 g/L 的戊二胺,摩尔转化率大于98%,经过初步核算每吨戊二胺的生产成本可以控制在1.4 万元左右,具有较好的经济可行性,有望替代同类产品己二胺[44]。1,4-丁二醇(BDO)是一种极具商业价值的化学品,每年用其生产超过250 万吨的聚合物,目前仅可通过石油和天然气原料合成,借助基因组规模代谢模型,工程改造大肠杆菌,包括增强TCA 循环的厌氧途径以提升还原力供给等,最终首次构建了可直接合成BDO 的生物合成途径,浓度可达18 g/L[45];随后通过优化代谢途径中酶的活性,1,4-丁二醇产量可达200 g/L,实现了万吨级规模的生产应用,比石化路线减少56%的温室气体排放[46]。利用合成生物学技术,更多的脂肪酸、脂肪醇、酯、烯烃、烷烃、酮、酚等石油化学品也可以通过生物制造实现,不过目前大多数产品与石化路线相比还不具备经济可行性,需要进一步提升生产水平[47]。
2.2 生物基聚合材料
利用合成生物学技术也可以直接生产生物基聚合材料[48-49]。聚乳酸(PLA)也称为聚丙交酯,属于聚酯家族,是一种生物基可生物降解材料,主要通过生物制造的L-乳酸或D-乳酸化学聚合而成[50];通过引入多种外源基因可在大肠杆菌工程菌体内直接生产PLA 均聚物及其共聚物P(3HB-co-LA),但效率很低,后期通过基因敲除、启动子优化等方法最终实现高效合成PLA 均聚物和共聚物,为一步法生物合成非天然聚合物提供了支撑[51-52];通过进一步的大肠杆菌改造实现了一步合成非天然高分子聚乳酸-羟基乙酸共聚物PLGA,相关聚合物在组织工程支架、药物缓释载体、医用工程材料等领域具有良好的应用前景[53]。聚羟基脂肪酸酯(PHA)是天然可生物降解的高分子聚合物,在包装材料、医疗器械材料领域有广阔的应用前景。目前,运用合成生物学手段,大多数常见的PHA 可以以葡萄糖为单一碳源来合成。通过在工程大肠杆菌中整合多种外源酶基因,可直接体内合成3-羟基丙酸酯(3HP)和4-羟基丁酸酯(4HB)的共聚酯P(3HP-co-4HB),并且在可控制范围内可调节单体比,会直接影响3HP 和4HB 的聚合物、共聚物性能,是首次实现可调单体比的P(3HP-co-4HB)[54];通过在大肠杆菌中工程改造反式脂肪酸β-氧化途径,可直接利用葡萄糖合成中长链PHA(mcl-PHA),继续敲除主要硫酯酶、引入特异性PHA 合成酶,最终可实现多种短链-中长链PHA 共聚物,表明利用反式脂肪酸β-氧化途径生产中长链PHA 具有广阔前景[55];通过分离在含有氯化钠的海水中快速生长的嗜盐菌——盐单胞菌,利用合成生物学技术对该菌株进行从头改造,使其能在不灭菌和连续工艺过程中高效生产各种PHA,大幅度降低PHA 的生产成本,目前已完成35 t罐规模的生产测试,为规模化工业生产奠定了坚实基础[56-57]。
3 精细与医药化学品合成生物制造
随着经济的发展和科技的进步,精细与医药化工产业已进入成熟期。目前,我国已经成为全球最大的精细与医药化学品供应国。随着合成生物学的发展,通过对细胞内代谢途径的全新设计,使精细与医药化学品可以通过微生物细胞以廉价的糖类等为原料来合成,为降低精细与医药化学品的生产成本,实现绿色生产提供可能[58-59]。
3.1 肌醇
肌醇是重要的精细化学品,广泛应用于饲料、医药、食品等行业。通过四种酶构建了新一代肌醇生物合成路线,且无需额外添加ATP 或NAD+,得率可达98.9%±1.8%(质量分数),在国际上实现了规模化利用多酶分子机器催化淀粉生产肌醇的工艺路线,相比传统的植酸酸解生产工艺,磷酸污染降低90%,成本降低50%[60]。通过在大肠杆菌中葡萄糖和甘油的协同利用实现碳源的合理分配,将甘油用于细胞生长,葡萄糖用于合成肌醇,并对生产和生长两个模块进行优化,实现了肌醇的高效生产,肌醇产率可达76 g/L,产量达0.68 g/g总碳源,葡萄糖利用率几乎达到100%,为肌醇的生物制造提供了另一个选择[61]。
3.2 芳香族化合物
芳香族化合物既是重要的精细化学品,也是化学原料药的重要组成部分,如香草醛(食品香料)、苯甲酸(食品防腐剂)、对乙酰氨基酚(抗感冒药物)、乙酰水杨酸(抗凝药物)、左旋多巴(治疗帕金森病药物)等都是重要的芳香族化合物。目前这些芳香族化合物主要通过高污染、高能耗的苯基化学合成或植物提取获得,具有不可持续性[62]。生物体中普遍存在的莽草酸生物合成途径可以生产出一系列芳香族化合物,并且通过进一步的生物衍生转化,可以合成出这些不同种类的化学原料药。因此,通过构建高效生物催化剂和新菌种,创建绿色生物合成工艺,使芳香族化合物的高效生物合成制造取得了一些最新进展(表1),这将有望大幅减少能耗、物耗和污染物排放,实现绿色低碳、可持续的发展模式[73]。本文作者所在研究团队通过对大肠杆菌莽草酸合成途径进行重新设计优化,逐步组合调控,并结合生物传感器、液滴微流控分选等新一代高通量筛选技术,实现了3-脱氢莽草酸、3-脱氢奎尼酸、原儿茶酸、左旋多巴、对氨基苯甲酸、邻羟基苯甲酸等数十种芳香族化合物的从头生物合成[74-75],这些产品技术指标不仅在国际上领先于同类研究,且初步生产成本低于化学合成或植物提取,显示出了良好的产业应用前景。其中3-脱氢莽草酸、原儿茶酸、左旋多巴等产品已经技术许可或技术转让给企业,正在推进产业应用。
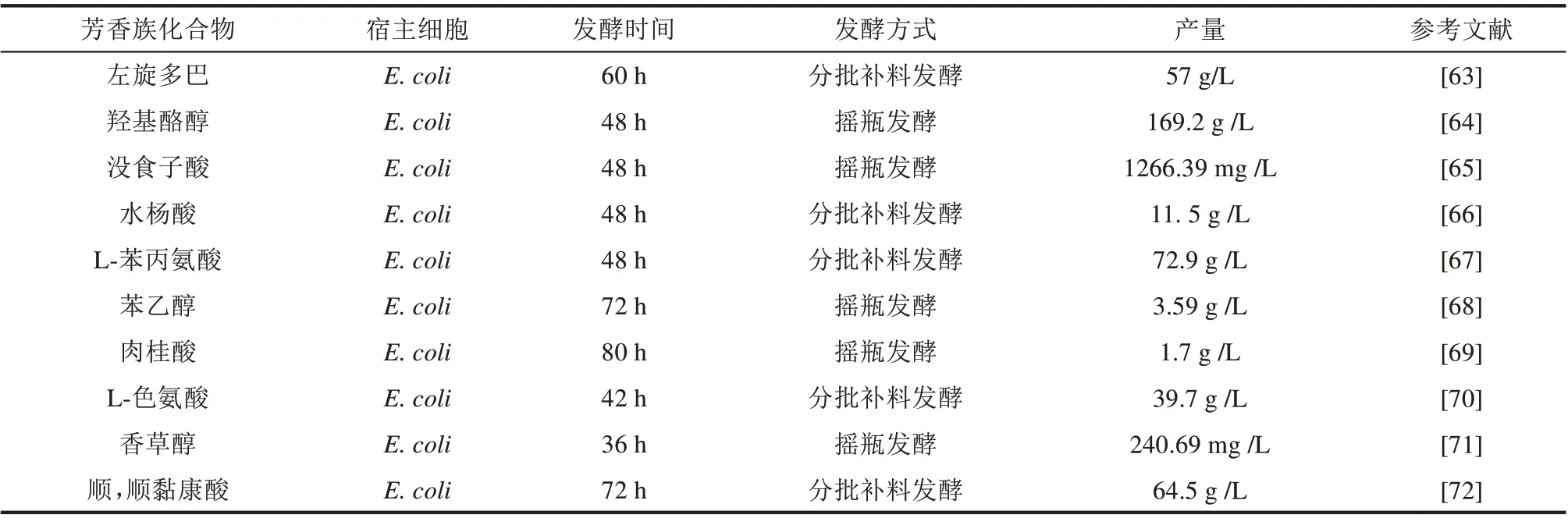
表1 芳香族化合物合成生物制造新进展Tab.1 Progress of synthetic biomanufacturing of aromatic chemicals
3.3 甾体激素
甾体激素是除了抗生素之外的第二大类药物,全球产值超过100 亿美元[76]。目前甾体激素化合物的生产制造主要以化学合成为主、生物转化为辅。化学合成不仅严重依赖需要大量土地种植获取的植物资源,而且生产过程排放大量有机废物,对生态环境造成严重污染。基于合成生物学的原理,设计和改造微生物菌种来发酵生产能有效解除原料限制,提升现有生产工艺中生物催化剂(转化菌种或酶)性能,克服产物精制分离新技术的应用等瓶颈。近年来,重要甾体化合物的生源合成途径被依次解析,胆固醇、薯蓣皂素和氢化可的松的全生物合成连续实现[77-78]。通过转录组学分析,结合酿酒酵母底盘细胞的基因功能鉴定,成功挖掘到蓝色犁头霉来源的11β-羟化酶系统,随后通过酶半理性改造,获得R126D/Y398F 突变体,可将该羟化酶系统的催化活性提高2 倍,最终构建的酿酒酵母人工细胞生物转化合成氢化可的松的产量达1.06 g/L,最大生产速率达667 mg/(L·d),较出发菌株提高30 倍,达到目前酵母体系生物转化合成氢化可的松的最高水平[79]。通过对新金分枝杆菌工业菌种的基因组测序及转录组分析,设计构建的新菌种可以高效生产黄体酮前体支链醇、A 环开环物(谷内酯)、A-环酮酸、雄烯二酮等一系列甾体化合物及中间体[80-81],使19-去甲雄烯二酮合成反应步骤由原来化学转化的14 步,缩短至生物转化的2 步,在国际上首次实现以大豆甾醇为原料规模化生产,取得良好经济效益,提升了该产业的国际竞争力。
4 天然产物合成生物制造
目前全球使用天然药物的人数约40 亿,占世界总人口的80%。天然药物销售额约占全球医药销售总额的30%,并且每年还以15%的速度增长,因此传统的种植业已经难以满足社会发展需求[82]。同时多数天然产物结构复杂,化学合成途径烦琐,得率低、能耗高、污染重,难以实现环境友好的规模化生产。借助合成生物学,构建合理的合成途径及菌种生产天然产物,为其产业长久发展提供了新的思路[83]。
4.1 天然产物合成生物制造国际进展
近年来,全球研究人员在植物天然产物的合成生物学领域取得了多项成果,成功创建了萜类化合物和苯丙素类等植物天然产物的人工合成菌种。青蒿素的微生物合成就是成功的典范,通过十多年努力,花费超过5000 万美元,得到青蒿素前体的产量25 g/L[84]。抗癌药物紫杉醇是备受关注的另一个重要案例,将设计改造的紫杉二烯合成酶导入大肠杆菌中,并对功能模块进行精确调控,获得生产紫杉醇前体化合物——紫杉二烯的菌种,产量比以前报道的提高了1 万倍以上[85]。在镇痛药物的生产方面,通过利用改造的酵母从糖中直接生产阿片类化合物的蒂巴因和氢可酮以及那可丁的方法,整个过程大约只需3~5 天,可显著地缩短其生产周期[86-87];在俗称“脑黄金”的长链脂肪酸DHA 生产方面,在产油酵母解脂耶氏酵母中设计和构建了人工不饱和脂肪酸(PUFA)生物合成基因簇,最终在磷酸盐限制条件下,营养筛选可使PUFA 产量大大增强,在已报道PUFA生产的解脂耶氏酵母菌株中,该研究所获得总脂肪酸中DHA(16.8%)含量最高[88]。近期,通过将大麻素前体大麻萜酚酸(CBGA)合成途径导入酵母细胞,并通过替换植物来源的异戊二烯转移酶成功实现CBGA 工程微生物体内合成的突破,借助合成生物学手段通过使用发酵罐合成出需要经过人工6 个月才能种植提取出来的大麻素[89],又成为合成生物制造领域的一个突破性进展。
4.2 天然产物合成生物制造国内进展
我国在植物天然产物生物制造方面已经取得了众多进展。人参皂苷是是一种固醇类化合物,被视为人参中的活性成分,具有抗肿瘤等功能。目前利用人工栽培人参、西洋参生产的人参皂苷类化合物产量已经远不能满足社会的需求,亟待新的资源途径。通过在酿酒酵母中构建原人参二醇的全新生物合成途径,结合关键基因的表达活性改造提升及双相发酵工艺优化,原人参二醇的产量提高到1 g/L[90];随后,获得了能同时合成齐墩果酸、原人参二醇和原人参三醇3种人参基本皂苷元的第一代“人参酵母”[91]。通过分子工程、过表达关键酶基因、定向进化等工程策略构建人参皂苷酵母细胞,提升前体物碳供应、目标产物转化率,最终可实现摇瓶179.3 mg/L及批式添加发酵2.25 g/L 的历史突破[92],1000 m2车间里“人参酵母”生产人参皂苷的能力相当于十万亩人参种植,成本是人参种植提取的1/4。其他天然产物如β-胡萝卜素、番茄红素、天麻素、红景天苷等在生物制造方面也取得了巨大的进展(表2),必将颠覆传统种植提取模式。

表2 我国天然产物合成生物制造进展Tab.2 Progress of synthetic biomanufacturing of natural products in China
5 未来农产品合成生物制造
由于全球人口的持续增长,地球出产农业产品的能力将接近极限。据预测,到2050 年全球人口增长到100 亿左右,届时地球将无法为人类提供足够的食物。例如从1961 年到2007 年,世界人均肉类消耗量已经翻了一番,据联合国预测至2050 年还会再翻一番。如何为全世界人口提供足量健康的农产品将成为未来全球面临的艰巨挑战。数千年来,人类的农产品始终依赖于动、植物提供,但是合成生物学的发展,可以使人们通过发掘动、植物的营养、功能成分合成的关键遗传基因元件,有可能对跨种属的基因进行组合,采用人工元件对合成通路进行改造,优化和协调合成途径中各蛋白的表达,创建淀粉、蛋白、油脂以及其他营养功能因子的高效人工生物合成路线,形成崭新的细胞工厂,颠覆现有的农产品生产与加工方式,摆脱人类所需营养素及天然化合物对资源依赖和以环境破坏为代价的发展。目前,随着生命科学与技术的快速进步与发展,利用合成生物学等手段,构建具有特定合成能力的细胞工厂种子,不仅可以生物合成制造香兰素、白藜芦醇、甜菊糖苷等一系列高附加值农业相关产品,合成制造淀粉、油脂、健康糖、牛奶、素食奶酪、各种蛋白(胶原蛋白、蚕丝蛋白、肉类蛋白及卵蛋白等)和肉类的技术也日趋成熟。这些新技术将颠覆传统的农产品加工生产方式,形成新型的生产模式(图2),促进农业工业化的发展[103-104]。
5.1 油脂生物制造
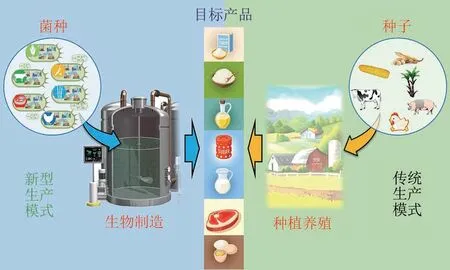
图2 未来农产品合成生物制造Fig.2 Schematic diagram for synthetic biomanufacturing of future food
油脂是人类生活必需的营养成分,目前人类食用油脂主要来源于植物和动物。微生物油脂是继植物油脂、动物油脂之后开发出来的又一人类食用油脂新资源。微生物细胞工厂产生油脂的过程,本质上与动植物产生油脂的过程相似,都是从乙酰CoA 羧化酶催化羧化的反应开始,然后经过多次链延长,或再经过去饱和作用等完成整个生化过程。自20 世纪80 年代以来,开发利用微生物进行功能性油脂的生产成为一大热点,利用微生物细胞工厂生产的γ-亚麻酸(GLA)、花生四烯酸(AA)、二十碳五烯酸(EPA)、二十二碳六烯酸(DHA)等营养价值高且具有特殊保健功能的功能油脂产品,相继在日本、英国、法国、新西兰等国投入市场。因此,合成生物学技术构建的细胞工厂种子,淀粉、油脂以及蛋白质等基础性农产品都可以实现工业车间制造,将有望终结农药化肥的使用,减少对土地的依赖和污染,推动农业工业化发展,为解决全球人口的农产品供给问题提供新策略。
5.2 植物基肉、蛋、乳制品生物制造
此外,植物基肉、蛋、乳制品也开始逐渐普及,渗透进大众日常生活中。美国加州Impossible Foods 公司创建了人造牛肉关键组分血红素蛋白的酵母细胞工厂[105],结合植物蛋白组分合成了人造牛肉,可以节省74%的水,减少87%的温室气体排放,需要的养殖土地面积也减少了95%,并且不含激素、抗生素、胆固醇或人造香料。Perfect Day公司利用细胞工厂技术,创建了能够合成牛奶香味和营养成分的人工酵母,通过酵母细胞工厂发酵生产牛奶一样的蛋白质,有可能彻底改变乳品行业;由于全球大约75%的人口乳糖不耐受,亚洲人尤其多,人造牛奶的口味和营养与天然牛奶相同,不含胆固醇和乳糖,适用人群也更广,而且产生的碳排放减少了84%,有望成为下一代重要的牛奶替代品。此外来自硅谷的Clara Foods科技公司,通过酵母细胞工厂构建、发酵合成乳清蛋白,是利用分子合成技术生产动物蛋白的范例;美国Hampton Creek 公司研发出含蛋类替代品“人造蛋”,以独特技术将种植于加拿大的豌豆和多种豆类植物混合,制作出味道和营养价值可与真鸡蛋媲美的植物蛋产品,产品保存时间更长,营养价值和味道与真蛋相似,此类“植物蛋黄酱”已经在香港等地的超市“亮相”销售[106]。
生物技术的发展已经让微生物细胞工厂成为“新型种子”,从牛肉、牛奶、牛胰岛素到牛胶原蛋白,所有的奶牛制品能用发酵罐生产,进而合成制造替代养殖奶牛获取奶制品。结合关键组分合成、3D 打印、蛋白仿真等技术,未来农产品生产将完全不同于传统生产模式。相比动植物制品,人造农产品中蛋白质组分、铁含量、脂肪含量等更容易控制,更利于健康。例如针对能增加患心脏疾病风险的胆固醇,人造农产品可以做到完全剔除,而且生产成本低,生产过程不含抗生素和激素。随着人们对健康、环保及美味食品的追求,利用微生物细胞工厂作为种子,创制出包括淀粉、蛋白、肉类、牛奶以及鸡蛋等未来农产品,不仅能为人类提供美食味道和营养,而且无需种植作物和养殖动物。随着技术的发展,越来越多农产品的未来,将走向人工制造的道路,这也将是无激素及抗生素等农残、无食品过敏源、价格更低以及温室气体排放更少的农产品生产发展趋势。
6 一碳原料人工生物转化利用
大宗发酵产品、可再生化学品与聚合材料等生物制造已经取得长足的发展,但受限于糖基底物无法持续稳定供应及成本因素考虑,亟需开发更加经济的底物来进行生物制造,降低生产,提高经济可行性。目前,一碳原料包括CO2、甲烷、甲醇、甲醛和甲酸盐等,被认为是廉价和可持续原料,有望彻底改变合成生物制造[107]。一碳原料来源广泛,既可以由有机废物产生,也可从石化废气中得到,利用一碳原料能够解决化学转化能耗高、污染重、自然生物转化效率低的问题,也因此这一领域成为科学界和产业界共同关注的焦点。近年来,随着合成生物学的发展,通过元件挖掘与设计、合成途径创新与优化、细胞性能优化等新思路为一碳原料利用提供了重要技术支撑。
6.1 甲醇原料利用
甲醇作为一种一碳原料,可由甲烷或合成气(H2和CO)规模化制备。目前,研究者已通过直接改造甲基营养菌来生产一些化学品,但受限于遗传工具、产物纯度以及滴度的限制,还未能实现技术经济的可持续性[108]。在合成生物学的助力下,研究者已经开始探索人工构建合成甲基营养菌。通过对大肠杆菌进行理性设计,将甲醇和葡萄糖酸盐的代谢相耦合,经实验室进化获得了依赖甲醇和葡萄糖酸作为共同底物生长的进化菌株,同位素标记实验证明进化菌株由甲醇转化的中心碳代谢物占比24%,甲醇消耗速率亦达到与天然甲基营养菌相当的水平[109]。通过对大肠杆菌进行工程设计,并使用添加氨基酸的培养基进化出甲醇依赖的菌株,最终在以13C 标记的甲醇作为底物的分批补料发酵中,甲醇到丙酮的转化率为22%,远高于先前甲基营养型大肠杆菌2.4%的转化率水平[110]。与此同时,改造谷氨酸棒状杆菌进行甲醇转化的研究也在进行,通过理性设计构建了高效利用甲醇的甲醇依赖型谷氨酸棒杆菌,结合适应性进化策略,实现工程菌株在甲醇-木糖混合碳源的矿物培养基中生产速率提升20 倍,而甲醇-木糖利用比率达到3.83∶1,为继续深入研究全合成甲醇营养工程菌奠定了基础[111]。
6.2 甲酸原料利用
甲酸同样是值得期待的一碳原料,甲酸来源广泛,但自然界中能够利用甲酸的微生物在能量利用、生产速率、工程改造方面难度极大,研究者尝试在工程菌中引入天然途径或构建新型甲酸途径。通过计算建模,设计合成了非天然的还原甘氨酸途径(reductive glycine pathway, rGlyP),该途径在效率上与还原性乙酰辅酶A 途径/Wood-Ljungdahl 途 径(reductive acetyl-CoA pathway,rAcCoAP)相当,但是rGlyP 却不需要氧敏感酶的参与,使rGlyP 途径的应用更加广泛[112]。通过引入三种外源基因(Me-FTL、Me-Fch、Me-MtdA)及过表达四种内源基因构建重组大肠杆菌,构建了以甲酸盐和葡萄糖为底物通过rGly 途径来合成丝氨酸,经检测,菌体中10%碳组分来自于甲酸,其余来自葡萄糖[113]。
6.3 CO2原料利用
CO2是主要的温室气体,同时也是一种取之不尽、用之不竭的廉价一碳原料,以CO2为原料的生物制造既可以减少CO2排放,又可以提供碳基燃料和化学品。通过合成生物学技术,利用和固定CO2取得了重要进展[114-115]。通过产乙酸菌转化合成气(H2/CO2或CO)生产乙酸,后取发酵上清液培养酵母工程菌以生产脂质化合物,最终经过底物和发酵过程优化,脂质化合物浓度可达115 g/L,此种两步法联合培养展现了利用CO2等一碳原料进行生物制造方面的巨大潜力[116]; 利用光合微生物作为光吸收体开发的微生物光伏(BPV)为可再生能源生产提供了生物学方案,但由于光合微生物外电子活性很弱,BPV 的强度很难提高,通过结合光合蓝细菌和可产生电子的希瓦氏菌构建新型BPV,实现了利用光能固定CO2,同时生成电流,为BPV 的进一步研究开拓了新的方向[117];通过代谢性逆合成分析形成初步框架,从包括人类、植物和微生物在内的9 种生命体中选择了16 个不同来源的酶,构建了一条比植物更高效的固定大气中CO2的合成途径,成为了六种自然进化的CO2固定途径之外的第七种方法,为CO2人工生物转化利用开辟了新路径[118]。
尽管一碳原料生物经济潜力巨大,但需要解决的问题同样很多,比如怎样提升还原力和能量输入以便更加高效地吸收利用底物等。未来通过对天然酶的定向进化或者从头设计新酶将会是实现一碳原料生物制造的关键。
7 合成生物制造展望与发展趋势
合成生物支撑的生物制造产业正在成为快速发展的战略性新兴产业,将引领新的产业模式和经济形态。通过利用合成生物高效合成稀缺的医药、实现精细化工产品的绿色工业生产,为传统产业走出资源环境制约提供了崭新思路。合成生物制造是物质财富创造的新模式,是大幅度提升绿色指数的最佳选择。特别是,最近席卷全球的新冠疫情正在进一步重塑世界经济社会发展格局,在可预期的未来,人类生活与生产模式将发生深刻变化,医药与健康系统、食品与农业系统、能源与材料系统等新的科技需求将推进生物技术领域发生重大变革,后新冠时代的生物制造产业面临着历史性的振兴机遇与全新的挑战。日本经济产业省的研究报告分析指出,工程化生物细胞及其与信息/人工智能技术的组合将成为“后第四次工业革命”的主要驱动力。
近年来合成生物学技术展示出惊人的应用潜力,且进展迅猛,利用合成生物可生产多种高价值代谢产物,广泛用于药品、保健品、食品等诸多行业,相比之下前景看好的大宗化学品及其衍生物并没有展示出预期的发展速度,原因主要为底物受限、成本高昂、经济性差。因此,要大力发展非粮原料,消除与人争粮的矛盾,同时探索新型固碳方式,开发利用来源广泛的一碳化合物的技术,创造全新碳利用方式。随着世界范围内人类对于环境保护意识增强,合成生物学技术必须从绿色发展战略考虑其方向,并且要从全产业链层面思考绿色合成生物制造,从合成生物设计构建到后期产品分离,都要最大限度降低甚至避免对环境的影响。
合成生物学至今仍然以自然生物的设计改造为主开展研究,利用合成生物产物绝大部分为天然化合物,与之矛盾的是绝大多数化学品并没有天然生物合成途径,这是合成生物学未来发展将直面的巨大挑战,因为目前为止可以实现从头创建全新非自然合成途径的报道极少;同时这也展示了合成生物学巨大的发展机会,随着技术的发展有望实现颠覆性的革新;新世纪人工智能、大数据等技术为科学发展创造出新的可能,同样合成生物学也可将其引入自身体系,全面整合生物合成途径规模化解析、元件库建设、生物途径高通量组装和优化、人造系统的调试等技术,人工构建全新合成途径,生产新型化合物,服务人类发展。
未来,将合成生物学应用于合成生物制造,可以让越来越多大宗发酵产品、精细与医药化学品、可再生化学品与聚合材料、天然产物、未来农产品以及一碳原料等合成生物制造成本持续降低,促进经济社会可持续发展。
