应用阿帕替尼和替吉奥对晚期胃癌进行二线治疗的近期疗效和不良反应分析
2021-05-21张凯蒋珍新
张凯,蒋珍新
(京山仁和医院肿瘤科,湖北 荆门 431800)
胃癌是临床较常见的消化道恶性肿瘤,具有较高的发病率、死亡率[1-2]。胃癌存在隐匿性,大多数患者在确诊时已处于晚期[3],丧失手术根治机会,一般采用全身化疗。标准的一线治疗能延长晚期胃癌患者的生存期[4],当一线治疗无效后,需对患者进行二线治疗。临床中单纯采用替吉奥进行二线治疗具有一定的效果,但存在不良反应多、耐药性低等不足,故探索更加有效、安全的二线治疗方案十分重要。本研究探究替吉奥、阿帕替尼在晚期胃癌患者联合治疗中的效果,现报道如下。
1 资料与方法
1.1 临床资料 选取本院2018年2月至2019年1月收治的66 例晚期胃癌患者作为研究对象,按照随机数字表法分为两组,每组33 例。对照组男20 例,女13 例;年龄44~76 岁,平均(54.75±3.83)岁。胃癌类型:乳头状腺癌13 例,印戒细胞癌7 例,黏液腺癌3 例,管状癌4 例,其他6 例。转移部位:肝转移15 例,腹腔淋巴结转移10 例,其他8 例。病理分期:Ⅲ期14 例,Ⅳ期19 例。观察组男21 例,女12 例;年龄45~77 岁,平均(54.84±3.90)岁。胃癌类型:乳头状腺癌14 例,印戒细胞癌8 例,黏液腺癌4 例,管状癌3 例,其他4例。转移部位:肝转移16 例,腹腔淋巴结转移11 例,其他6例。病理分期:Ⅲ期16例,Ⅳ期17例。两组患者临床资料比较差异无统计学意义,具有可比性。所有患者均对本研究知情同意,并自愿签署知情同意书。本研究已通过医院伦理委员会审核批准。
纳入标准:所有患者均经细胞学检查、组织病理学检查明确诊断为晚期胃癌,并可检测到≥1个可测量病灶;一线治疗无效、ECOG评分<2分者;肝肾功能、心功能正常者。排除标准:存在其他部位肿瘤者;存在胃肠瘘、胃穿孔或出血倾向者;存在难以控制的高血压者;存在影响口服药物吸收效果疾病者;对相关药物存在过敏反应或存在化疗禁忌者。
1.2 方法 对照组采用替吉奥(齐鲁制药有限公司,国药准字H20100150)治疗。按照患者体表面积控制用药剂量,体表面积<1.25 m²者口服替吉奥每次40 mg,每天2次;体表面积1.25~1.50、>1.50 m²者分别口服替吉奥每次50、60 mg,每天2 次。连服3 周,停服1 周,4 周为1 个周期,共治疗2 个周期。观察组采用阿帕替尼(江苏恒瑞医药股份有限公司,国药准字H20140103)联合替吉奥治疗。替吉奥用法用量同对照组,餐后30 min 口服阿帕替尼,每次500 mg,每天1 次,根据患者耐受程度对用药剂量进行调整,1个疗程为4周,连续治疗2个疗程。
1.3 观察指标 ①比较两组血清细胞因子水平。在化疗前、后采集两组患者空腹静脉血5 mL,以3 000 r/min离心10 min,取上层血清,对血清γ-干扰素(IFN-γ)、肿瘤坏死因子-α(TNF-α)、白介素-4(IL-4)、IL-10 进行检测。②比较两组体质量、饮食、疼痛、睡眠等改善情况。③比较两组临床疗效。评价标准:完全缓解,病灶彻底消失且维持至少1个月;部分缓解:病灶较化疗前缩小>30%且维持至少1 个月;稳定:病灶缩小<30%;进展:病灶增加>20%或有新病灶出现。疾病控制率=完全缓解率+部分缓解率+稳定率。④比较两组不良反应发生率。包括恶心呕吐、腹泻、中性粒细胞减少、手足综合征、乏力、骨髓抑制
1.4 统计学方法 采用SPSS 21.0统计软件进行数据分析,计量资料以“±s”表示,比较采用t检验,计数资料用[n(%)]表示,比较采用χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 两组血清细胞因子水平比较 治疗前,两组血清细胞因子水平比较差异无统计学意义;治疗后,两组血清细胞因子水平较治疗前明显改善(P<0.05),且观察组IFN-γ、TNF-α水平高于对照组,IL-4、IL-10水平均低于对照组(P<0.05),见表1。
表1 两组的血清细胞因子水平比较(±s,pg/mL)Table 1 Comparison of serum cytokine levels between the two groups(x±s,pg/mL)

表1 两组的血清细胞因子水平比较(±s,pg/mL)Table 1 Comparison of serum cytokine levels between the two groups(x±s,pg/mL)
组别对照组(n=33)观察组(n=33)t值P值IFN-γ治疗前7.52±1.26 7.58±1.23 0.196 0.845治疗后9.64±1.75 12.56±2.11 6.119<0.001 TNF-α治疗前4.01±0.83 4.04±0.90 0.141 0.889治疗后5.10±1.00 5.95±1.42 2.811 0.007 IL-4治疗前9.03±1.60 9.10±1.64 0.176 0.861治疗后5.36±1.27 3.12±1.06 7.779<0.001 IL-10治疗前24.08±3.59 24.15±3.63 0.079 0.938治疗后12.66±2.37 8.46±1.95 7.861<0.001
2.2 两组临床相关改善指标比较 观察组临床相关指标改善情况明显优于对照组(P<0.05),见表2。
2.3 两组临床疗效比较 观察组总控制率明显高于对照组,差异有统计学意义(P<0.05),见表3。
2.4 两组不良反应发生率比较 观察组不良反应发生率明显低于对照组,差异有统计学意义(P<0.05),见表4。
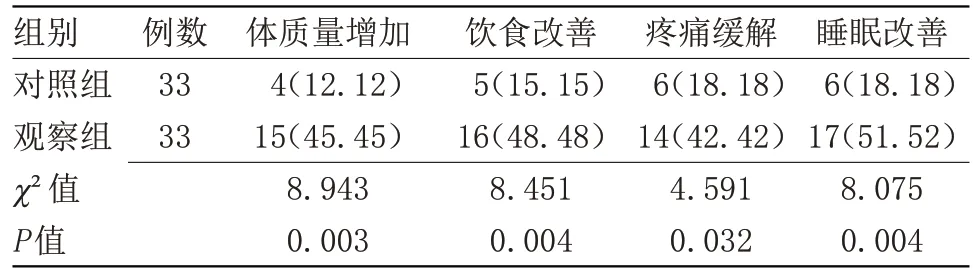
表2 两组临床相关改善指标比较[n(%)]Table 2 Comparison of related clinical improvement indicators between the two groups[n(%)]

表3 两组临床疗效比较[n(%)]Table 3 Comparison of clinical efficacy between the two groups[n(%)]

表4 两组不良反应发生情况比较[n(%)]Table 4 Comparison of the incidence of adverse reaction between the two groups[n(%)]
3 讨论
近年来,随着人们生活方式、饮食习惯及结构的改变,胃癌发病率呈现增长的趋势[5],严重影响人们的身体健康和生活质量。手术是根治早期胃癌的有效方法[6],但大部分患者在确诊时已为晚期,此阶段进行手术存在复发率高、生存期短等不良情况,故临床多予以全身化疗。晚期胃癌的一线治疗多使用二联或三联化疗药物,但随着疗程的增加,会加重不良反应、耐药现象[7],进而转为二线治疗。目前临床尚无统一规范的二线治疗用药方案。替吉奥是常用于治疗晚期胃癌的二线治疗药物,其中含有的替加氟抗癌作用较好[8],吉美嘧啶可提升疗效,奥替拉西钾可抑制替加氟引起的不良反应,3 种药物混合可使5-氟尿嘧啶作用时间延长,降低血管内皮生长因子水平[9],能抑制肿瘤细胞增殖、肿瘤新生血管生成,但会出现恶心、呕吐等不良反应,且患者的耐受力较差[10]。阿帕替尼能对血管内皮生长因子-2表达水平进行抑制[11],从而阻止下游促血管生成信号通道,还可抑制肿瘤组织血管生成以及营养供应,不良反应低,可较好地对肿瘤进展进行抑制[12]。
本研究结果显示,治疗后,观察组IFN-γ、TNF-α、IL-4、IL-10 水平均较治疗前改善,且优于对照组,提示阿帕替尼联合替吉奥可有效改善晚期胃癌患者的机体免疫抑制水平,可延缓肿瘤进展[13];观察组临床相关指标改善情况、疾病总控制率更优,且不良反应发生率低,证明阿帕替尼联合替吉奥能较好地控制病情,提高患者的生存质量[14],且联合用药能够减少不良反应,提高用药安全性。
综上所述,对晚期胃癌患者采用阿帕替尼和替吉奥进行二线治疗的近期疗效较理想,且可减轻不良反应。
