基底前脑催产素受体基因沉默对大鼠认知行为和胆碱能通路的影响
2021-05-20荣翠平宋双双侯雪芹
荣翠平宋双双侯雪芹∗
(1. 广州中医药大学,第二临床医学院,广州 510006; 2. 山东第一医科大学,药学院药理学研究所,山东泰安 271016)
中枢胆碱能神经系统损伤是阿尔兹海默病(Alzheimer’s disease,AD)关系最密切的信号通路之一,乙酰胆碱(acetylcholine,Ach)减少时可导致认知功能障碍[1]。与Ach 相似,催产素能神经元纤维末梢释放的催产素可作为神经递质,释放到大脑的不同脑区[2],并且催产素信号系统可能与毒蕈碱乙酰胆碱信号相互作用,调节认知状态过程[3]。催产素通过其受体发挥作用[4]。以胆碱能神经元为主的基底前脑Meynert 基底核(nucleus basalis of Meynert,NBM)中表达催产素受体[5],而且在与学习记忆密切相关的胆碱能投射靶区海马和皮质中也有催产素能神经纤维的传入[2,6]。因此,催产素受体信号通路可能与胆碱能通路存在关联。本文利用重组腺相关病毒(recombinant adeno-associated virus,rAAV)和短发夹RNA(short hairpin RNA,shRNA)技术干扰大鼠基底前脑催产素受体(oxytocin receptor,OXTR),研究OXTR 对学习记忆的影响,探讨OXTR 对胆碱能通路的调控作用,为认知行为中催产素相关机制的研究提供基础。
1 材料与方法
1.1 材料
1.1.1 实验动物
65 只 SPF 级 3 月龄雌性 SD 大鼠,体重(240 ±10)g,购于济南朋悦实验动物繁殖有限公司【SCXK(鲁)20190003】。饲养在山东第一医科大学动物房【SYXK(鲁)20190022】,12 h 昼夜明暗交替,相对湿度(50 ± 5)%,室温(23 ± 2)℃,动物自由饮水和进食。动物实验经过山东第一医科大学实验动物伦理审查(审批号:2017047),动物管理和使用符合法规要求。
1.1.2 主要试剂与仪器
rAAV9-EGFP-Oxtr-shRNA (以下简称 OXTR-shRNA ) 腺 相 关 病 毒 ( 靶 点 序 列;CGGGTCAGTAGTGTCAAGCTT)由上海吉凯基因化学技术有限公司提供;抗荧光淬灭封片剂(谷歌生物,货号: G1401), 乙酰胆碱转移酶(choline acetyltransferase,ChAT)抗体(Servicebio 公司,货号GB11070,兔源);OXTR 抗体(Bioss 公司,货号 bs-1314R,兔源),Cy3 标记山羊抗兔IgG(Servicebio 公司,货号 GB21303), Cy5 标记山羊抗兔 IgG(Servicebio 公司,货号 GB27303),Ach 酶联免疫吸附测定试剂盒(上海酶联生物科技有限公司,批号m1003048-C)。
台式低温离心机(Eppendorf,德国);Tecan infinite200 酶 标 仪 (TECAN, 瑞 士); 电 子 天 平(Sartorius,德国);制冰机(上海安亭科学仪器厂,中国);涡旋混匀机(海门市其林贝尔仪器制造有限公司,中国);超净工作台(上海海新前医疗器械制造有限公司,中国);Morris 水述宫、明暗箱、TopScan 行为分析系统(CSI,美国);37℃恒温箱(Thermo 科技有限公司);荧光显微镜(Olympus,日本)。
1.2 方法
1.2.1 OXTR 基因沉默大鼠模型的制备和病毒感染效率鉴定
参照作者前期方法[7],大鼠充分麻醉后,固定在脑立体定位仪上,剪掉颅顶毛发,常规消毒头皮,暴露前囟,根据Paxinos 和Watson 的《大鼠脑立体定位图谱》确定的 NBM 坐标点(AP:-1.0 mm,L:± 2.7 mm,V:7.8 mm)调整好钻孔位置(图1),用颅骨钻在进针处钻孔,微量进样器抽取病毒质粒OXTR-shRNA 或空病毒载体 rAAV9-EGFP (ConshRNA)以5 nL/s 的速度注入基底前脑,单侧注射体积 0.2 μL(低、中、高剂量分别为 0.558、1.116、2.232 v.g/mL,用无菌生理盐水稀释),注射完后留针5 min。以同样方法向对侧操作。
分别于注射病毒后的第2、3、4、5 周,麻醉动物,取脑组织,福尔马林固定组织4 ~6 h,30%蔗糖脱水直至脑组织完全下沉,制备冰冻切片,显微镜下观察荧光表达,比较不同剂量和感染时间的病毒感染效率。
1.2.2 OXTR 基因沉默对大鼠学习记忆和胆碱能通路的影响
(1)动物分组:根据随机对照表分组,33 只SD大鼠随机分为3 组:假手术组(Sham)、阴性病毒对照组(Con-shRNA)、OXTR 沉默组(OXTR-shRNA)。其中,假手术组注射生理盐水;Con-shRNA 组注射空病毒载体rAAV9-EGFP;OXTR-shRNA 组选取中剂量病毒注射(1.116 v.g/mL),感染周期3 周(选择依据见结果部分)。手术方法参考模型制备部分。
(2)Morris 水迷宫:实验大鼠进行Morris 水迷宫的装置包括记录系统、黑色圆形水池(直径180 cm,高50 cm)以及平台(直径12 cm,高30 cm)。水池平均分为四象限,平台放入其中1 个象限,没于水面下方1 ~2 cm。测试的前1 d为适应期,先将大鼠放在平台上60 s,然后从不同象限入水,自由游泳120 s,找不到平台的大鼠,人为引导其至平台停留20 s。测试期共连续5 d,每只大鼠每天测试4 次,每次从不同象限入水,记录大鼠找到平台的时间(逃避潜伏期),若大鼠120 s 未找到平台,逃避潜伏期记为120 s,并使其在平台停留20 s。
(3)避暗实验:避暗箱由两个大小完全相同的白色明箱和黑色暗箱组成,底部为可控制电流的电栏栅,两箱中间由电动门连接。实验分为适应、获得和巩固三个阶段。第1 天为适应阶段,电动门打开,电栏栅不通电,将大鼠从明箱放入(每次放入均背朝电动门),让其自由活动90 s,记录第1 次进入暗箱的时间(潜伏期)。第2 天为获得阶段,电动门打开,从明箱放入大鼠,当动物四肢进入暗箱中,关闭电动门,暗箱通电0.2 mA 持续3 s,停留10 s 再次通电0.2 mA 持续2 s,停留10 s 后将大鼠取出。第3 天为巩固阶段,电动门打开,电栏栅不通电,从明箱放入大鼠,让其自由活动90 s,记录第1 次进入暗箱的时间,90 s 未进入则记为90 s。每次实验、每只大鼠完成之后,需用酒精喷洒擦拭干净,再进行下1 只。
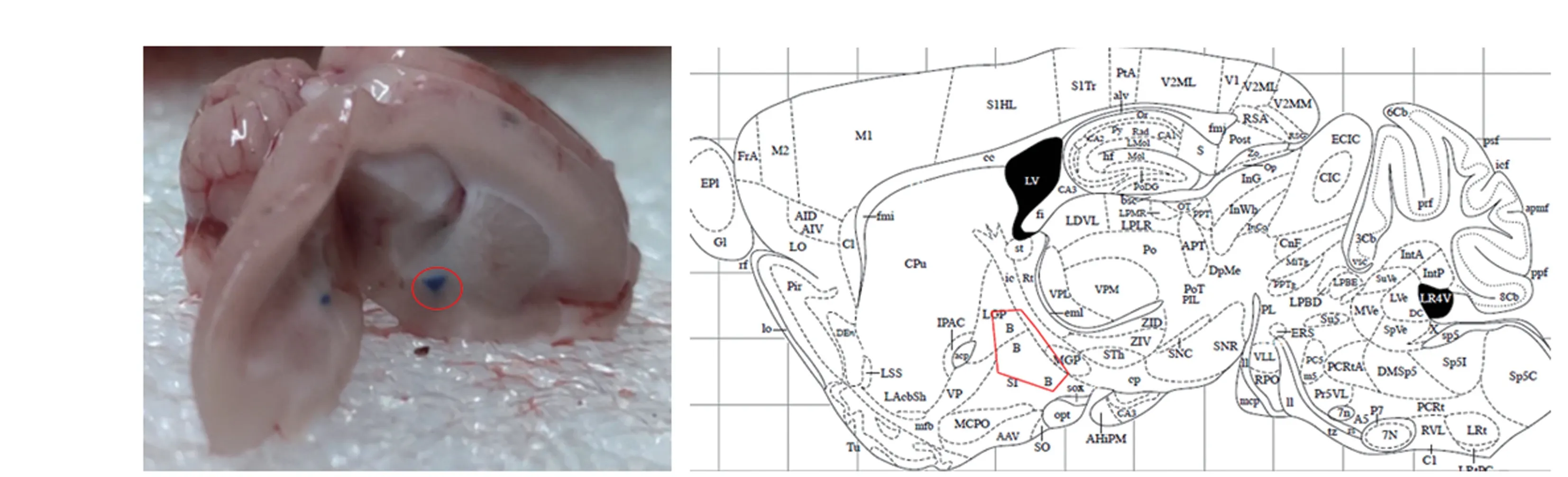
注:大鼠脑组织矢状切面所示的注射点(左,红圈内)与脑矢状面图谱的NBM 脑区(右,红框内)相符。图1 注射位点NBM 区示意图Note. Injection site (left, in the red circle) shown on the sagittal section of the rat brain is consistent with the NBM region(right, in the red box) on the sagittal plane of the brain map.Figure 1 Schematic diagram of the injection site NBM region
(4)脑组织样品处理:行为学测试结束后,禁食12 h,麻醉大鼠,打开胸腔,经心脏灌注0.9%生理盐水,每组随机抽3 ~4 只大鼠用于制备脑组织切片标本,在流出液体变澄清后用福尔马林冲洗,断头分离脑,福尔马林固定,用于制备冰冻切片。其余动物经心脏灌注生理盐水后,分离脑组织,-80℃保存备用。
(5)ELISA 法检测皮质区Ach 含量:操作步骤参照上海酶联生物公司的大鼠Ach ELISA 试剂盒说明书。
(6)免疫荧光法检测NBM 区OXTR 和皮质区ChAT 蛋白表达:将冰冻切片于磷酸盐缓冲液(phosphate buffer solution,PBS)中室温平衡15 min,弃PBS,加封闭用血清室温孵育1 h;去封闭液,加一抗(OXTR 稀 释比 例 1 ∶ 100, ChAT 稀释比 例1 ∶3000),4℃孵育过夜;吸出一抗,PBS 漂洗,加荧光标记的二抗(OXTR 对应使用Cy3 标记山羊抗兔IgG,稀释比例1 ∶300;ChAT 对应使用 Cy5 标记山羊抗兔IgG,稀释比例1 ∶300),37℃恒温摇床上避光孵育1 h;PBS 漂洗,DAPI 复染细胞核;PBS 漂洗,将切片贴在载玻片上,滴加防荧光淬灭封片剂,盖玻片封片,荧光显微镜观察荧光表达。
1.3 统计学分析
使用IBM SPSS Statistics 20 软件分析数据,所有数据均平均值± 标准差(¯x ±s)表示。水迷宫逃避潜伏期采用一般线性模型中重复测量的方差分析(Repeated Measures ANOVA)进行处理,分析1 ~5 d 各组间逃避潜伏期是否具有统计学差异,在差异具有统计学意义的前提下,采用 LSD(Leastsignificant Difference)法进行组间两两比较(post hoc multiple comparison)。避暗实验中的潜伏期和皮质Ach 数据分析采用单因素方差分析,P< 0.05 为差异具有统计学意义。
2 结果
2.1 OXTR-shRNA 感染大鼠NBM 区的效率呈剂量和时间依赖性
基底前脑 NBM 区注射不同量 OXTR-shRNA后,低剂量组在第2、3、4 周时未观察到明显EGFP荧光表达,在第5 周时见少量EGFP 阳性细胞;中、高剂量组在第2 周时可见少量EGFP 阳性细胞,第3周时EGFP 阳性细胞增多,第4、5 周时 EGFP 表达量均明显增多(图2)。

图2 NBM 区注射病毒后的感染效率Figure 2 Efficiency of virus infection in the NBM region after injection
2.2 中剂量OXTR-shRNA 感染大鼠NBM 区3 周后对OXTR 的沉默效果
通过对不同剂量OXTR-shRNA 感染大鼠NBM区的观察,选择中剂量OXTR-shRNA 感染3 周作进一步研究。免疫荧光染色结果显示,OXTR-shRNA组OXTR 阳性表达比假手术组和Con-shRNA 组减少(图3)。
2.3 沉默大鼠NBM 区OXTR 可影响学习记忆
各组大鼠的逃避潜伏期随着训练天数的增加呈现缩短趋势。OXTR-shRNA 组第5 天逃避潜伏期比假手术组和阴性对照病毒组延长,差异具有统计学意义(P< 0.05)(图4)。
在避暗实验中,各组大鼠在适应阶段进入暗箱的潜伏期之间的差异无显著性(P> 0.05);在巩固阶段,假手术组和阴性对照病毒组大鼠进入暗箱的潜伏期延长,OXTR-shRNA 组大鼠进入暗箱的潜伏期与适应阶段无明显差异,并且低于假手术组和阴性对照病毒组,具有显著性差异(P<0.01)(图5)。
2.4 沉默大鼠NBM 区OXTR 可降低皮质区Ach水平
OXTR-shRNA 组皮质中Ach 浓度比假手术组和阴性对照病毒组减少,且差异具有统计学意义(P<0.05)(图6)。
2.5 沉默大鼠 NBM 区 OXTR 可下调皮质区ChAT 蛋白表达
图7 为各组大鼠皮质区ChAT 免疫荧光染色结果,OXTR-shRNA 组ChAT 阳性表达量比假手术组和Con-shRNA 组少,荧光强度弱。
注:红色荧光表示OXTR 阳性,蓝色荧光为DAPI 表示细胞核。图3 大鼠基底前脑NBM 区OXTR 表达Note. Red fluorescence indicates OXTR-positive, blue fluorescence indicates DAPI (nucleus).Figure 3 Expression of OXTR in the NBM region of basal forebrain in rats

注:假手术组n=10;阴性对照组n=9;OXTR 沉默组n=12;与假手术组、阴性对照组相比,#P< 0.05。(下图同)图4 水迷宫实验中各组大鼠逃避潜伏期变化Note. Sham group n=10. Con-shRNA group n=9. OXTR-shRNA group n=12. Compared with sham group and con-shRNA group, #P< 0.05. (The same in the following figures)Figure 4 Escape latency in the water maze test
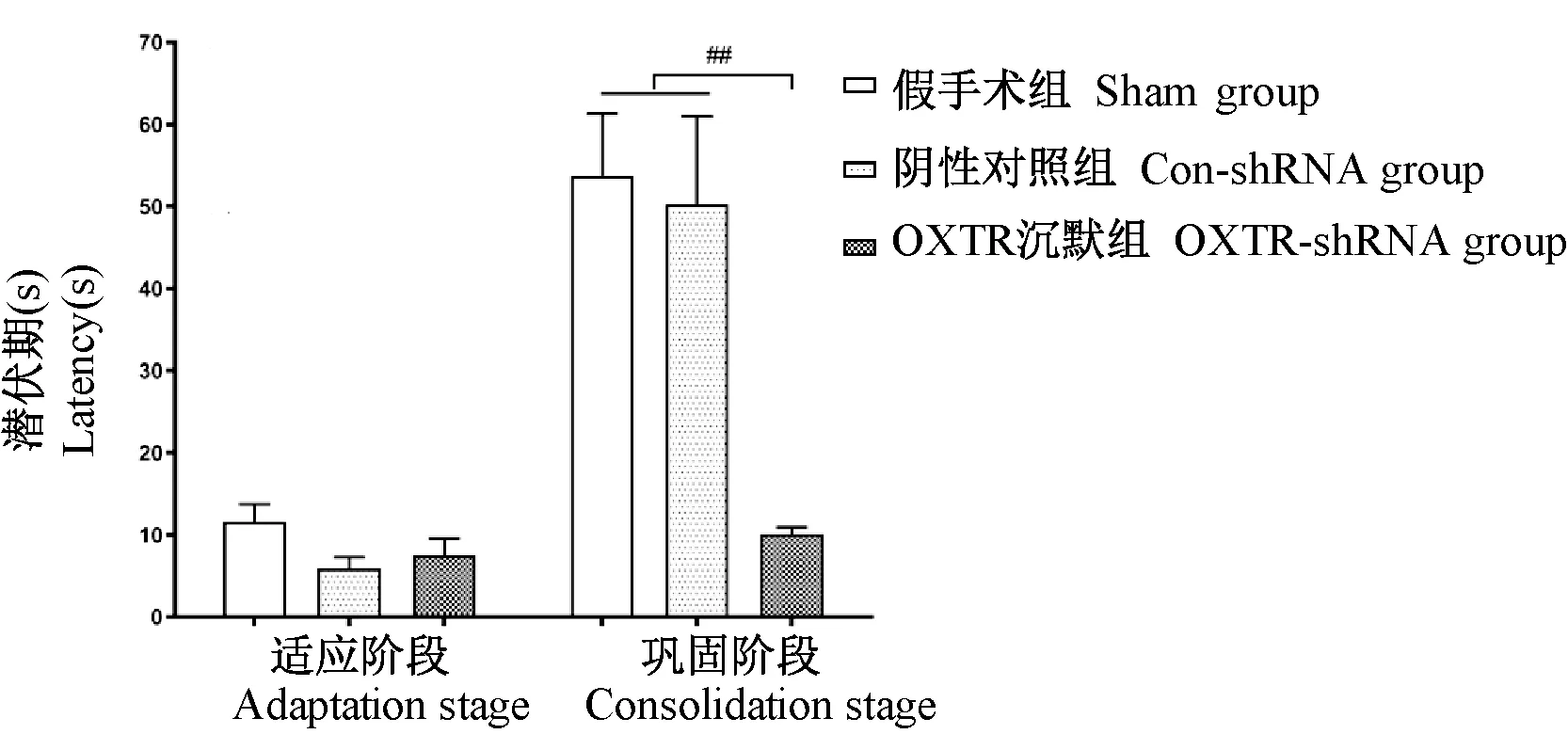
注:假手术组n=10;阴性对照组n=9;OXTR 沉默组n=12;与假手术组、阴性对照组相比,##P< 0.01。图5 避暗实验中各组大鼠进入暗箱潜伏期Note. Sham group n=10. Con-shRNA group n=9. OXTR-shRNA group n=12. Compared with sham group and conshRNA group, ##P< 0.01.Figure 5 Latency to enter the dark chamber in the ligth-dark box test
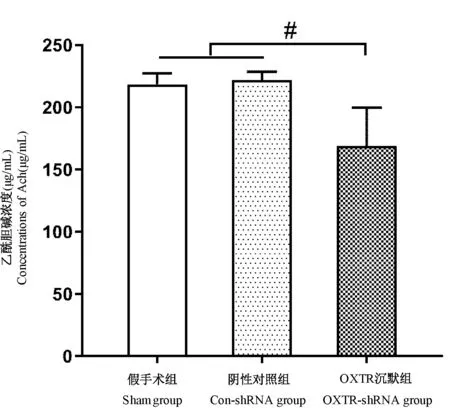
图6 各组大鼠皮质区Ach 水平(n=6)Figure 6 Ach levels in the cortex of rats(n=6)

注:粉色荧光表示ChAT 阳性,蓝色荧光为DAPI 表示细胞核。图7 大鼠皮质区ChAT 表达Note. Pink fluorescence indicates ChAT-positive, blue fluorescence indicates DAPI (nucleus).Figure 7 Expression of ChAT in the cortex of rats
3 讨论
AD 是一种慢性进行性神经系统变性疾病,为常见的痴呆类型,其发病率逐年增加。胆碱能系统损伤是AD 发病机制的核心,可表现为乙酰胆碱大量降解等,进而引起和促进一系列病理变化,最终导致AD 复杂多样的病理特征和临床表现。因此,临床上用于治疗AD 的一线药物主要是拟胆碱药物,但其治疗效果并不理想。由于AD 发病机制较为复杂,单独采用拟胆碱药物治疗不能达到理想的效果,多靶点治疗可能更有利于改善AD[8]。胆碱能通路并不是单独运作的,因此阐明胆碱能通路与其他通路之间的关联将有助于发现协同治疗AD 的靶点。Freeman 等[5]发现,在胆碱能神经元分布的脑区(包括基底前脑NBM 区和脚桥被盖核),OXTR特异性表达。另外,胆碱能投射靶区海马和皮质也有催产素能神经纤维的传入[2,6],提示胆碱能通路可能与催产素受体通路具有潜在关联。因此,本实验建立了NBM 区OXTR 基因沉默的大鼠模型,阐明OXTR 对胆碱能通路和认知行为的影响。
rAAV 载体可在体内外有效介导外源基因长期稳定表达,不同血清型的组织的特异性不同,其中rAAV9 具有较好的脑组织靶向性[9]。因此,选取rAAV9 提高其转导效率。通过对NBM 区注射不同量OXTR-shRNA 后不同感染周期的观察发现,中剂量OXTR-shRNA 感染3 周后EGFP 阳性细胞表达明显,提示该条件下已经可以达到较好的感染效果。第4、5 周时中、高剂量组的EGFP 阳性表达增多,说明病毒的感染效果较为稳定且可维持较长时间,为开展成模后的进一步研究提供了时间上的保障。当采用中剂量 OXTR-shRNA 感染 NBM 区3 周后,感染部位OXTR 表达下降,提示 OXTR 被敲低。而且,沉默NBM 区OXTR 对大鼠的空间学习记忆和恐惧记忆均产生了损害,表明该模型大鼠表现出类似于AD 的行为表型。
皮质是基底前脑NBM 区胆碱能神经元投射的靶区。通过检测皮质区Ach 水平和Ach 的合成酶ChAT 的表达情况,发现沉默NBM 区OXTR 使皮质中Ach 水平和ChAT 表达均减少,提示OXTR 可能影响了NBM-皮质环路的胆碱能神经元,进而对动物的学习记忆产生损伤,进一步证实沉默基底前脑NBM 区OXTR 基因可模拟AD 的典型病理变化,提示其作为AD 动物模型的可行性。
AD 患者常伴有不同程度的神经精神症状,如淡漠、抑郁、睡眠障碍等[10-11]。针对神经精神症状的治疗在一定程度上有利于改善AD 患者的认知功能[12],或者延缓 AD 的进程[13]。可见,综合治疗可能更有利于改善AD。基底前脑-皮质胆碱能神经环路不仅与学习记忆密切相关,也与焦虑、睡眠等行为相关[14]。由于OXTR 在胆碱能神经元分布的脑区有较高的特异性表达[5],OXTR 也参与调节恐惧记忆、抑郁等精神行为[15-16]。因此,综合解剖学和功能学,通过调控OXTR 介导的精神行为可能会进一步影响认知功能。综上,催产素受体-胆碱能通路可能是治疗AD 的潜在复合靶点,但其深入机制有待后续研究。
