iTRAQ 法分析增龄雌性小鼠肝蛋白组学变化
2021-05-20朱明雪匡海学兰辛键梁华
朱明雪匡海学兰辛键梁华∗
(1. 黑龙江中医药大学,哈尔滨 150040; 2. 大连大学,辽宁大连 116622; 3. 长春中医药大学,长春 130117)
增龄是指机体在成熟期以后,随着年龄增加所致的衰老表现。人口老龄化的急剧增加和低出生率迅速推动了社会老龄化,并增加了与老龄化相关的神经退行性疾病[1],但人类对衰老机制的研究从未间断。蛋白质组的研究不仅能为生命活动规律提供物质基础[2],也能为众多种疾病机理的阐明及攻克提供理论根据和解决途径[3],亦可为中医学证候的客观化研究及病证结合研究提供新的方法和手段[4-5]。基于蛋白质组学筛选不同月龄小鼠的差异蛋白,有助于阐明衰老机制及发现潜在的标志物,为衰老的预防及增龄性疾病的诊断和治疗具有重要意义。因此,本研究使用同位素标记的相对与绝对定量(iTRAQ 法)、LC-MS 及生物信息学分析12月龄、3 月龄雌性小鼠间差异蛋白,并深入挖掘、研究,为衰老的预防及增龄性疾病的诊断和治疗提供新的分子靶位。
1 材料与方法
1.1 材料
1.1.1 实验动物
无特定病原体 SPF 级 ICR 小鼠,3 月龄(20 ±2)g、12 月龄(35 ± 2)g 雌性小鼠各 10 只,购自辽宁长生生物技术有限公司,实验动物生产许可证号【SCXK(辽)2020-0002】。饲养期间小鼠自由摄食、饮水,饲喂普通固体饲料,由哈尔滨市南岗区玉英养殖厂提供。实验地点黑龙江中医药大学研究楼负一层屏障环境,使用许可证号【SYXK(黑)2016-004】,饲养环境:室内昼夜自然明暗交替照明,室温(22 ± 2)℃,湿度(55% ± 20%),空气新鲜。所有操作均符合黑龙江中医药大学实验伦理要求(审批号:2014120101)。
1.1.2 主要试剂与仪器
胞质和线粒体蛋白质提取试剂盒(生工生物工程,中国),BCA 蛋白浓度测定试剂盒(碧云天生物技术,中国),iTRAQ 标记试剂盒(AB SCIEX,美国), 小鼠抗细胞色素 c 单克隆抗体( BD Pharmingen,556433,美国),鼠源性抗GAPDH 单克隆抗体(Sigma 技术有限公司,G8795-100UL,美国),β-Actin (8H10D10) Mouse mAb (Cell signaling,3700S,美国),DTT(Sigma 技术有限公司,美国),SDS(Sigma 技术有限公司,美国),Tris(上海双向西巴斯科技发展有限公司,中国),30% Acrylamide/Bis Solution 29 ∶1(Bio-Rad,美国),TEMED(Bio-Rad,美国),过硫酸铵(Sigma 技术有限公司,美国),COX IV (3E11) Rabbit mAb(Cell signaling,4850S,美国),IAA(Sigma 技术有限公司,美国),TEAB(Sigma技术有限公司,美国),ACN(Merck KguA Darmstadt,德国),氨水(Acros Organics,美国),甘油、乙醇、乙腈、乙酸、甘氨酸、溴酚蓝(国药试剂,中国),生理盐水(哈尔滨三联药业有限公司,中国)。
Mili-Q 超纯水系统(Millipore,美国),蛋白电泳仪(Bio-Rad,美国),安捷伦液相色谱仪1290 Infinity(Agilent Technologies,美国),Waters Xbridge BEH C18 2.5 μm 3.0 × 100 mm Column XP (Waters Corporation,美国),Easy-nLC 1000 纳升级液相色谱仪(Thermo scientific,美国),Obritrap Elite 组合式质谱仪(Thermo scientific,美国)。
1.2 方法
1.2.1 样品处理
将各组小鼠劲椎脱位法处死后迅速摘取其肝,称其湿重,用胞质和线粒体蛋白质提取试剂盒提取肝微粒体,基于色氨酸浓度的荧光分光光度法检测蛋白质浓度,聚丙烯酰胺凝胶电泳进行样品完整性检测,具体步骤均参照说明书。
1.2.2 蛋白质酶解
采用蛋白滤膜辅助酶解(FASP)方法[6],制取肽段。
1.2.3 iTRAQ 标记
按照AB SCIEX 公司iTRAQ 标记试剂盒使用说明书操作,每组样品各取20 μg,用于iTRAQ 标记。
1.2.4 肽段分级
选用Easy-nLC 1000 纳升级液相色谱仪,Waters Xbridge BEH C18 2.5 μm 3.0 × 100 mm Column XP的分离柱对样品进行分离,得到22 个组分。将样品冻干后用0.1%的甲酸复溶合并为若干份。
1.2.5 LC-MS 分析
采用Easy nLC1000 和orbitrap Elite 液质联用平台对iTRAQ 标记样品进行数据采集。运用Obritrap Elite 进行质谱分析,所有数据采集均基于Xcalibur软件平台进行。
1.2.6 生物信息学分析
将质谱检测的原始数据通过Maxquant 网站中的Uniprot release 2016_07(www.uniprot.org)数据库进行检索,将数据归一化处理后,利用gene ontology数据库、KEGG 数据库、STRING 数据库、经 R studio软件对鉴定到的蛋白进行功能注释、生物通路信息分析,以及蛋白质-蛋白质相互作用网络构建(PPI)。
2 结果
2.1 蛋白质定量分析结果
蛋白质含量与色氨酸的含量成正线性相关关系,通过测定蛋白质样品中的色氨酸含量,计算蛋白质的浓度。色氨酸定量标准曲线见图1,根据样品测得的吸光度计算出3 月雌鼠蛋白质含量为16. 02 μg/μL,12 月雌鼠蛋白质含量为14. 94 μg/μL。
2.2 样品完整性检测结果
经SDS-PAGE 凝胶电泳分析得出蛋白质抽提定量后的跑胶质量控制结果。由图2 可见,蛋白质电泳结果条带清晰,定量较为整齐,降解较少。
2.3 蛋白质鉴定结果
经数据库检索后,筛选出12 月与3 月雌鼠对比鉴定到蛋白数3079 个。使用Significant B 算法利用余补误差函数,筛选Significant B 值的分层(sign.level)≥2,即P< 0.05 者为差异蛋白,差异蛋白数369 个,其中182 个表现为上调,187 个表现为下调。部分差异蛋白见表1(P< 0.01,蛋白信号质谱检测强度分层(int.level)≥9)。
2.4 差异蛋白GO 注释富集分析
通过对差异表达蛋白(DEP)进行GO 功能注释(见图3),从分子功能(MF)、生物过程(BP)、细胞组成(CC)三方面进行分析,发现DEP 主要涉及氧化还原、脂类生物合成、类固醇生物合成及代谢、大分子复合亚基组织、辅因子代谢过程、脂肪酸代谢过程等分子功能,细胞定位主要在线粒体、内质网等部位。
2.5 KEGG 信号通路分析
通过对差异蛋白进行KEGG 通路富集分析,发现差异蛋白参与的通路包括类固醇生物合成、药物代谢、P450 细胞色素P450 对外源性药物代谢的影响、氧化磷酸化、视黄醇代谢、丙酸酯代谢、柠檬酸循环等(见图4)。
2.6 核心DEP 的PPI 网络构建
特异蛋白相互作用关系采用STRING 数据库进行构建差异表达蛋白的子网络。筛选出241 个DEP节点(Significant B < 0.05),本项目将Significant B< 0.01 定义为核心DEP,共计55 个DEP 节点,其可交互式网络图(见图5)。经筛查,核心DEP 中与增龄相关的差异蛋白共13 个(见表2)。
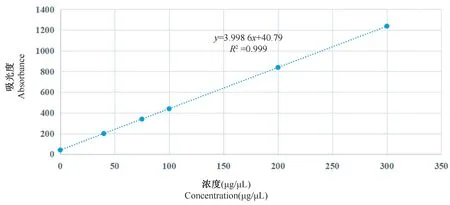
图1 色氨酸定量标准曲线Figure 1 Standard curve for tryptophan quantification

图2 肝微粒体蛋白完整性检测结果Figure 2 Detection results of liver microsomal protein integrity

表1 部分差异蛋白信息Table 1 Some information about the different proteins

表2 核心DEP 中与增龄相关的差异蛋白Table 2 Differential age-related proteins in core DEP

图3 GO 分析 DEP 在 BP、CC、MF3 个方面的分布Figure 3 Go Analysis of the distribution of DEP in BP, CC and MF3

图4 差异蛋白KEGG 通路分析Figure 4 Analysis of differential protein KEGG pathway

注:红色节点表示上调表达,蓝色节点表示下调表达,节点大小表示该节点再改组对比中的差异显著程度;边长度表示综合打分,成反比关系。图5 核心DEP 可交互式网络图Note. The red node indicates up expression, the blue node indicates down expression, the size of the node indicates the significant difference in the comparison of the node reorganization, and the side length indicates the comprehensive score, which is inversely proportional.Figure 5 Core DEP interactive network diagram
3 讨论
3-keto-steroid reductase/17-beta-hydroxysteroid dehydrogenase 7 蛋白编号 O88736, 编码基因Hsd17b7,涉及类固醇激素代谢和胆固醇生物合成的双功能[7]。Hsd17b7 参与角鲨烯后胆固醇的生物合成,从而完成了该中央代谢途径的所有基因的分子克隆,它作为胆固醇生物合成的3-酮类固醇还原酶,是胆固醇代谢先天缺陷的新候选者[8]。Matsuoka 等[9]人研究发现,Hsd17b7 蛋白水平、活性程度可影响卒中型自发性高血压模型大鼠胆固醇的含量。与3 月龄雌鼠相比,12 月龄雌鼠O88736呈升高趋势,说明小鼠体内的胆固醇水平与其月龄呈正相关。
蛋白编号为 Q64481、Q6XVG2、P12791、Q8K0C4的蛋白,均属于细胞色素P450 氧化还原酶,是一组血红素硫醇单加氧酶,在许多组织中存在,在激素合成和分解,胆固醇代谢、维生素D 代谢中有重要作用[10]。同时,细胞色素P450 酶类在体内毒素包括药物、内源代谢产物,主要是肝中胆红素的代谢中起作用。在肝微粒体中,该酶参与NADPH 依赖性电子转运途径。细胞色素P450 2E1(CYP2E1)被认为是氧化应激相关代谢性疾病的分子靶点[11]。与3 月龄雌鼠相比,12 月龄雌鼠Q64481、Q6XVG2、P12791 呈下降趋势,胆固醇代谢降低;Q8K0C4 呈上升趋势,胆固醇生物合成加快,导致体内的胆固醇数量增多。
实验表明,以人类年龄计算实验动物年龄,小鼠的整个生命周期约为730 d,生殖衰退期节点为其出生后的450 d,老年期持续时长为280 d[12],故12月雌鼠处于生殖衰退阶段,即卵巢功能衰退阶段,此阶段是心血管疾病的独立危险因素[13]。以上5个核心差异蛋白的发掘,说明增龄小鼠患动脉粥样硬化或血管变窄,诱发心脏病发作或中风等严重疾病的几率升高,其可能为衰老导致的血管病变性疾病的分子靶位。
蛋 白 编 号 P63028, 编 码 基 因 Tpt1,Translationally-controlled tumor protein,翻译控制肿瘤蛋白(TCTP),在调节细胞生长和体内平衡中发挥多种作用。研究表明,TCTP 在肝癌组织中显著高表达,对AKT 和ERK 通路的磷酸化激活有重大作用[14],且通过激活mTORC2/AKT 信号通路促进肝再生[15]。TCTP 具有抗凋亡活性和调控肿瘤转移的作用,已成为肿瘤治疗的一个有前景的靶点[16]。蛋白编号Q62433,Protein NDRG1,肿瘤转移抑制因子,编码基因NDRG1,参与上皮细胞分化,受雄激素调控表达[17],并与p53 蛋白的积累和活动引起细胞凋亡有关。衰老是肿瘤发生的一个重要风险因素,肿瘤发生一定程度上是衰老的自然结果[18]。本实验中与3 月龄小鼠相比,12 月龄小鼠P63028 升高、Q62433 降低,说明随着小鼠月龄的增长,小鼠患有肿瘤的概率升高,其可能为衰老导致的肿瘤性疾病的分子靶位。
研究发现,衰老、神经退行性疾病和代谢疾病都与线粒体相关联[19],且内质网与线粒体的接触决定着线粒体的复制、分裂和分布[20]。而本实验的差异蛋白细胞定位主要在线粒体、内质网等部位,亦验证了以上结论。
综上所述,本研究基于 iTRAQ 法对3 月、12 月雌性小鼠肝微粒体蛋白进行检测分析,发现不同月龄小鼠与增龄性改变相关的关键蛋白和主要信号通路,与胆固醇合成升高、代谢降低及TCTP 升高、肿瘤转移抑制因子降低有关。该研究有助于阐明衰老机制及发现潜在的标志物,为衰老的预防及增龄性疾病的诊断和治疗提供新的分子靶位。
