肿瘤坏死因子受体超家族成员4(TNFRSF4)敲除和人源化小鼠模型的建立
2021-05-20黄艺滢白琳雷雪裴李珂雅李欣悦侯丽雅石桂英
黄艺滢白琳雷雪裴李珂雅李欣悦侯丽雅石桂英
(国家卫生健康委员会人类疾病比较医学重点实验室,中国医学科学院医学实验动物研究所,北京协和医学院比较医学中心,北京市人类重大疾病实验动物模型工程技术研究中心,北京 100021)
目前免疫检查点阻滞剂在肿瘤免疫治疗中受到很大关注, 靶向程序性细胞死亡蛋白 1(programmed cell death,PDCD1)和细胞毒T 淋巴细胞相关蛋白4 (cytotoxic T-lymphocyte associated protein 4,CTLA4)的治疗剂的成功为癌症治疗策略提供了更多的选择[1-2]。然而,尽管此疗法在一些患者中能够消除肿瘤并实现患者的长期生存,但并非对所有患者都有效果[3],许多患者对基于免疫检查点阻断的单一药物治疗有抗药性[4]。因此,具有不同作用机制或不同靶点的新型免疫调节药物亟待开发[5-6]。肿瘤坏死因子受体超家族成员 4(tumor necrosis factor receptor superfamily member 4,TNFRSF4)(也称为OX40 或 CD134)是 TNF 受体超家族的一员,在活化的T 细胞上高度表达,有一个已知配体TNFSF4(也称为OX40 L 或CD252),主要在活化的抗原呈递细胞上表达[7-8]。TNFRSF4 与配体结合并激活后,T 细胞中的下游细胞内信号通路激活,导致核因子 κB(nuclear factor-kappa B,NF-κB)的转录激活[9]。目前,在早期癌症临床试验中测试了几种anti-TNFRSF4 激动性单克隆抗体,越来越多的临床前证据支持其临床发展[4]。人类和小鼠的TNFRSF4 只具有69.17%的同源性,为进一步研究TNFRSF4 相关药物,使用TNFRSF4 人源化小鼠是更好的选择。
采用CRISPR/Cas9 的方法将人源TNFRSF4 基因导入到小鼠的受精卵中,同时敲除小鼠内源TNFRSF4 基因的表达。TNFRSF4 人源化小鼠(TNFRSF4h/h)及TNFRSF4 敲除小鼠(TNFRSF4-/-)表型正常。通过建立基因结构和调节方式与人类相似的模型,改善TNFRSF4 在人与小鼠中种属差异导致的在临床测试与动物实验结果差异,从而使药物评价的结果更加客观。
1 材料与方法
1.1 材料
1.1.1 实验动物
SPF 级 C57BL/6 J(雌性,3 ~ 4 周龄,30 只,7~ 12 g;雄性,8 周龄,30 只,19 ~ 25 g)及 ICR 小鼠(雌性,8 ~ 10 周龄,8 只,25 ~ 33 g),购自北京华阜康生物科技股份有限公司【SCXK(京)2020-0004】并在本所SPF 级动物屏障环境动物房【SYXK(京)2019-0014】中长期饲养繁殖。实验中繁殖产生TNFRSF4h/h和TNFRSF4-/-及其野生型小鼠,其中各10 只用于实验。饲养环境:温度20 ~26℃,湿度40% ~70%,光照周期明暗比12 h:12 h。饲养期间小鼠自由进食饮水,垫料、鼠盒、水瓶、均经过高温高压灭菌处理。涉及动物操作程序和动物实验经本所动物使用与管理委员会(IACUC)批准(批准号:BL18003)。
1.1.2 主要试剂与仪器
载 体 构 建: 试 剂 盒 MEGAshortscriptTMT7 Transcription Kit ( Ambion, Am1354 ); 试 剂 盒mMESSAGE mMACHINETMT7 ULTRA Transcription Kit(Ambion,Am1345);基因 型 鉴 定:EasyPure ®Genomic DNA Kit(Transgen,EE101-12);鼠尾直接PCR 试剂盒(Bimake,B45012);细胞培养:MEM 培养基(Gibco,12571063)、胎牛血清(Gibco,10099141C)、青链霉素(Gibco,15140122)、CD3 抗体(Santa,sc-20047);RT-PCR:TRIzol(Invitrogen,15596018);反转录试剂盒(Thermo,K1682);流式细胞术:红细胞裂解液(BD,555899);抗 体:CD4、B220、CD8、CD11b、NK1.1、CD3、TNFRSF4(Invitrogen)。
多样品研磨珠均质仪(OMNI,Bead Ruptor 24 Elite);电泳仪(Bio-Rad);PCR 仪(Hema);细胞培养箱(Thermo);流式细胞仪(BD FACSAria);组织脱水机、石蜡包埋机、石蜡切片机(德国Leica)。
1.2 方法
1.2.1 载体构建
小鼠TNFRSF4 基因位于第四号染色体的4E2区段(Chromosome 4: 156,013,843-156,016,612,ENSMUSG00000029075)。针对该基因,设计并合成一对向导RNA(single-guide RNA,sgRNA)作用靶点(上海英潍捷基),分别为靶点 1 ∶5’-CCTGTC CGCCTACTCTTCTTG-3’ (寡 核苷 酸序列 为: m-TNFRSF4-gRNA UP1 ∶5’-TAGGCAAGAAGAGTAG GCGGAC-3’ 和 m-TNFRSF4-gRNA DOWN1 ∶5’-AAACGTCCGCCTACTCTTCTTG-3’) 和靶点 2 ∶5’-CTTTGAGATGTAGTGGCCGGG-3’ (寡核苷酸序列为:m-TNFRSF4-gRNA UP2 ∶5’-TAGGCTTTGAGAT GTAGTGGCC-3’和 m-TNFRSF4-gRNA DOWN2 ∶5’-AAACGGCCACTACATCTCAAAG-3’)。克隆测序结果正确的用于后续实验。将合成的 TNFRSF4 sgRNA 单链通过退火复性结合成小片段。用Bsa I酶切pUC57-sgRNA 表达载体使其线性化,然后与TNFRSF4 sgRNA 双链进行连接。
构建完成的sgRNA 载体和pST1374-NLS-flaglinker-Cas9 载体分别利用试剂盒 T7 Transcription Kit 或T7 ULTRA Transcription Kit 通过体外转录成为可注射的sgRNA 和Cas9-RNA。
1.2.2 显微注射
将sgRNA 与Cas9-RNA 混合,用显微注射法注射于C57 小鼠受精卵中,用ICR 雌鼠作为假孕受体,将注射后的受精卵移植到受体鼠输卵管壶腹部,等待小鼠出生。
1.2.3 基因型鉴定
小鼠出生后进行编号,并取尾尖进行鉴定。使用EasyPure® Genomic DNA Kit 提取基因组 DNA,根据人源化小鼠序列信息分别设计2 对人源化及1对野生检测引物(上海英潍捷基),2 对人源化检测引物分别为:M-TNFRSF4-UP-S:5’-CAACACCATG CAGCTCACAACTGCC-3’, M-TNFRSF4-UP-A: 5’-TGTCCTCACAGATTGCGTCC-3’(产物 1451 bp)和M-TNFRSF4-DOWN-S:5’-CAGAAGTGGGAGTGAGC GG-3’,M-TNFRSF4-DOWN-A:5’-TCTGCTTGAGTT CACTTCCACTTC-3’(产物1696 bp),可以分别检测转入人源TNFRSF4 基因的上游和下游;1 对野生引物为 M-TNFRSF4-WT-S: 5’-GTTCACCACTGCCTA TAACTCTAGCTC-3 ’ 和 M-TNFRSF4-WT-A: 5 ’-CTTCATTGTAGAAGCCAGTCTCACAC-3’,检测鼠源TNFRSF4 基因。使用2 对人源化检测引物时,人源化小鼠子代PCR 产物中TNFRSF4 人源基因上下游表达,且大小正确,则小鼠含有该人源基因且插入位置正确,为杂合或纯合小鼠,若同时使用野生引物检测未表达鼠源TNFRSF4 基因(产物886 bp),则为人源化纯合小鼠。
根据敲除小鼠序列信息设计1 对敲除引物为M-TNFRSF4-KO-F:5’-TGCCTGTCCGCCTACTCTTC-3’和 M-TNFRSF4-KO-R:5’-CTTTCAAACCCCTACC CTATACTTCTG-3’,检测敲除小鼠基因型。使用敲除引物时,小鼠子代PCR 产物中若含有1964 pb 的片段,则小鼠含有正常鼠源TNFRSF4 基因,若含有503 bp 的片段,则小鼠含有敲除后的TNFRSF4 基因,敲除小鼠子代若只含有敲除后的TNFRSF4 基因而无正常鼠源基因,则为纯合敲除小鼠。
使用鼠尾直接PCR 试剂盒进行PCR,扩增程序为 95℃ 15 min;(95℃ 30 s,62℃ 30 s,72℃ 2 min)×30 循环;72℃ 10 min。使用1.5%的琼脂糖凝胶进行电泳。随后,选取包含突变的PCR 产物进行TA克隆,并进行测序分析,确定DNA 缺失片段信息。
1.2.4 逆转录PCR(reverse transcription-polymerase chain reaction,RT-PCR)检测 TNFRSF4 mRNA 在小鼠各组织中的表达
取后续繁育的雌性TNFRSF4 人源化小鼠纯合(TNFRSF4h/h)(3 月龄)及其同窝野生(TNFRSF4m/m)各1 只,取心、肝、脾、肺、肾、胸腺、脑、骨髓,用 TRIzol分离总RNA,并使用反转录试剂盒获得cDNA。根据序列信息分别设计 1 对人源及 1 对小鼠源TNFRSF4 mRNA 检测引物(上海英潍捷基),分别为hTNFRSF4-F:5’-TGGGCCTGGGGCTGAGC-3’,hTN FRSF4-R:5’-TTGTAGCTGTCCAG GGGCTGG-3’,TM为65℃,产物 304 个碱基对;和 mTNFRSF4-F:5’-CATCCGTGTGAGACTGGCTT-3’,mTNFRSF4-R:5’-AGCTGTTTCCCCAACAAGGT-3’,TM 为 60℃,产物580 个碱基对。并设计一对内参检测引物β-actin-F:5’-TGCTGTCCCTGTATGCCTCT-3’,β-actin-R:5’-TTGATGTCACGCACGATTTC-3’,TM 为 60℃,产物223 个碱基对。
1.2.5 HE 染色检测淋巴细胞在各组织中的分布
选用3 月龄的TNFRSF4h/h雄性小鼠和同窝TNFRSF4m/m小鼠、2 月龄TNFRSF4-/-雄性小鼠和同窝TNFRSF4+/+小鼠各2 只,福尔马林固定24 h 以上,取心、肝、脾、肺、肾、胸腺、脑、骨髓脱水、包埋、切片,最后进行HE 染色。
1.2.6 流式细胞术检测小鼠外周血中各类细胞的比例
TNFRSF4h/h小鼠7 只和同窝TNFRSF4m/m小鼠5只,取外周血100 μL(EDTA 抗凝),使用红细胞裂解液去除红细胞。每管血中加入40 μL PBS + CD4(FITC)、NK1.1(PE)、CD3(PerCP-Cy5.5)、B220(PE-Cy7)、CD8(APC)、CD11b(APC-Cy7)小鼠单克隆抗体各 0.5 μL。避光 4℃孵育 30 min,PBS 洗 3次,1500 r/min 离心 5 min,200 μL PBS 重悬,使用流式细胞仪分析染色细胞,FlowJo 软件计算细胞表面抗原阳性表达率。
1.2.7 流式细胞术检测TNFRSF4 在基因敲除小鼠脾中的表达
取TNFRSF4 敲除小鼠纯合(TNFRSF4-/-)及其同窝野生型(TNFRSF4+/+)小鼠各2 只(2 月龄,雌雄各半),获取脾细胞后用MEM 培养基加入10%胎牛血清和1%青链霉素,在37℃及5% CO2环境中培养,并用 CD3 抗体(0.1 μg/mL)刺激培养 4 d。每管血中加入 40 μL PBS、CD4(FITC)、CD3(PerCPCy5.5)、TNFRSF4(PE-Cy7)、CD8(APC)小鼠单克隆抗体各 0.5 μL。避光 4℃孵育 30 min,PBS 洗 3次,1500 r/min 离心 5 min,200 μL PBS 重悬,使用流式细胞仪分析染色细胞,FlowJo 软件计算细胞表面抗原阳性表达率。
2 结果
2.1 表达载体的构建
pUC57-sgRNA 表达载体经Bsa I 酶切线性化,合成的TNFRSF4 sgRNA 双链的粘性末端与表达载体Bsa I 酶切后的粘性末端相匹配,两者连接,成功构建TNFRSF4 sgRNA 表达载体,经测序验证序列正确。
2.2 TNFRSF4 敲除及人源化小鼠的构建
按照实验方案(图1),将转录后的sgRNA 和Cas9 mRNA 混合后通过显微注射技术注射到C57小鼠受精卵中,移植到ICR 假孕鼠子宫内,第1 批出生23 只幼仔,第 2 批出生22 只幼仔,使用 PCR 进行基因型鉴定。根据PCR 结果,选取分子量不同于野生型条带的 PCR 产物测序并与野生型小鼠TNFRSF4 基因序列比较。结果显示,第1 批小鼠中,2#,7#小鼠发生基因敲入,第2 批小鼠中,7#小鼠发生基因敲除。将F0 代小鼠与C57 小鼠进行杂交,获得杂合子TNFRSF4h/m或TNFRSF4+/-,将杂合子互交并将子代进行基因型鉴定(图2),得到纯合敲入或敲除小鼠TNFRSF4h/h或TNFRSF4-/-。
2.3 TNFRSF4 敲除及人源化小鼠组织中TNFRSF4 的表达
为了鉴定人源化小鼠是否在蛋白水平发生TNFRSF4 敲除或人源化转入,取3 月龄小鼠外周血进行流式细胞鉴定,使用种属反应性为小鼠的TNFRSF4 抗体检测 TNFRSF4 表达(图3a)。结果显示,在TNFRSF4-/-小鼠的外周血中,TNFRSF4 表达被敲除。
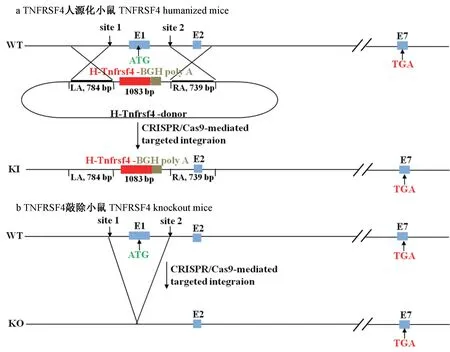
注:在sgRNA 和Cas9 mRNA 的参与下,小鼠TNFRSF4 第一外显子被剪切;a:使用人TNFRSF4 的CDS 区及BGH Poly A 组成的1083 bp 阅读框,成功替换了小鼠TNFRSF4 第一外显子的编码区,建立TNFRSF4 人源化小鼠;b:阅读框未能替换小鼠TNFRSF4 第一外显子的编码区,建立TNFRSF4 敲除小鼠。图1 TNFRSF4 人源化及敲除小鼠建立方案Note. With the participation of sgRNA and Cas9 mRNA, the first exon of mouse TNFRSF4 was cut. a. The 1083 bp reading frame composed of the CDS region of human TNFRSF4 and BGH Poly A was used to replace the coding region of the first exon of mouse TNFRSF4 to establish a humanized TNFRSF4 mouse. b. The reading frame did not replace the coding region of the first exon of mice TNFRSF4 and a TNFRSF4 knockout mice was established.Figure 1 Establishment of TNFRSF4 humanization and knockout mice
由于市售蛋白抗体无法区分人源与小鼠源TNFRSF4 蛋白,使用 RT-PCR 鉴定TNFRSF4h/h和TNFRSF4m/m小鼠各组织中 mRNA 表达(图3b)。结果可见人特异性引物只能扩增TNFRSF4h/h小鼠的cDNA,而小鼠特异性引物也只能扩增TNFRSF4m/m的 cDNA,结果可见在TNFRSF4h/h小鼠中,鼠源TNFRSF4 被人源替代。
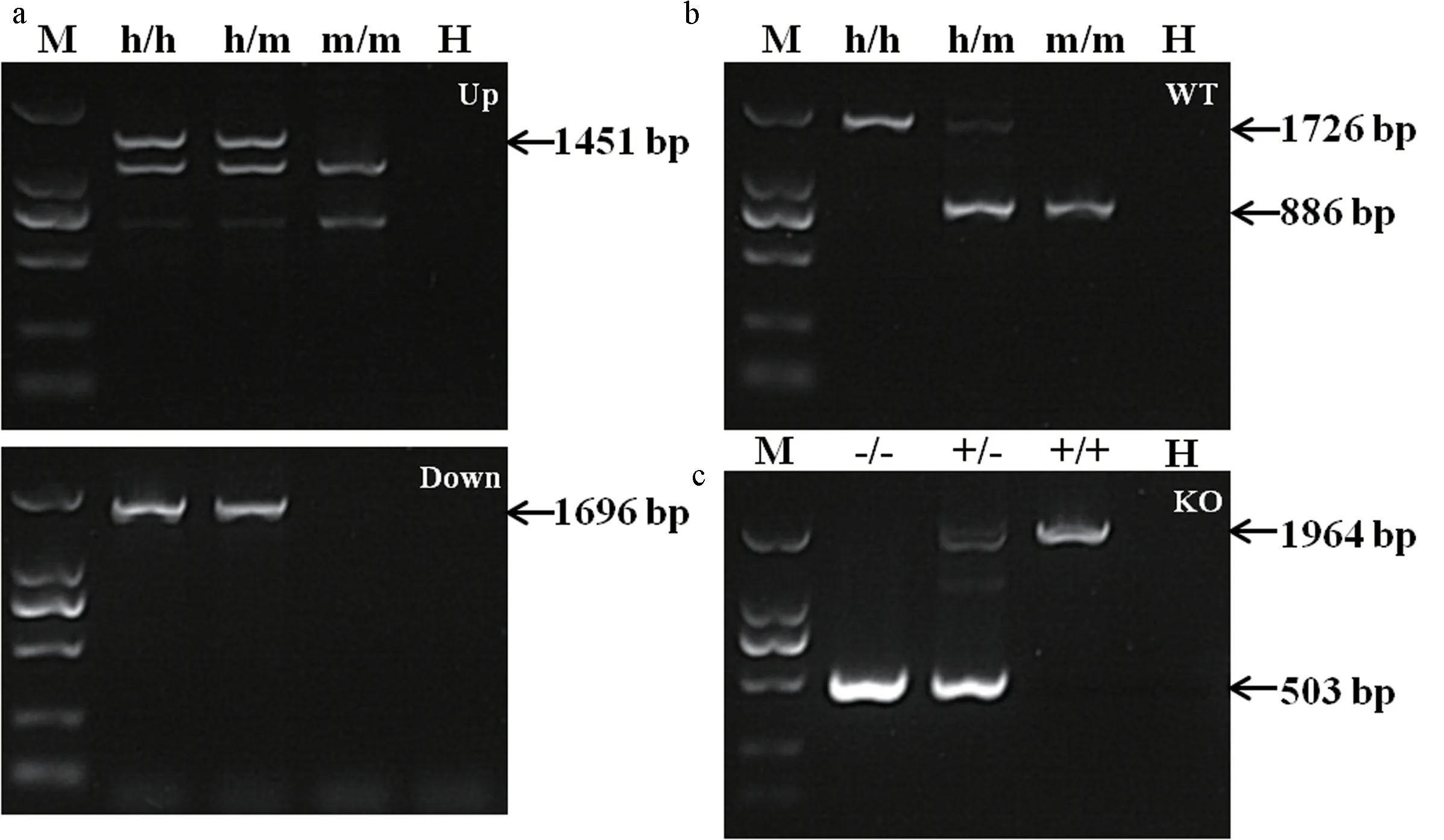
注:使用PCR 鉴定子代小鼠基因型,突变可传代;M:Marker(TaKaRa,DL2000);H: 水;h/h:TNFRSF4 人源化纯合子小鼠;h/m:TNFRSF4 人源化杂合子小鼠;m/m:同窝野生型小鼠;a:鉴定使用引物M-TNFRSF4-UP,M-TNFRSF4-DOWN; b:鉴定使用引物M-TNFRSF4-WT;c:-/-:TNFRSF4 基因敲除纯合子小鼠;+/-:TNFRSF4 基因敲除杂合子小鼠;+/+:野生型小鼠;使用鉴定引物M-TNFRSF4-KO。图2 PCR 鉴定子代小鼠基因型Note. Offspring mice were identified by PCR, the mutation can be transmitted. M.Marker(TaKaRa,DL2000). H. H2O. h/h. Humanized TNFRSF4 homozygous mouse. h/m. Humanized TNFRSF4 heterogeneous mouse. m/m. Wild-type mice. a. Identification used primers M-TNFRSF4-UP and MTNFRSF4-DOWN. b. Identification used primers M-TNFRSF4-WT. c. -/-. TNFRSF4 knock-out mice. +/-. TNFRSF4 heterogeneous mice. +/+.Wild-type mice. Identification used primers M-TNFRSF4-KO.Figure 2 Identify the genotype of the offspring mice by PCR
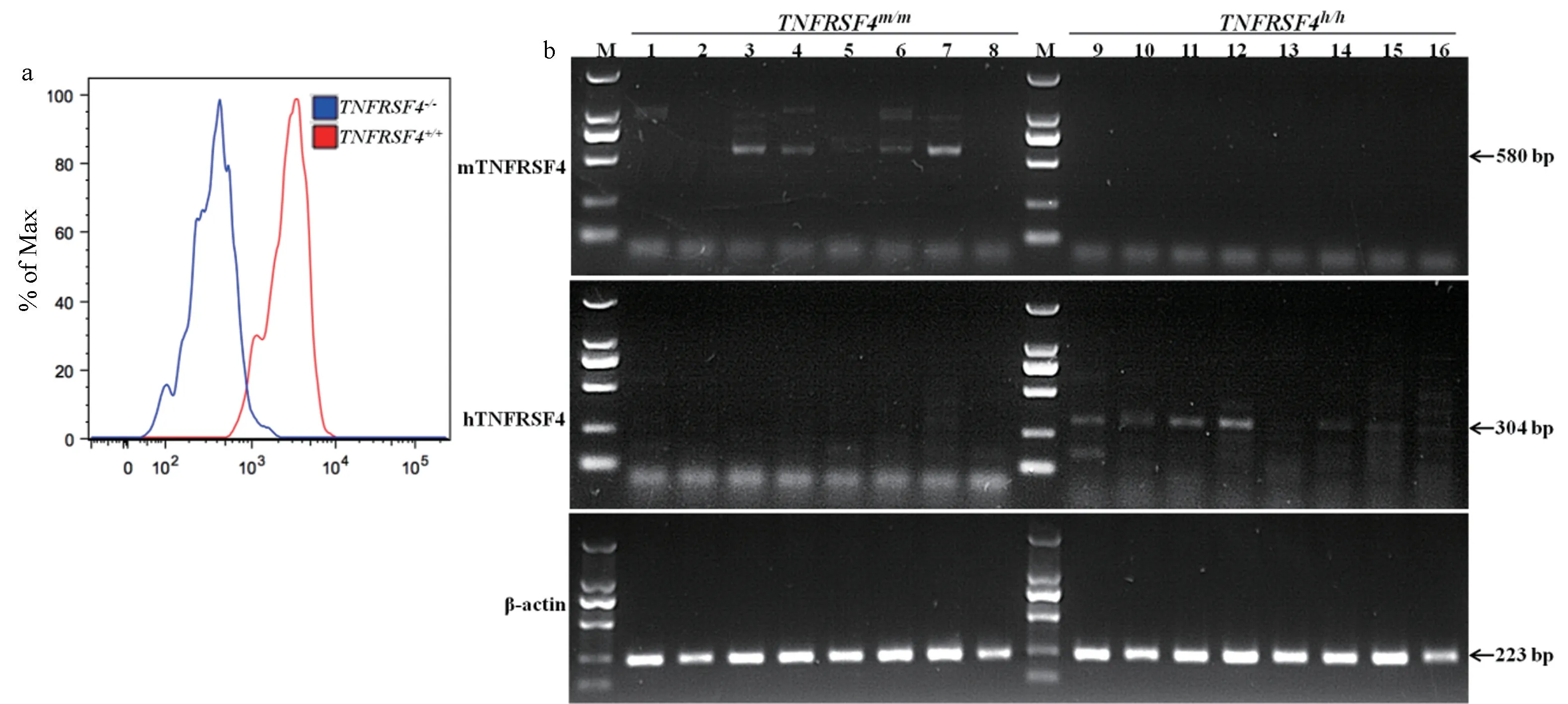
注:a:流式细胞术统计TNFRSF4+/+和TNFRSF4-/-小鼠培养的脾细胞中CD3+CD4+T 细胞中TNFRSF4+细胞的直方图;b:TNFRSF4 在TNFRSF4m/m(1~8)和 TNFRSF4h/h小鼠(9 ~ 16)心(1,9)、肝(2,10)、脾(3,11)、肺(4,12)、肾(5,13)、胸腺(6,14)、脑(7,15)、骨髓(8,16)中的表达;hTNFRSF4:人特异性 TNFRSF4 引物;mTNFRSF4:小鼠特异性 TNFRSF4 引物;β-actin:小鼠特异性 β-actin 引物;M:Marker(TaKaRa,DL2000)。图3 TNFRSF4-/-及TNFRSF4h/h小鼠中TNFRSF4 表达Note. a. Proportion of TNFRSF4+ cells in CD3+CD4+T cells of splenocytes by flow cytometry. b. Expression of TNFRSF4 in heart (1,9), liver (2,10), spleen (3,11), lung (4,12), kidney (5,13), thymus (6,14), brain (7,15) and bone marrow (8,16) of TNFRSF4m/m(1 ~8) and TNFRSF4h/h mice (9 ~ 16). hTNFRSF4. Human-specific TNFRSF4 primer. mTNFRSF4. Mouse-specific TNFRSF4 primer. β-actin. Mouse-specific β-actin primer. M. Marker (TaKaRa, DL2000).Figure 3 TNFRSF4 expression in TNFRSF4-/- and TNFRSF4h/h mice
2.4 人源 TNFRSF4 基因可正常替代小鼠TNFRSF4 基因
HE 染色结果显示,在TNFRSF4-/-小鼠及TNFRSF4h/h小鼠的各组织中,没有观察到淋巴细胞的浸润(图4),且全身病理检查未发现异常。结果表明,TNFRSF4h/h及TNFRSF4-/-小鼠发育正常,在6 个月内没有观察到自身免疫性疾病发展的迹象。利用流式细胞术检测了TNFRSF4h/h小鼠外周血中各类细胞的比例,发现其外周血中B 细胞(B220+)、T 细胞(CD3+、 CD4+、 CD8+)、 粒 细 胞 (CD11b+) 和 NK(NK1.1+)细胞的比例都没有明显差异(图5)。结果说明人源化TNFRSF4 基因后没有改变正常生理状态下小鼠免疫系统的组成。因此,在TNFRSF4h/h小鼠中,人源TNFRSF4 等位基因可以替代小鼠TNFRSF4基因。
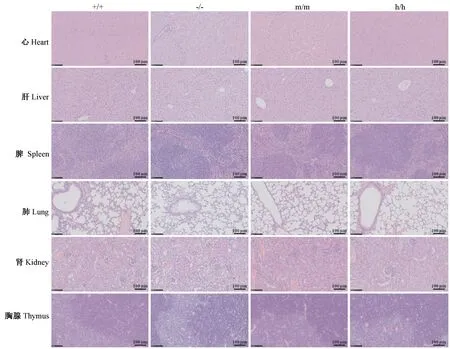
注:m/m:野生型小鼠;h/h:TNFRSF4 人源化纯合子小鼠;+/+:野生型小鼠;-/-:TNFRSF4 基因敲除纯合子小鼠。图4 组织HE 染色Note. m/m. Wild-type mice. h/h. Humanized TNFRSF4 mice. +/+. Wild-type mice. -/-. TNFRSF4 knockout mice.Figure 4 Tissue HE staining

注:a:流式细胞术统计不同免疫细胞在外周血中的比例;b ~e:流式细胞术检测外周血中B220(b),CD3(c),CD11b(d),NK1.1(e)表达。图5 在TNFRSF4h/h小鼠外周血中不同免疫细胞的比例Note. a. Proportion of different immune cells in peripheral blood by flow cytometry. b~e. Expression of B220(b), CD3(c), CD11b(d), NK1.1(e) in peripheral blood by flow cytometry.Figure 5 Proportion of different immune cells in peripheral blood of TNFRSF4h/h mice
3 讨论
TNFRSF4 最初被鉴定为 T 细胞活化标志物[10],在之后的研究中发现它是具有共刺激功能的NGFR/TNFR 超家族成员[11-14]。TNFRSF4 可以在活化的CD4+和CD8+T 细胞上表达,但是在静止的初始T 细胞或大多数静止的记忆T 细胞上都没有发现[10-12]。尽管长期以来人们一直认为TNFRSF4表达仅限于活化的常规T 细胞,但现在已经在活化的调节性T 细胞[15],NK 细胞[16-17],NKT 细胞[18-19]和嗜中性粒细胞[20]上发现了它。
TNFRSF4 敲除小鼠在正常情况下无明显病理反应,研究表明,TNFRSF4 敲除小鼠免疫后产生的初始效应CD4+T 细胞要更少,并且对TNFRSF4 基因敲除动物或缺乏TNFRSF4 的CD4+T 细胞的研究进一步阐明了,TNFRSF4-TNFSF4 的相互作用在初始T 细胞的有效克隆扩增和产生有效的初始CD4+T 细胞应答中起了重要作用[21-24]。
抗 CTLA4 抗体 ipilimumab(Yervoy®)在 2011 年获得批准,通过显著提高转移性黑色素瘤患者的长期生存率,改变了免疫肿瘤学领域。从那时起,许多其他免疫肿瘤学药物已进入临床开发。除了检查点抑制剂外,这些还包括共刺激分子,例如TNFRSF4 和糖皮质激素诱导的 TNFR 相关蛋白等[2,25-26]。然而,由于T 细胞的系统性活化,CTLA4阻断抗体与严重的免疫相关不良事件有关,这限制了它们的使用[27-28]。与 CTLA4 相似,在肿瘤微环境中,TNFRSF4 在活化的 T 细胞上表达高度上调[29-31]。目前,几种抗TNFRSF4 单克隆抗体正在作为单一疗法或与检查点抑制剂联用进行临床开发[32-34]。有文献表明,将检查点抑制剂与T 细胞共刺激性激动抗体组合可以通过增强T 细胞扩增和效应子功能,同时控制Tregs 的抑制功能,将冷肿瘤转变为热肿瘤[35-36]。与单特异性抗体相比,通过靶向在肿瘤中过度表达的两个受体,有可能增加对肿瘤区域的定位,并且降低全身性T 细胞活化的风险并提高疗效。由于人类和小鼠的TNFRSF4 只具有约70%的同源性,为进一步研究 TNFRSF4 相关药物,使用TNFRSF4 人源化小鼠可以更好的与临床接轨。TNFRSF4 基因人源化小鼠的免疫应答是在自然环境中产生的,可以用于评估与潜在人类治疗性抗体相关的自身免疫副作用的能力。
因此,本研究建立的TNFRSF4 人源化小鼠模型可以改善TNFRSF4 在人与小鼠中种属差异导致的实验结果差异,从而使药物评价的结果更加客观,为治疗性抗体的验证提供了更有价值的实验动物模型。同时,建立的TNFRSF4 敲除小鼠为TNFRSF4在免疫过程中的作用机制研究提供了小鼠模型。
