血管介入法构建兔对比剂急性肾损伤模型的氧化应激和病理学改变
2021-05-20王征宇相建峰彭志清李万斌王永利
王征宇, 相建峰, 彭志清, 陈 亮, 李万斌, 王永利
随着介入诊疗技术发展,碘对比剂更多地应用于血管内诊治, 从而导致对比剂急性肾损伤(contrast-induced acute kidney injury,CI-AKI)发生。目前认为CI-AKI 发病机制主要与肾血管收缩引起的肾缺血、肾小管直接毒性和肾小管细胞氧化应激反应等因素有关[1-2],但现有研究仍不能完全明确其发病机制和病理变化。 本研究通过血管介入技术构建兔CI-AKI 模型,旨在观察评估其肾功能改变、氧化应激反应、肾组织病理变化及其相关性,为临床防治CI-AKI 提供实验证据支持。
1 材料与方法
1.1 实验器械和试剂
4F 导管鞘(日本Terumo 公司),碘海醇(300mgI/mL,美国GE 公司),血清肌酐(sCr)和血清尿素氮(BUN)测试试剂盒(Olympus Diagnostica 爱尔兰公司),丙二醛(MDA)、髓过氧化物酶(MPO)、细胞总抗氧化能力(TAC)、过氧化氢酶(CAT)及总超氧化物歧化酶(T-SOD)测试试剂盒(南京建成生物工程研究所)。
1.2 实验动物
12 只健康、清洁、雄性新西兰大白兔,2~3 个月龄,体重约2 500 g(由上海奉贤辉煌养殖场购入),予1 周适应性分笼饲养,每笼1 只,提供足量饮水、标准兔食。 饲养环境良好,室温20~25℃,相对湿度为45%~65%。 本实验经医院伦理委员会批准,符合动物伦理要求。
1.3 兔CI-AKI 模型构建
将实验兔随机分为4 组:12 h CI-AKI 组(n=3)、24 h CI-AKI 组(n=3)、48 h CI-AKI 组(n=3)和对照组(n=3),均在AXIOM Artis dTA DSA 系统(德国Siemens 公司)下进行血管内介入手术造模。 经兔耳缘静脉注射1.5%戊巴比妥钠(1 mL/kg,初次剂量5 mL,随后根据情况追加剂量)麻醉后,将兔置于导管床,钝性分离左颈总动脉,采用改良Seldinger 技术逆行穿刺左颈总动脉成功后, 经导丝引入4 F 导管鞘中扩张管作为血管内导管, 头端位于腹主动脉上段,注入1~2 mL 碘海醇确认双肾动脉和肾实质显影,将导管固定; 各CI-AKI 组经导管持续注入碘海醇,剂量为14 g/kg,总量约120 mL,对照组注入等量0.9%氯化钠注射液,灌注时间均为30 min;灌注完毕拔除导管并结扎此颈总动脉, 局部缝合包扎,常规喂养。
1.4 血液学和组织学标本获取
分别于术前1 h,术后1 h、2 h、12 h、24 h(24 h、48 h CI-AKI 组和对照组)和48 h(48 h CI-AKI 组和对照组)经兔耳静脉抽血10 mL,用于肾功能和氧化应激反应检测。 分别于术后12 h(12 h CI-AKI 组)、24 h(24 h CI-AKI 组)、48 h(48 h CI-AKI 组和对照组),5%戊巴比妥钠经兔耳缘静脉注射(5 mL/只)致安乐死,立即称重并取下双肾,左肾用于病理学检查,右肾分离皮、髓质后用于肾组织匀浆检测。
1.5 实验室检查和组织病理学检查
根据试剂盒说明进行sCr 和BUN 检测, 同时检测血液和肾皮质、髓质匀浆中MDA、MPO、TAC、CAT、T-SOD。
将各组兔肾脏标本制成光镜病理切片,分别采用苏木精-伊红(HE)、高碘酸-无色品红(PAS)、过碘酸六胺银(PASM)和Masson 染色法染色后进行光镜病理学检查。 取48 h CI-AKI 组2 只和对照组1只兔肾脏标本,制作电镜病理切片,采用铀铅双染色后进行观察。光镜下对肾损伤病理变化程度进行分级:0 级,无损伤;1 级,轻度损伤(<25%);2 级,中度损伤(25%~<50%);3 级,严重损伤(50%~75%);4 级:非常严重损伤(>75%)[3]。 资料采集和分析均由2 名有经验的专业病理医师通过盲法进行。
1.6 统计学方法
采用SPSS 24.0 软件对所有数据进行统计学分析。 均数±标准差(±s)描述正态分布的定量资料,单因素方差分析比较各时间点组间各标记物差异,组间差异有统计学意义的用LSD-t检验行两两比较,独立样本t检验比较两组间定量资料分布差异,配对样本t检验比较各组术后各时间点各标记物与术前的差异,Pearson 相关分析比较各标记物间相关性,Spearman 相关分析比较病理损伤与各标记物间相关性,Kruskal-Wallis H 检验比较组间肾组织病理损伤程度差异, 组间差异有统计学意义的用Mann-Whitney U 检验进行两两比较。 本研究所有检验均为双侧检验,P<0.05 为差异有统计学意义。
2 结果
2.1 实验动物一般情况
术后兔在笼中自然苏醒,无死亡,活动自如,各CI-AKI 组兔精神萎靡,饮水和进食较术前减少1/4~1/2,对照组兔精神状态无明显变化,饮水和进食与术前基本一致。 术前各CI-AKI 组与对照组体重差异无统计学意义(t=-0.366,P=0.722),术后各CI-AKI组体重较术前减轻,显著低于对照组(t=-2.457,P=0.034),其中48 h CI-AKI 组术后体重较术前减轻,差异有统计学意义(t=5.500,P=0.032)。
2.2 手术前后肾功能变化
术前各CI-AKI 组sCr 和BUN 与对照组比较,差异无统计学意义(t=0.512,P=0.620)。 各CI-AKI组术后1 h 时sCr 均显著升高且高于对照组(P<0.05),12 h 时升高均>25%(表1);BUN 高于对照组(P<0.05), 其中12 h CI-AKI 组、48 h CI-AKI 组术后BUN 均高于术前12 h CI-AKI 组。
表1 手术前后sCr 变化 μmol/L,±s

表1 手术前后sCr 变化 μmol/L,±s
*与术前比较,P<0.05
组别 术前 术后1 h 术后2 h 术后12 h 术后24 h 术后48 h 12 h CI-AKI 组(n=3) 80.00±5.57 105.67±14.01* 116.33±19.66* 148.33±14.98* — —24 h CI-AKI 组(n=3) 85.33±3.51 93.33±5.86* 104.00±7.21* 121.00±10.15* 137.00±11.14* —48 h CI-AKI 组(n=3) 89.00±5.20 98.67±5.03* 111.33±10.69 122.33±12.42* 135.33±17.62* 162.00±5.00*CI-AKI 组整体 84.78±5.74* 99.22±9.63* 110.56±12.92* 130.56±17.28* 136.17±13.21* 162.00±5.00*对照组(n=3) 83.00±2.00 83.00±3.00 85.33±2.52 80.33±2.52 82.33±2.08 82.00±2.65 t 值 0.512 2.792 5.548 4.862 6.784 24.495 P 值 0.620 0.019 <0.001 0.001 <0.001 <0.001
2.3 手术前后血清和肾组织氧化应激反应标记物变化
各CI-AKI 组血清MDA 术后1 h 较术前有所降低,术后2 h 后开始升高;血清MPO 术后1 h 即开始明显升高; 血清TAC、CAT、T-SOD 术后1 h 即开始下降。 24 h CI-AKI 组、48 h CI-AKI 组术后血清MDA, 各CI-AKI 组术后MPO 均高于术前及对照组(P<0.05);12 h CI-AKI 组术后血清TAC, 各CI-AKI组术后血清CAT、T-SOD 均低于术前(P<0.05),其中CAT 低于对照组(P<0.05)。对照组术后各标记物与术前差异无统计学意义(P>0.05)。各CI-AKI 组肾皮质和髓质匀浆MDA、MPO 均较对照组增高,TAC、CAT、T-SOD 均下降, 其中24 h CI-AKI 组、48 h CI-AKI 组MPO 均高于对照组(P<0.05),各CI-AKI组肾髓质匀浆各标记物与对照组差异均无统计学意义(P>0.05)。 表2~5。
2.4 sCr、BUN 与氧化应激反应标记物变化相关性
sCr 与BUN,血清MDA、MPO,肾皮质MPO,肾髓质MDA、MPO 呈正相关,与肾髓质T-SOD 呈负相关;BUN 与血清MDA、MPO 呈正相关, 与血清T-SOD 呈负相关。
2.5 术后肾组织病理改变
肾组织病理学检查结果显示, 各CI-AKI 组有严重的皮质、髓质近端肾小管损伤、较轻的皮质远端肾小管损伤及轻度的肾小球损伤;对照组仅有轻度病理学改变,见图1。 皮质、髓质近端肾小管损伤,各组间差异有统计学意义(χ2=9.680,P=0.021;χ2=10.866,P=0.012), 各CI-AKI 组损伤均高于对照组(P<0.05)。皮质近端肾小管损伤与sCr,血清MDA、MPO,皮质MPO,髓质MDA、MPO 呈正相关,与血清CAT、髓质T-SOD 呈负相关。 髓质近端肾小管损伤与sCr,血清MDA、MPO,皮质MPO,髓质MDA 呈正相关,与血清、髓质T-SOD 呈负相关。
表2 手术前后血清MDA 变化 nmol/mL,±s

表2 手术前后血清MDA 变化 nmol/mL,±s
*与术前比较,P<0.05
组别 术前 术后1 h 术后2 h 术后12 h 术后24 h 术后48 h 12 h CI-AKI 组(n=3) 2.24±0.07 1.93±0.23 3.39±1.17 5.14±1.32 — —24 h CI-AKI 组(n=3) 3.56±0.81 2.97±0.29 4.12±0.97 5.11±1.33* 5.50±0.84* —48 h CI-AKI 组(n=3) 3.10±0.95 2.88±1.18 3.60±1.44 4.63±0.65* 5.32±1.02 5.45±0.65*CI-AKI 组整体 2.97±0.85 2.59±0.79 3.70±1.10 4.96±1.02 5.41±0.84 5.45±0.65对照组(n=3) 2.75±0.92 2.85±0.77 2.75±0.35 2.45±1.13 2.45±0.90 3.25±0.57 t 值 0.385 -0.494 2.291 3.601 4.876 4.393 P 值 0.708 0.632 0.045 0.005 0.002 0.012
表3 手术前后血清MPO 变化 U/L,±s
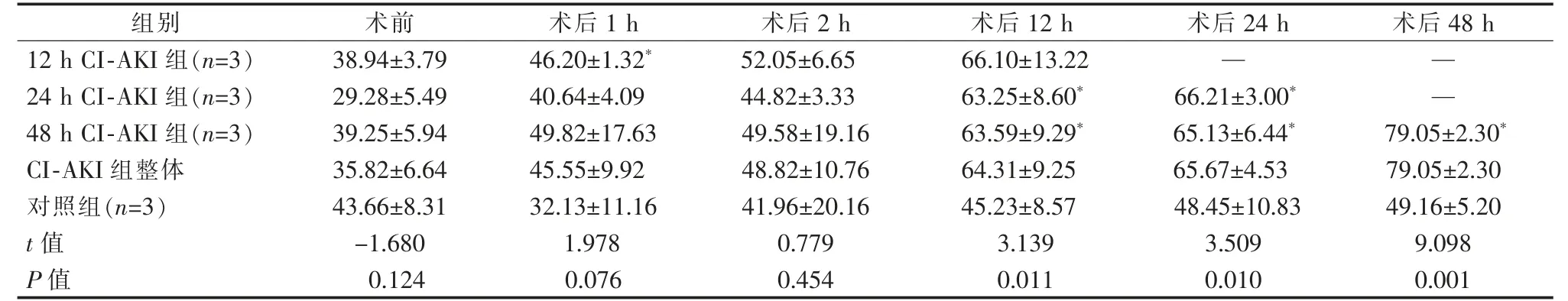
表3 手术前后血清MPO 变化 U/L,±s
*与术前比较,P<0.05
组别 术前 术后1 h 术后2 h 术后12 h 术后24 h 术后48 h 12 h CI-AKI 组(n=3) 38.94±3.79 46.20±1.32* 52.05±6.65 66.10±13.22 — —24 h CI-AKI 组(n=3) 29.28±5.49 40.64±4.09 44.82±3.33 63.25±8.60* 66.21±3.00* —48 h CI-AKI 组(n=3) 39.25±5.94 49.82±17.63 49.58±19.16 63.59±9.29* 65.13±6.44* 79.05±2.30*CI-AKI 组整体 35.82±6.64 45.55±9.92 48.82±10.76 64.31±9.25 65.67±4.53 79.05±2.30对照组(n=3) 43.66±8.31 32.13±11.16 41.96±20.16 45.23±8.57 48.45±10.83 49.16±5.20 t 值 -1.680 1.978 0.779 3.139 3.509 9.098 P 值 0.124 0.076 0.454 0.011 0.010 0.001
表4 手术前后血清CAT 变化 U/mL,±s

表4 手术前后血清CAT 变化 U/mL,±s
*与术前比较,P<0.05
组别 术前 术后1 h 术后2 h 术后12 h 术后24 h 术后48 h 12 h CI-AKI 组(n=3) 10.81±1.01 6.90±2.94 5.61±2.64* 3.49±0.64* — —24 h CI-AKI 组(n=3) 4.74±2.17 2.74±2.04* 2.55±2.08* 0.79±0.42 0.54±0.09 —48 h CI-AKI 组(n=3) 11.16±3.13 9.50±2.90* 8.03±2.10* 6.65±0.96 4.29±0.71 3.42±1.06 CI-AKI 组整体 8.90±3.69 6.38±3.74 5.40±3.09 3.64±2.61 2.42±2.10 3.42±1.06对照组(n=3) 4.34±1.24 6.39±2.63 8.68±2.88 8.16±0.84 6.56±2.13 5.28±0.24 t 值 2.044 -0.004 -1.615 -2.863 -2.774 -2.962 P 值 0.068 0.997 0.137 0.017 0.028 0.087
表5 手术前后血清T-SOD 变化 U/mL,±s
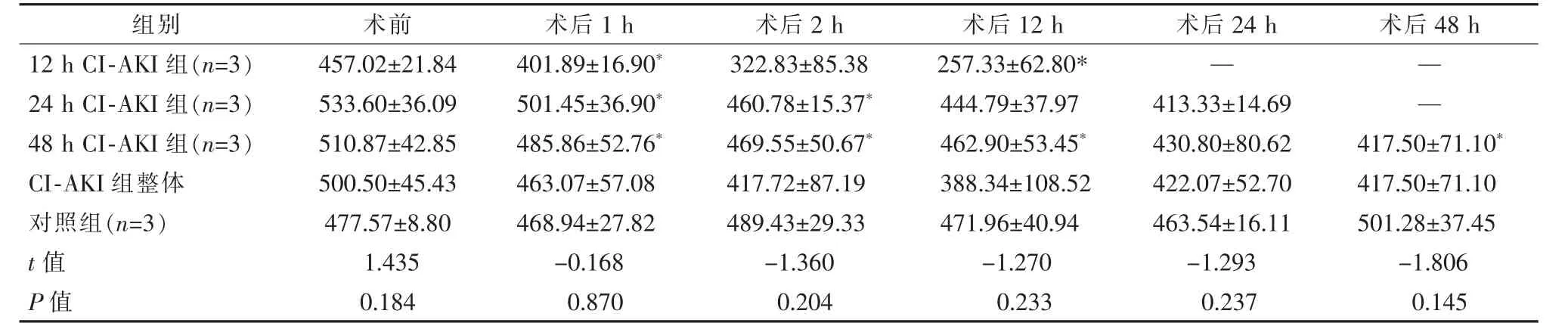
表5 手术前后血清T-SOD 变化 U/mL,±s
*与术前比较,P<0.05
组别 术前 术后1 h 术后2 h 术后12 h 术后24 h 术后48 h 12 h CI-AKI 组(n=3) 457.02±21.84 401.89±16.90* 322.83±85.38 257.33±62.80* — —24 h CI-AKI 组(n=3) 533.60±36.09 501.45±36.90* 460.78±15.37* 444.79±37.97 413.33±14.69 —48 h CI-AKI 组(n=3) 510.87±42.85 485.86±52.76* 469.55±50.67* 462.90±53.45* 430.80±80.62 417.50±71.10*CI-AKI 组整体 500.50±45.43 463.07±57.08 417.72±87.19 388.34±108.52 422.07±52.70 417.50±71.10对照组(n=3) 477.57±8.80 468.94±27.82 489.43±29.33 471.96±40.94 463.54±16.11 501.28±37.45 t 值 1.435 -0.168 -1.360 -1.270 -1.293 -1.806 P 值 0.184 0.870 0.204 0.233 0.237 0.145
3 讨论
目前文献报道的CI-AKI 动物实验多来自大鼠模型,但在啮齿类动物中,兔肾脏形态学表现与人体更接近[3]。 据文献报道,单次注射含碘对比剂5 g/kg即可在兔体内诱导CI-AKI 发生, 而在大鼠和小鼠体内却不会引起明显肾损伤[4-5],因此兔更适合构建CI-AKI 模型[6]。 既往研究中基本采用外周静脉注射方式, 多联合应用脱水或肾毒性药物共同诱导CI-AKI 发生[7],但不一定能真实反映经导管血管内治疗中CI-AKI 发生情况及病理生理变化。 因此,本研究采用血管内介入技术制作兔CI-AKI 模型,经颈动脉入路操作较为简便,且对比剂可随血流方向进入双侧肾动脉,更容易造模成功。 由于目前尚无动物CI-AKI 诊断标准, 本研究参考了临床最常用且比较公认的诊断标准: 应用对比剂48~72 h 内sCr 增加44 μmol/L 或较基础值升高>25%,并排除其他肾功能损害[8]。 本研究中各CI-AKI 组实验兔在12 h 时sCr 水平均升高>25%并具有统计学意义,且sCr 和BUN 变化水平显著高于对照组;肾功能改变结合临床表现证实,模型组兔在对比剂应用后12 h 均发生CI-AKI,表明血管介入技术可构建CI-AKI动物模型。

图1 兔CI-AKI 模型构建后肾组织病理改变
MDA、MPO 作为氧化应激反应终产物, 过量生成会导致氧化性组织损伤,CAT、T-SOD 作为体内主要抗氧化酶,分解活性氧,避免自由基对人体细胞的氧化损伤,而TAC 可反映血浆和体内所有抗氧化剂总的作用[9-10]。本研究中各CI-AKI 组血清MDA 在术后1 h 有一过性下降, 提示氧化应激反应初期兔抗氧化能力较强,可抑制血清MDA 形成,但随着氧自由基增加,氧化应激系统失代偿,因而在2 h 开始明显升高。MPO 升高和CAT、T-SOD、TAC 下降提示抗氧化酶过度消耗,兔总体抗氧化能力降低,结合肾组织匀浆标记物变化, 表明氧化应激反应发生,体内活性氧自由基过量产生导致肾损伤[10-11]。同时,各CI-AKI 组sCr、BUN 升高与氧化应激反应标记物变化显著相关。 因此,氧化应激反应发生和加重与肾功能损害一致,即在血管介入诊疗中,强烈的氧化应激反应导致CI-AKI 发生。
药物性肾损伤包括急性肾小管坏死和急性间质性肾炎,病理上主要表现为近端肾小管损伤和肾间质淋巴细胞、单核细胞、浆细胞等炎性细胞浸润。本研究中兔CI-AKI 模型病理表现为皮质和髓质近端肾小管损伤、 皮质远端肾小管程度较轻损伤、肾间质炎性细胞浸润及线粒体破坏,符合药物性急性肾损伤表现。 电镜下可看到肾小球有一定程度损伤,但与CI-AKI 是否直接相关尚不能确定。 肾间质无明显纤维化提示,对比剂导致的肾损伤为急性病理改变。 因此,实验兔经动脉注入对比剂后造成了比较严重的急性肾损伤,其病理变化与sCr、氧化应激反应标记物显著相关。 目前认为,近端肾小管比远端肾小管更容易发生缺血和毒性物质损伤的主要原因,在于其产生无氧糖酵解三磷酸腺苷能力较低,缺乏抗氧化剂和抗凋亡蛋白并对线粒体毒性更加敏感[12-14]。 肾小管细胞接触对比剂后受到外来毒性刺激并发生缺血、缺氧,线粒体发生肿胀、分裂和线粒体吞噬,以减少对肾小管的损害[15],线粒体功能受损并产生更多活性氧自由基,导致凋亡[16-17]。因此,本研究在电镜下观察到近端肾小管明显的线粒体损伤表现,并可观察到用于清除损伤线粒体的自噬体增多。
本研究不足之处乃样本量较小,且应用了较高剂量对比剂,因而达到100%造模成功,这是预实验中所用剂量12 g/kg 时sCr 升高未达到25%以上的缘故。 进一步实验中会扩大样本量,并尽量减少对比剂用量,以更接近临床实际情况观察动物模型肾损伤发生。
总之,采用血管介入法经动脉插管注入对比剂可成功构建CI-AKI 兔模型, 其存在明显的肾功能减退、氧化应激反应和肾损伤病理改变。 氧化应激反应和肾脏病变与碘对比剂所致肾功能损害直接相关。
