Wiskott-Aldrich综合征的临床特征与基因表型分析
2021-05-20金玉婷顾静文马典庆刘野天陈天平
金玉婷 王 敏 韦 楠 顾静文 马典庆 刘野天 陈天平
Wiskott-Aldrich综合征(WAS)又称湿疹血小板减少伴免疫缺陷综合征,为一种罕见的X连锁(Xp11.22-23)隐性遗传性疾病,其发病率约为(1~10)/100万[1-2]。该病多因感染和血小板减少就诊,易与免疫性血小板减少症混淆,早期诊断可指导患儿行造血干细胞移植(HSCT)以改善预后,故对该病进行及时、准确的诊断显得非常重要。本文分析我院3例WAS患儿临床特征及基因检测结果,初步探讨该病的治疗方法,以提高对本病的认识。
1 材料和方法
1.1 研究对象 先证者1,男,2月6天,初诊时因皮肤出血点、肛周皮肤红肿入院,入院后行骨穿等相关检查,拟诊为免疫性血小板减少症,后因疗效欠佳,完善第二代基因测序(NGS),确诊为WAS,予转外院行HSCT。先证者2,男,1月7天,初诊时即有大便带血、皮肤出血点等严重出血倾向,在我科完善相关检查后拟诊免疫性血小板减少症,后因疗效欠佳完善NGS检查,确诊为WAS,于等待HSCT期间合并严重感染死亡。先证者3,男1月6天,因腹泻、皮肤溃疡及皮肤出血点就诊,完善骨穿及NGS检查,确诊为WAS,随后联系外院行HSCT。
1.2 一般实验室检查 3例患儿入院后均完成了一般实验室检查,包括:血常规、免疫球蛋白定量、炎症反应指标、EBV-DNA及骨髓穿刺检查等,相关检查方法均为临床实验室常用检查,在此不再一一赘叙,相关检查结果见表1。
1.3 第二代基因测序 3例患儿均使用NGS的方法进行了全外显子扫描(WES)。具体分为以下三个步骤:突变筛查、基因数据分析和疑似致病突变验证。①突变筛查:采用IDT The x Gen Exome Research Panel v1.0全外显子捕获芯片,经Illumina Nova Seq 6000系列测序仪测序,目标序列测序覆盖度≥99%。②基因数据分析:使用智因东方“全谱遗传病精准诊断云平台系统”分析筛选,结合致病突变数据库、正常人基因组数据库、已知四千种遗传病临床特征数据库等基因数据分析算法,对发现的基因变异进行分级,变异分级采用ACMG(美国医学遗传学会)基因变异分级体系。③疑似致病突变验证:对目标序列进行PCR扩增,使用ABI3730测序仪进行Sanger测序验证,并经基因序列分析软件获得基因验证结果。
2 结 果
2.1 3 例先证者临床表现及一般实验室检查结果 3例患儿初诊时均有湿疹表现,3例初诊时均有出血表现,先证者1和先证者3出血部位在皮肤黏膜,先证者2有皮肤黏膜和消化道出血。先证者1既往有肛周感染、败血症病史,先证者2和先证者3既往有肺炎感染病史。3例患儿初诊时拟诊为免疫性血小板减少症,经糖皮质激素、丙球治疗,血小板计数均不能恢复。3例患儿家系中均无血小板减少及其他血液系统疾病家族史,亦无近亲结婚史。3例先证者的一般实验室检查结果,见表1。
2.2 基因检测及家系验证结果 先证者1的WAS突变基因为第1090位核苷酸C>T(p.R364X)[c.1090C>T, p.R364X],造成编码蛋白质的第364位氨基酸由精氨酸(Arg,R) 变为终止子(X,Ter)(图1A),该突变为半合子突变,来源于母亲,见图2A。先证者2的WAS突变基因突变为第4号外显子411号核苷酸和4222号核苷酸之间插入序列(CGGGCCCT)[c.411(exon4)_c.412(exon4)ins CGGGCCCT](图1B),突变类型为半合子突变,来源于母亲(图2B)。先证者3的WAS基因突变位为第7号外显子631位核苷酸C>T [c.631C>T(exon 7),pp.R211X, 292](图1C),突变类型为半合子突变,家系验证结果提示该突变为新生突变(图2C)。

表1 一般实验室检查结果
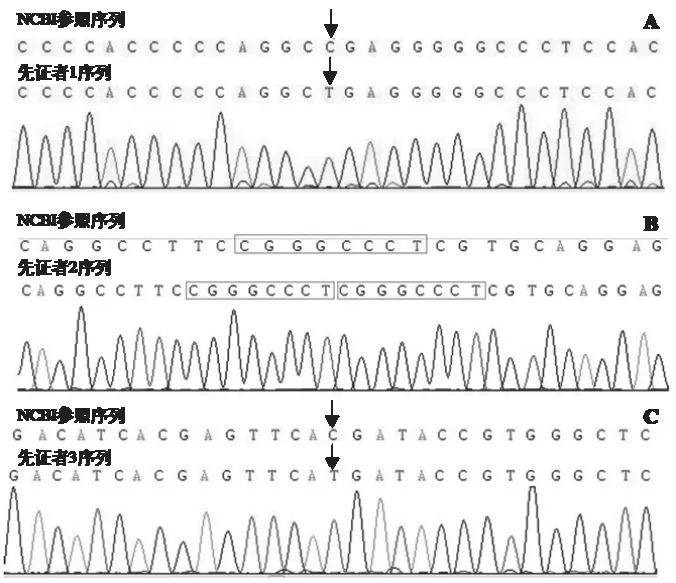
图1 WAS基因检测峰图
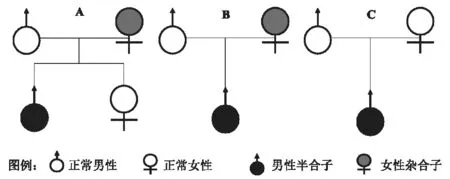
图2 WAS基因表型家系图
3 讨 论
Wiskott-Aldrich综合征(WAS)为一组X-连锁隐性遗传性疾病,以湿疹、小血小板性血小板减少和反复感染为主要临床表现,男性发病为主,发病率约为1/100万~10/100万,临床相对少见[3]。该病因出血、反复感染,导致患儿生长发育受阻、生存质量显著降低,据统计,未经治疗的WAS患儿,其中位生存年龄仅15岁[4]。虽然该病为单基因遗传病,但因其突变类型多变,因此其临床表现和疾病严重程度存在很大的异质性。虽然当前可以通过基因检测确诊WAS,但因其发病率非常低,而其他一般性实验室检查仅表现为血小板减少,故易误诊为免疫性血小板减少症(ITP)[3]。本文所述3例WAS患者,初诊时均拟诊为ITP,后因治疗效果欠佳方经基因检测确诊为WAS。
WAS致病基因位于X染色体p11.22-23,含12个外显子,长约9 kb,编码由502个氨基酸组成的胞浆蛋白,称WAS蛋白(WASP)[5]。WAS基因突变引起WASP结构和/或功能异常,导致免疫细胞的迁移、免疫突触形成及细胞骨架重塑等结构和功能障碍,影响机体的特异性及非特异性免疫功能[2],故WAS患儿一般有反复感染病史。血小板减少、免疫缺陷和湿疹是WAS经典的临床表现三联症,但在新生儿期,这些临床特征可不典型。本文所述3例患儿,初诊时均年龄较小,3例患儿在就诊时均有血小板减少、湿疹和既往感染病史,符合WAS疾病的一般临床表现。此外,WAS的血小板减少常为小血小板体积性血小板减少,但本文所述3例患儿,仅1例表现为血小板体积减小,其余2例血小板体积均正常;我们既往报道1例WAS合并石骨症的血小板减少症患儿,其血小板体积亦正常[6],这些提示临床上不能因血小板体积正常而轻易排除WAS的诊断。
WAS的治疗方案因其疾病的异质性而又所不同,造血干细胞移植(HSCT)是目前根治WAS的主要手段[2]。对于血小板减少症的患儿,糖皮质激素及丙球冲击治疗效果均不理想,血小板输注一般仅推荐用于发生严重大出血的患儿。因WAS患儿的血小板减少与脾脏破坏增多有关,故脾切除可一定程度上增加WAS的血小板数量并增加长期生存率,但脾切除可能会增加HSCT后的相关并发症[7-8]。据统计,未行HSCT的WAS患儿最终将死于感染(44%)、出血(23%)和恶性肿瘤(26%),而HSCT治疗后的WAS患儿长期生存率可达80%以上。影响HSCT治疗效果的关键因素在于移植的时间,目前认为5岁以前HSCT的治疗效果要优于5岁以后,且5岁前无关供者HSCT的疗效与同胞相合供者的疗效相差不大。因此,对于WAS患儿的早期诊断显得尤为重要。本文所述3例患儿初诊时曾行激素及丙球冲击治疗,但疗效均不佳,这与WAS的疾病特点有关。其后2例患儿行HSCT,1例于等待移植过程中死亡。截止到目前为止,2例HSCT后患儿反复感染和湿疹的临床表现基本消失,血小板计数基本恢复正常。
综上所述,本研究报道了3个经NGS基因确诊的WAS病例,分析并探讨了WAS的临床特征。对于男性婴幼儿、尤其是小婴儿,如出现血小板减少合并反复感染、湿疹,无论血小板体积是否减少,均应警惕WAS的可能性。基因检测是目前诊断WAS的金标准,HSCT是其确切有效的治疗手段。
