流感病毒神经氨酸酶活性及型别鉴定酶联凝集素法的建立
2021-05-19曹海丹刘旭光王平赵丹红孙宇孙志伟杨红育李帅张雪梅吴业红
曹海丹,刘旭光,王平,赵丹红,孙宇,孙志伟,杨红育,李帅,张雪梅,吴业红
长春生物制品研究所有限责任公司,吉林长春130012
流感病毒表面含有两种糖蛋白,分别为血凝素(hemagglutinin,HA)和神经氨酸酶(neuraminidase,NA)[1]。HA能够与宿主细胞表面唾液酸受体结合,随后感染细胞。抗HA中和抗体能够抑制病毒HA活性从而抵抗病毒感染[2]。HA是流感疫苗中的主要成分,其含量和活性已成为疫苗制备中的关键控制指标。NA是流感病毒表面上的另一种重要糖蛋白,其在病毒的成熟释放过程中发挥重要作用[3]。有研究表明,抗NA抗体能够阻止病毒通过黏液层渗透,阻止新生病毒颗粒从感染细胞中脱离,限制游离病毒颗粒感染新细胞的数量[4]。针对NA的免疫力可显著降低流感发病率和致死率,限制流感传染易感个体的机会[5]。据报道,人群中抗NA抗体水平与感染后康复及感染疾病程度相关[6]。由于人群对带有新型HA的流感病毒无免疫力,但人体可能在之前流感病毒流行时就已经对NA产生免疫力,从而抵抗病毒感染。因此,针对NA的免疫力在新型HA流感大流行期间可能起到极重要作用[7]。
WHO推荐采用硫代巴比妥酸(thiobarbithuric acid,TBA)检测流感病毒NA活性及型别鉴定[8],该方法是基于检测NA从胎球蛋白上裂解后的游离唾液酸数量,但存在大量使用危险化学品和操作复杂等缺点,限制了其在流感疫苗生产检定和流感病毒监测中的应用。最近发展起来的酶联凝集素测定法(enzyme-linked lectin assay,ELLA)也依赖于NA的唾液酸酶活性,但不检测游离唾液酸,而是检测NA裂解唾液酸后暴露的末端半乳糖[9-10]。已有文献证明,与TBA法相比,ELLA法具有灵敏度高、操作简单并利于推广等优点[11]。本研究应用ELLA法检测流感疫苗单价原液NA活性,并鉴定流感病毒NA型别,现将结果报道如下。
1 材料与方法
1.1 毒株H1N1型疫苗毒株[A/California/7/2009(H1N1)(NYMC X-179A)、A/Michigan/45/2015(H1N1)(NYMC X-275)、A/Brisbane/2/2018]、H3N2型疫苗毒株[A/Texas/50/2012(NYMCX-223A)、A/Hongkong/4801/2014(NYMCX-263B)、A/Singapore/INFIMH-16-0019/2016(NIB-104)]、B型疫苗毒株[B/Brisbane/60/2008(NYMC BX-35)、B/Phuket/3073/2013、B/Colorado/6/2017]均购自NIBSC。
1.2 主要试剂及仪器 胎球蛋白、BSA、辣根过氧化物酶标记的花生凝集素(HRP-PNA)购自美国Sigma公司;抗N1、N2和B型流感病毒NA标准血清购自NIBSC;H1N1、H3N2和B型流感疫苗单价原液、PBS、甲醛、TritonX-100、未接种病毒鸡胚尿囊液为长春生物制品研究所有限责任公司疫苗六室制备;TMB购自北京索莱宝科技有限公司;酶标板购自美国Thermal Fisher公司。
1.3 流感疫苗单价原液中NA活性检测ELLA法的建立 将胎球蛋白用PBS溶解后,用0.05 mol/L CB(pH 9.6)稀释至25μg/mL,加至酶标板中,100μL/孔,密封膜包裹,4℃过夜;弃上清,用洗液洗涤3次,拍干,加入倍比稀释的单价原液,100μL/孔,每个样品作复孔,设加入0.01 mol/L磷酸盐缓冲液(pH 7.2)的阴性对照孔,37℃孵育16~18 h;弃孔中液体,用洗涤液洗涤3次,拍干,加入HRP-PNA(酶稀释液1∶500稀释),100μL/孔,室温作用2 h;弃孔内液体,洗涤液洗涤5次,拍干,加入TMB底物液,100μL/孔,室温作用15 min;加入终止液,100μL/孔,10 min内于酶标仪450 nm波长处测定A值。以待测样品A值大于等于2.1倍阴性对照A值作为Cutoff值,确定单价原液的酶活。
1.4 流感疫苗毒株NA型别鉴定ELLA法的建立
1.4.1 流感病毒毒株最佳工作浓度确定 取3个型别的样品各30μL分别加入120μL病毒稀释液中,混匀,取120μL,加至病毒稀释板,进行2倍倍比稀释,设阴性对照孔(病毒稀释液),每个型别病毒均作复孔。将不同比例稀释的病毒液转移至包被胎球蛋白的酶标孔中,100μL/孔,(37±1)℃孵育16~18 h;弃液体,洗涤液洗涤3次,拍干,加入HRPPNA,100μL/孔,室温作用2 h;弃液体,洗涤液洗涤5次,拍干,加入TMB底物液,100μL/孔,室温作用15 min;加入终止液,100μL/孔,10 min内于酶标仪450 nm波长处测定A值。以病毒稀释度为横坐标,A值为纵坐标绘制病毒酶活性曲线。以病毒稀释度A值约为起始病毒稀释度的90%且在线性范围内,且至少比阴性对照大10倍为最佳病毒稀释度。
1.4.2 流感病毒毒株型别鉴定 将3个型别的抗流感病毒NA标准血清56℃灭活1 h,取20μL分别加至80μL血清稀释液中,混匀,取60μL,加至血清稀释板中,进行2倍倍比稀释。将3个型别的样品用病毒稀释液稀释至最佳工作浓度,加至血清稀释板中,60μL/孔,每个样品作复孔,设阳性对照孔(120μL最佳稀释度病毒)和阴性对照孔(120μL病毒稀释液),振荡混匀,取100μL转移至包被胎球蛋白的酶标板中,(37±1)℃孵育16~18 h;弃孔内液体,洗涤液洗涤3次,拍干,加入HRP-PNA,100μL/孔,室温作用2 h;弃孔内液体,洗涤液洗涤5次,拍干,加入TMB底物液,100μL/孔,室温作用15 min;加入终止液,100μL/孔,10 min内于酶标仪450 nm波长处测定A值,并按照下式计算NA抑制率。选取抑制率≥50%的最高血清稀释度作为NI50。

1.5 方法的验证
1.5.1 耐用性 将HRP-PNA孵育不同时间(1.5、2、2.5 h),用上述建立的方法检测NI50。
1.5.2 专属性 用上述建立的方法检测PBS(阴性对照)、甲醛、TritonX-100、未接种病毒鸡胚尿囊液等单价原液中的原辅料的A450。
1.5.3 适用性 用上述建立的方法进行H1N1、H3N2和B型不同疫苗毒株的型别鉴定。
2 结果
2.1 流感疫苗单价原液NA活性 结果显示,阴性对照A450均值为0.041,不同型别连续3批单价原液的A450均值分别为H1N1:1.919~1.930;H3N2:1.909~1.952;B:1.805~1.871。所有型别单价原液的NA活性均为阳性,且不同型别批间一致性较好。见表1。

表1 不同型别流感病毒单价原液NA活性检测结果(A450)Tab.1 Determination result of NA activity in monovalent bulk of influenza virus of various subtypes(A450)
2.2 流感病毒最佳工作浓度 结果显示,随着病毒稀释度的增加,不同型别毒株的NA活性逐渐降低,直至为0。在1∶10、1∶20稀释的H1N1中,A值比较接近,在1∶40稀释时,A值约为最大值的90%。对于H3N2和B型毒株,均是在1∶20稀释时,A值约为最大值的90%。因此,确定H1N1、H3N2和B型毒株最佳稀释度分别为1∶40、1∶20和1∶20。见图1。
2.3 流感病毒型别 结果显示,对于H1N1型毒株,抗N1型血清能够明显抑制H1N1的NA活性,NI50对应的血清稀释度为1∶2 560,而抗N2和B型血清不能有效抑制H1N1的NA活性,NI50对应的血清稀释度分别为1∶80和1∶10。对于H3N2型毒株,抗N1、N2和B型标准血清的NI50分别为1∶160、1∶2 560和1∶10。对于B型毒株,抗N1、N2和B型标准血清的NI50分别为1∶40、1∶40和1∶320。见图2~4。
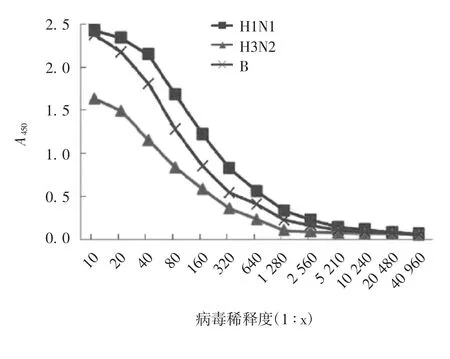
图1 不同型别毒株NA活性Fig.1 NA activity of influenza virus of various subtypes

图2 H1N1型毒株NA活性抑制结果Fig.2 Inhibition of NA activity of influenza virus of subtype H1N1
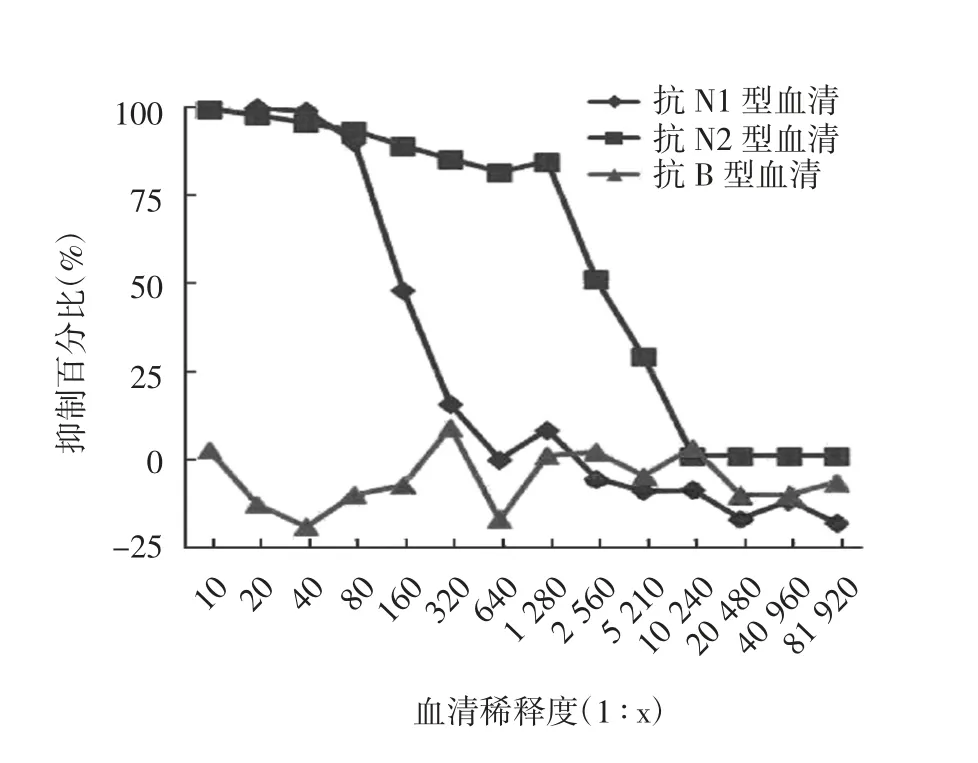
图3 H3N2型毒株NA活性抑制结果Fig.3 Inhibition of NA activity of influenza virus of subtype H3N2
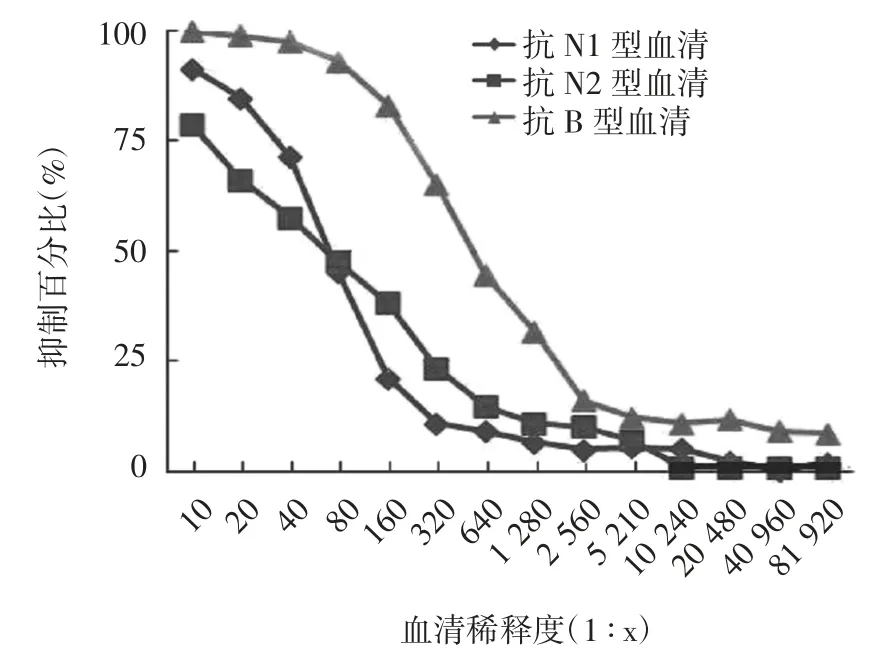
图4 B型毒株NA活性抑制结果Fig.4 Inhibition of NA activity of influenza virus of subtype B
2.4 方法的验证
2.4.1 耐用性 结果显示,HRP-PNA不同孵育时间对检测结果均无影响,见表2。

表2 HRP-PNA不同孵育时间对检测结果的影响(NI50)Tab.2 Effect of incubation time of HRP-PNA on test result(NI50)
2.4.2 专属性 结果显示,PBS、甲醛、Triton X-100和未接种鸡胚尿囊液的A450值均为阴性,见表3。
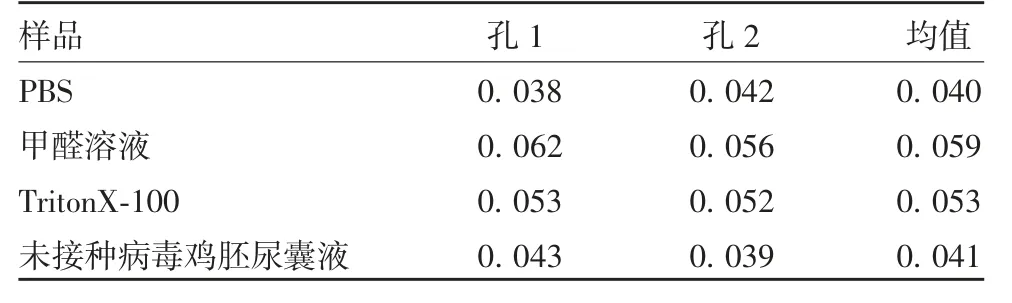
表3 辅料对检测结果的影响(A450)Tab.3 Effect of additives on test result(A450)
2.4.3 适用性 结果显示,H1N1型别不同毒株[A/California/7/2009(H1N1)(NYMC X-179A)、A/Michigan/45/2015(H1N1)(NYMC X-275)、A/Brisbane/2/2018)]分别与倍比稀释的抗N1、N2和B型血清混合后,NI50分别为1∶2 560、1∶80、1∶10;1∶1 280、1∶80、1∶10;1∶1 280、1∶160、1∶10。H3N2型别不同毒株[(A/Texas/50/2012(NYMCX-223A)、A/Hongkong/4801/2014(NYMCX-263B)、A/Singapore/INFIMH-16-0019/2016(NIB-104)]分 别 与倍比稀释的抗N1、N2和B型血清混合后,NI50分别为1∶80、1∶2 560、1∶10;1∶80、1∶1 280、1∶10;1∶80、1∶1 280、1∶10。B型别不同毒株[B/Brisbane/60/2008(NYMC BX-35)、B/Phuket/3073/2013、B/Colorado/6/2017)]分别与倍比稀释的抗N1、N2和B型血清混合后,NI50分别为1∶40、1∶40、1∶320;1∶20、1∶40、1∶320;1∶20、1∶40、1∶320。见图5~7。

图5 H1N1型别不同疫苗毒株NI50检测结果Fig.5 Determination result of NI50 of vaccine strains of subtype H1N1
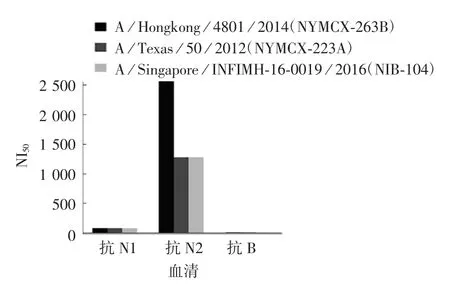
图6 H3N2型别不同疫苗毒株NI50检测结果Fig.6 Determination result of NI50 of vaccine strains of subtype H3N2

图7 B型别不同疫苗毒株NI50检测结果Fig.7 Determination result of NI50 vaccine strains of subtype B
3 讨论
目前,欧洲药品管理局(European Medicines Agency,EMA)和WHO均要求对流感疫苗单价原液进行NA活性检测,流感疫苗毒种需进行NA型别鉴定[12-14]。流感病毒NA活性可通过NA水解胎球蛋白来确定,型别鉴定可通过NA抑制(NI)试验及抗体介导对酶活性的干扰程度来确定。这些检测均依赖于NA水解唾液酸的活性,即通过测量唾液酸从高糖基化蛋白如胎球蛋白的释放程度。
本研究成功建立了一种用于流感病毒NA活性及型别鉴定的检测方法。应用该方法检测了流感病毒裂解疫苗单价病毒原液,结果显示,3个型别单价原液的NA活性均为阳性,且不同型别批间一致性较好。该结果与文献报道基本一致[15],即同一厂家各批次疫苗间NA活性比较为稳定。流感病毒型别鉴定结果显示,相应的NA血清能够明显抑制相应型别的流感病毒NA活性,而非对应的NA血清不能有效抑制其他型别流感病毒NA活性。综上所述,该方法能够区分流感病毒不同亚型的NA,且同一型别不同流感疫苗株结果基本一致。因此,可用于国内流感病毒裂解疫苗质量评估。
