脊髓灰质炎病毒受体转基因小鼠接种Ⅰ+Ⅲ型二价脊髓灰质炎减毒活疫苗后的排毒规律
2021-05-19赵婷施红媛李菁陈诗怡傅宇婷赵钰萍杨晓蕾杨净思
赵婷,施红媛,李菁,陈诗怡,傅宇婷,赵钰萍,杨晓蕾,杨净思
中国医学科学院北京协和医学院医学生物学研究所,云南昆明650118
口服脊髓灰质炎减毒活疫苗(oral poliovirus vaccine,OPV)作为曾经广泛应用的脊髓灰质炎(简称脊灰)疫苗,大大降低了脊灰的发病率,为预防控制乃至消灭脊灰作出了突出的贡献[1]。在野生脊髓灰质炎病毒几近被消灭的情况下,考虑到OPV会引起疫苗相关的脊灰病例(vaccine-associated paralytic polio,VAPP)和疫苗衍生脊髓灰质炎病毒循环(circulating vaccine derived polioviruses,cVDPV)[2-3],在脊灰消灭行动的最后阶段,世界卫生组织(World Health Organization,WHO)建议逐步使用脊灰灭活疫苗(inactivated poliovirus vaccine,IPV)替换OPV[4]。包括中国在内的大部分国家,OPV中的Ⅱ型成分被去除,改用IPV和Ⅰ+Ⅲ型二价OPV(bivalent oral poliovirus vaccine,bOPV)联合序贯免疫程序。
目前阶段,环境中的脊灰减毒株和野生毒株还一直存在,由于IPV几乎不能诱导产生脊灰特异的黏膜免疫以减少接触脊灰病毒后带来的排毒效应,因此在粪口途径传播普遍的国家,减少排毒成为彻底消灭脊灰的关键[5]。本实验利用脊灰受体转基因小鼠动物模型,观察接种1、2、3剂bOPV后小鼠的排毒情况及脊灰特异的黏膜免疫球蛋白A(immunoglobulin A,IgA)抗体水平,分析排毒与接种剂次、黏膜IgA水平的关系,进一步观察排毒小鼠与洁净小鼠共居后对洁净小鼠排毒的影响,以期摸索接种bOPV后的排毒规律,为脊灰的防控和排毒监测提供依据。
1 材料与方法
1.1 疫苗、载体及菌株Ⅰ+Ⅲ型脊髓灰质炎减毒活疫苗(人二倍体细胞)由中国医学科学院医学生物学研究所提供,规格:0.1 mL/剂,含脊髓灰质炎活病毒总量不低于6.12 lgCCID50,其中Ⅰ型应不低于6.0lgCCID50,Ⅲ型应不低于5.50 lgCCID50;pSP64 polyA载体购自美国Promega公司;大肠埃希菌Top10购自日本TaKaRa公司。
1.2 实验动物SPF级脊灰受体转基因C57BL/6N小鼠,共12只,雌性,体重18 g,购自北京维通利华公司,动物合格证号:1103411911000199。
1.3 主要试剂及仪器RNA提取试剂盒购自天根生化科技(北京)有限公司;RNA体外转录试剂盒(RiboMAXTMLarge Scale RNA Production System-SP6)购自美国Promega公司;一步法绝对定量试剂盒(One Step PrimeScript®RT-qPCR Mix)购自日本TaKaRa公司;小鼠脊髓灰质炎抗体IgA酶联免疫分析(ELISA)试剂盒购自默沙克生物公司。
1.4 疫苗接种及采样 取12只脊灰受体转基因小鼠,以灌胃方式接种bOPV,0.1 mL,共接种3剂,间隔28 d。每剂bOPV接种后第1、3、5、7天采集当天小鼠粪便样本,均质后称取500 mg,加入2 mL PBS溶液并充分混匀,800×g离心20 min后收集上清溶液,用于后续排毒和脊灰特异IgA的检测。
1.5 排毒检测 采用实时定量聚合酶链反应(realtime quantitative polymerase chain reaction,q-PCR)法测定病毒载量。取140μL粪便上清溶液,使用RNA提取试剂盒提取样品RNA。标准品制备:将Sabin1和Sabin3基因序列[由生工生物工程(上海)股份有限公司合成]酶切连接进入pSP64 polyA载体中,转化大肠埃希菌Top10工程菌,挑取单克隆,提取载有基因片段的完整质粒作为模板。将分别载有Sabin1和Sabin3基因片段的完整质粒线性化,使用RNA体外转录试剂盒体外转录获得Sabin1和Sabin3的RNA序列作为绝对定量PCR的标准品,使用一步法绝对定量试剂盒测定病毒载量。Sabin1株实时定量引物为:Primer1:5′-CCACTGGCTTCAGTGTTT-3′,Primer2:5′-AGGTCAGATGCTTGAAAGC-3′,Probe:Cy5-TTGCCGCCCCCACCGTTTCACGGA-BHQ-3;Sabin3株实时定量引物为:Primer1:5′-TTAGTATCAGGTAAGCTATC;Primer2,5′-AGGGCGCCCTAACTTT-3′,Probe:ROX-TCACTCCCGAAGCAACAG-BHQ2。扩增条件为:第1步:42℃5 min,95℃10 s;第2步:95℃5 s,56℃30 s,35个循环;在第2步56℃扩增时检测信号。
1.6 IgA检测 收集每剂bOPV接种后第7天的粪便上清溶液,使用小鼠脊髓灰质炎抗体IgA酶联免疫分析(ELISA)试剂盒测定粪便上清溶液中IgA水平。
1.7 小鼠共居试验 接种了第1剂bOPV的转基因小鼠经排毒检测后,将排毒较高的6只小鼠分为高排毒组,排毒较低的6只小鼠分为低排毒组。第1剂bOPV接种后高排毒组小鼠与10只洁净小鼠放入一个鼠笼,低排毒组小鼠与10只洁净小鼠放入另一个鼠笼,共同饲养2 d后,按照小鼠编号将接种过bOPV的小鼠与洁净小鼠分开(每只小鼠通过剪脚趾的顺序,有自己独有编号,按照编号区分每只小鼠)。采集洁净小鼠共居后第3、5、7天的当天粪便,按照1.5项步骤检测小鼠的排毒量。
1.8 统计学分析 应用GraphPad Prism 5和SPSS19.0软件进行统计学分析。两组间平均值的比较采用t检验,两组数据方差不齐时,采用秩和检验比较两组间的平均值。率的比较采用Fisher确切概率法。假设检验水准为双侧α=0.05,以P<0.05为差异有统计学意义。
2 结果
2.1 脊灰受体转基因小鼠接种bOPV后的排毒情况 第1剂bOPV接种后第1~7天,均发现了Ⅰ和Ⅲ型脊灰病毒的排毒个体;第2和第3剂bOPV接种后第1~5天,有Ⅰ和Ⅲ型脊灰病毒排毒呈现阳性的个体,而第2和第3剂bOPV接种后第7天,除第3剂bOPV接种后检测到Ⅲ型脊灰病毒少量排毒,其余未检测到排毒呈阳性的个体。排毒期随着接种bOPV剂接种次的增加而逐步缩短;其次,随着剂次的增加,每剂bOPV引起的排毒量逐渐减少。见表1。第2和第3剂bOPV接种后Ⅰ型脊灰病毒排毒量显著低于第1剂(t分别为3.203和3.672,P分别为0.004和0.001),Ⅲ型脊灰病毒排毒量也显著低于第1剂(t分别为2.633和2.598,P分别为0.015和0.016),随着剂次的推移,其排毒的波峰越来越小。第3剂接种后发现Ⅲ型脊灰病毒的排毒持续时间更长,第3剂接种后第7天仍检测到Ⅲ型脊灰病毒有少量排毒,且第3剂接种后第1和第7天,Ⅲ型脊灰病毒的排毒阳性率和排毒量均高于Ⅰ型。见图1。
2.2 接种第1剂bOPV后排毒量高和排毒量低的个体在后续剂次的排毒情况 将接种第1剂bOPV后排毒量较高的6只小鼠归为一组(高排毒组),另6只排毒量相对较低的小鼠归为一组(低排毒组),对比分析接种首剂bOPV后排毒高和排毒量低的个体在第2和第3剂接种后的排毒情况,结果显示,第1剂接种后(排毒峰值在第3天)高排毒组的Ⅰ和Ⅲ型脊灰排毒量均显著高于低排毒组(t分别为5.056和3.608,P分别<0.001和=0.005);第2剂接种后,首剂高排毒组的Ⅰ型排毒峰值显著低于首剂低排毒组(t=2.313,P=0.043),首剂高排毒组的Ⅲ型排毒峰值略低于首剂低排毒组,但差异无统计学意义(U=11,P=0.285 7)。见图2。
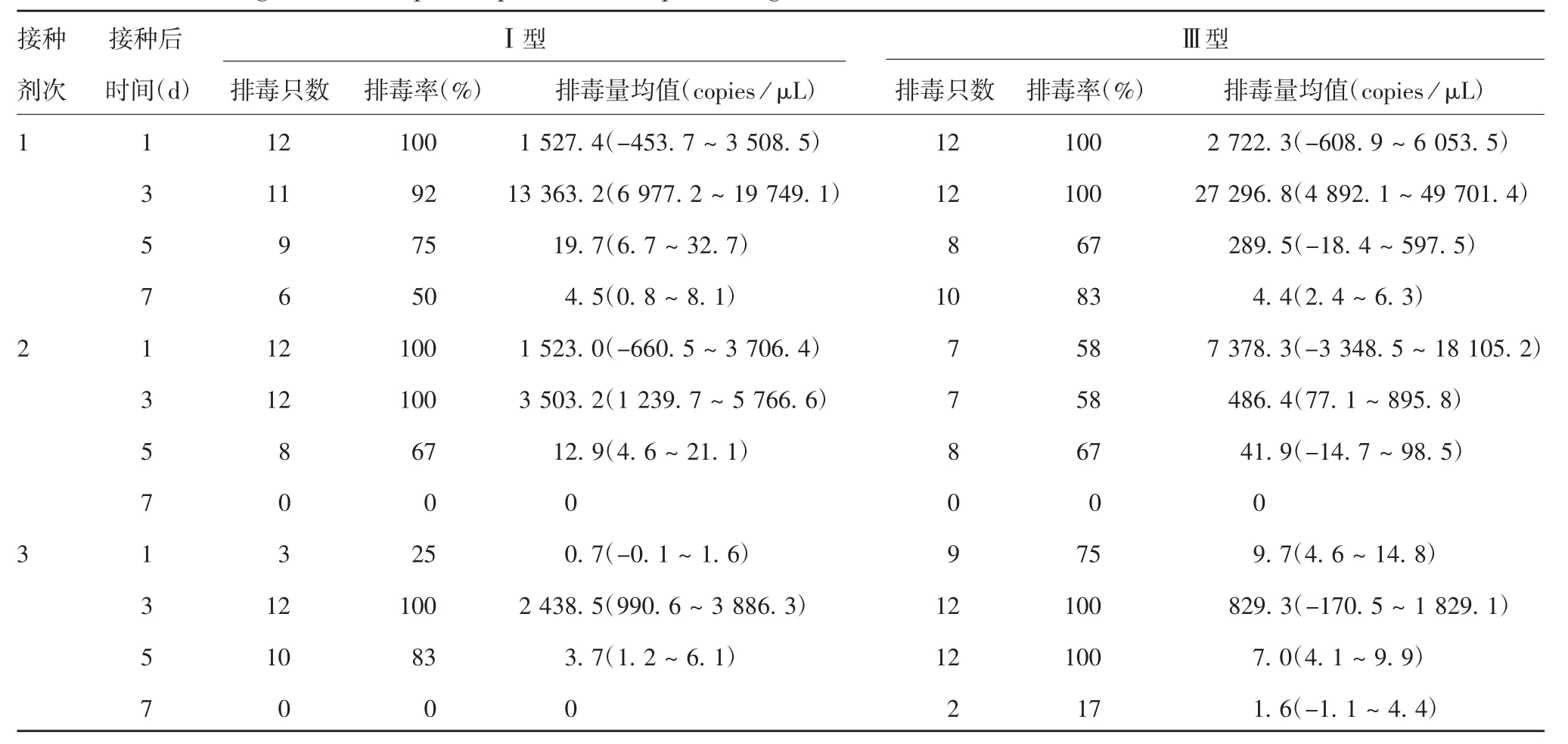
表1接种3剂bOPV后脊灰受体转基因小鼠粪便样本中的脊灰排毒情况Tab.1 Viral shedding in fecal samples of poliovirus receptor transgenic mice after inoculation with three doses of bOPV
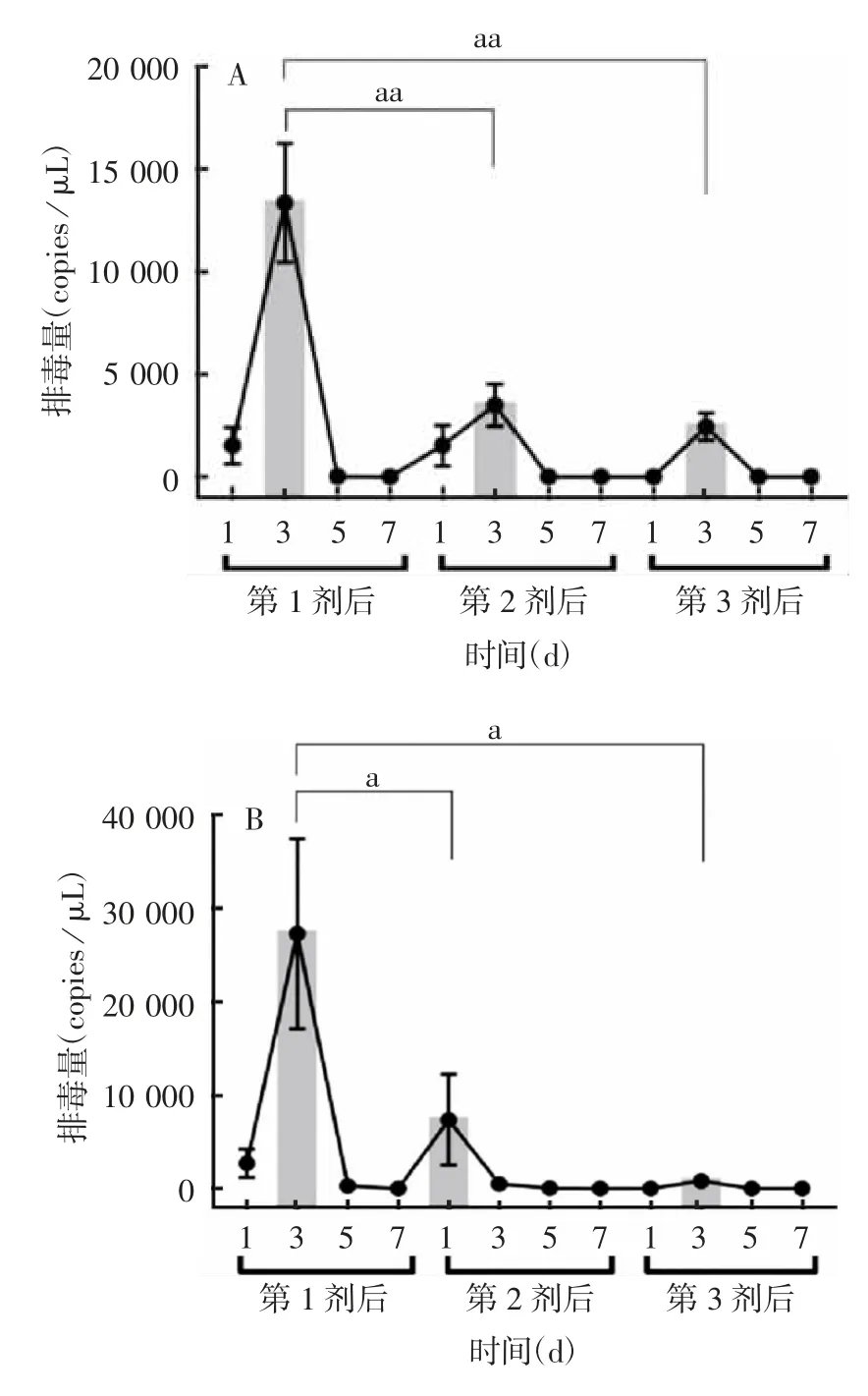
图1 脊灰受体转基因小鼠每剂bOPV接种后Ⅰ型(A)和Ⅲ型(B)的排毒峰值(柱状图)Fig.1 Histogram of peak values of viral shedding of poliovirus receptor transgenic mice after inoculation with bOPV of typesⅠ(A)andⅢ(B)
2.3 排毒与脊灰特异的肠道黏膜IgA的关系 第1、2、3剂接种后,随着接种剂次的增加,脊灰特异的IgA阳性率逐渐升高,IgA呈现阳性的个体数在增加,同时IgA平均水平也有一定程度的上升,见表2。根据第1剂bOPV接种后脊灰特异的IgA是否呈阳性,将小鼠分为第1剂接种后IgA阳性组和阴性组,观察两组之间接种第1剂和第2剂bOPV后排毒的差异,结果显示,第1剂接种后IgA阳性组在第1剂接种后第3天(即排毒的峰值),脊灰排毒量高于阴性组,其中Ⅰ型脊灰排毒量显著高于第1剂接种后IgA阴性组(t=3.989,P=0.003)。相反,第2剂bOPV接种后,第1剂接种后IgA阳性组的Ⅰ和Ⅲ型脊灰排毒量均显著低于阴性组(U分别为5和3,P分别为0.048和0.015)。同样,第2剂bOPV接种后IgA阳性组在接种第3剂bOPV后,其Ⅰ和Ⅲ型脊灰排毒量均低于阴性组,但差异无统计学意义(U分别为8和12,P分别为0.214和0.570)。见图3。
2.4 未接触过bOPV的洁净小鼠与排毒小鼠接触后的排毒情况 与接种bOPV后发生排毒小鼠共居后,部分洁净小鼠有排毒。与高排毒组共居的洁净小鼠有更多个体发生排毒,其中在共居的第3天,与高排毒组共居的洁净小鼠Ⅰ型脊灰排毒率显著高于与低排毒组共居的洁净小鼠(P=0.020)。从排毒量来看,与高排毒组共居的洁净小鼠整体排毒量更高,其中在共居的第3天,与高排毒组共居的洁净小鼠Ⅰ型和Ⅲ型脊灰排毒量均显著高于与低排毒组共居的洁净小鼠(U均为18,P分别为0.014和0.020)。且在与高排毒组共居的第3和第5天,洁净小鼠Ⅲ型脊灰排毒量显著高于Ⅰ型(t分别为3.482和2.324,P分别为0.003和0.032)。见表3和图4。

表2 每剂bOPV接种后脊灰特异的IgA情况Tab.2 Poliovirus-specific IgA in mice after inoculation with each dose of bOPV

图2 第1剂bOPV接种后排毒量高和排毒量低两组小鼠Ⅰ型(A)和Ⅲ型(B)的排毒情况Fig.2 Shedding of poliovirus of typesⅠ(A)andⅢ(B)in mice with high and low viral shedding levels after inoculation with the first dose of bOPV

图3 bOPV接种后排毒与脊灰特异的肠道黏膜IgA的关系Fig.3 Relationship between viral shedding and IgA in intestinal mucosa of mice after inoculation with bOPV
图4 洁净小鼠与高排毒和低排毒组小鼠共居后的排毒量对比Fig.4 Viral shedding levels of clean mice after cohabitation with high and low viral shedding mice

表3 洁净小鼠与接种bOPV后排毒小鼠共居后的排毒情况Tab.3 Viral shedding of clean mice after cohabitation with viral shedding mice after inoculation with bOPV
3 讨论
OPV能提供高水平的肠道黏膜免疫来预防病毒沿粪口途径的传播扩散,这也是其能快速降低发病率的关键,特别是在发展中国家[6]。但由于新的免疫策略比起原脊灰免疫程序中应用了IPV,减少了OPV的使用次数,而IPV激发脊灰特异的肠道黏膜免疫能力有限,因此人群中脊灰特异的黏膜免疫力有所降低[7-9]。本实验利用脊灰受体转基因小鼠动物模型研究bOPV接种后的排毒规律及对周围群体的影响。
首先,通过研究发现,随着bOPV接种剂次的增加,疫苗所引发的排毒量逐渐减少。其次,第1剂bOPV接种后排毒量较高的个体在后续的bOPV接种后,排毒量比首剂排毒量低的个体显著降低,且在第1剂bOPV接种后IgA呈阳性的个体在第1剂接种后第3天(即排毒的峰值),脊灰的排毒量高于IgA呈阴性组。因此,接种首剂减毒活疫苗后排毒亮高的个体由于减毒株的增殖复制,可能引起较高水平的黏膜免疫反应,产生较多脊灰特异的IgA,在后续bOPV接种后能快速中和病毒,减少排毒量。最后,通过观察清洁小鼠与接种过bOPV排毒小鼠共居后的排毒状态,了解bOPV接种后脊灰排毒强弱对周围群体的影响。与高排毒的小鼠共居后,洁净小鼠发生排毒的机率显著高于与低排毒的小鼠共居的洁净小鼠。因此,要达成彻底消灭脊灰的目标,降低脊灰病毒的排毒量是目前的重要任务。另外,通过排毒小鼠与洁净小鼠的共居试验,发现在接触后,Ⅲ型脊灰疫苗株比Ⅰ型更易引起洁净小鼠的排毒反应,排毒量和持续时间更长。这可能与不同脊灰型别的毒株排毒数量、持续性和在环境中存在的稳定性不同有关[10]。
本实验结果显示,接种过bOPV的个体可产生黏,膜免疫快速抑制脊灰病毒的复制,在接种过2剂bOPV后,个体再次接触脊灰病毒几乎不发生排毒。而对于缺乏脊灰特异黏膜免疫的个体一旦接触疫苗株后,特别是与排毒量高的个体接触后,很可能会引起病毒复制和排毒反应。因此,在使用OPV的国家转为使用IPV的过程中,一旦引入疫苗变异株后,可能会引起cVDPV的暴发。
目前在OPV向IPV的过渡阶段,IPV-bOPV序贯免疫是包括我国在内大多数国家采用的免疫程序。目前新的免疫策略比起原脊灰免疫程序中应用了IPV,减少了OPV的使用次数,且未接种Ⅱ型的脊灰减毒活疫苗,因此,脊灰的肠道黏膜免疫力有所降低,人群一旦接触环境中的毒株,易发生排毒反应和毒株变异[11]。事实上,在转换为bOPV后,在我国和多个国家已暴发了多起cVDPV2,WHO已将cVDPV2暴发列为公共国际关注的卫生紧急事件[12]。当前由于全球形势,使用OPV的国家可能需要重新使用OPV2[13]。因此,发展新型脊灰疫苗对于彻底消灭脊灰病毒具有重要意义。通过基因编辑技术,开发新型OPV疫苗,提高Sabin减毒株的遗传稳定性,降低恢复神经毒性的可能性和排毒率,可很好地激发黏膜免疫反应,减少病毒再次入侵后的复制和排毒,有效控制粪口途径的传播。目前新型单价OPV2(novel OPV2,nOPV2)已计划用于应对cVDPV2的暴发[14]。
