云南省保山市健康人群脑膜炎奈瑟菌带菌状况调查
2021-05-19陈晨任远郭妮郑月李育中唐聪谭银珍李娇春王学付寸韡毕研伟
陈晨,任远,郭妮,郑月,李育中,唐聪,谭银珍,李娇春,王学付,寸韡,毕研伟
1.中国医学科学院北京协和医学院医学生物学研究所,云南昆明650031;
2.保山中医药高等专科学校,云南保山678000
脑膜炎奈瑟菌(Neisseria meningitidis,Nm)是引起流行性脑脊髓膜炎(简称流脑)的病原菌[1]。该病多发于儿童,人群隐性感染多,发病率、病死率均较高。Nm可分为13个血清群,能引起侵袭性流脑的菌株多具有完整的荚膜结构,包括A、B、C、Y、W135和X群[2]。无症状带菌者是该病的主要传染源,健康人群带菌情况与流脑疫情趋势呈现一定的相关性[3]。
保山市位于云南省西南部,处于滇西居中,是中国通往南亚、东南亚乃至欧洲各国的必经之地,其西北、正南部与缅甸交界,而缅甸等部分东南亚国家尚未将流脑疫苗列为国家常规接种疫苗,随着边境地区人员迁徙与流动,时有从缅甸输入流脑病例的报道[4]。保山市近年来脑膜炎奈瑟菌流行病学调查数据缺乏,因此,本研究选择保山市作为调查区域。
青年人群由于升学更易出现来自不同地区人员的学校聚集,这使得青年人群成为流脑暴发高危人群,而在中国,流脑疫苗主要针对的接种对象为婴幼儿及3岁或6岁儿童,本研究选择在18~22岁健康人群中调查脑膜炎奈瑟菌携带状况,可为中国青年人接种流脑疫苗提供参考,为今后流脑疫情监测提供依据。
1 材料与方法
1.1 样本来源 本次调查选择保山市隆阳区一高校作为调查点,采用随机抽样的方法,于2020年12月随机抽取1 076名18~22岁且处于健康状态的学生采集咽拭子样本,共采集样本1 076份。
1.2 参考菌株Nm标准菌株共5株,分别为A、B、C、W135、Y群,由中国医学科学院医学生物学研究所保存。
1.3 主要试剂 巧克力双抗平板(含3.3μg/mL盐酸万古霉素和4.2μg/mL硫酸多黏菌素)培养基购自广东环凯微生物科技有限公司(货号:J0612Y);Taq DNA聚合酶等购自康为世纪生物科技有限公司(货号:CW0655M)。
1.4 采样及培养 受试者签署知情同意书后采集咽拭子标本,立即接种于巧克力双抗平板,37℃,5%CO2条件下培养24~48 h。
1.5 分离鉴定 挑取圆形,光滑,湿润,中央凸起,边界清晰,无色或灰色,不透明的菌落,转接于新的巧克力双抗平板,再次培养24 h,同时将标准菌株(B群)平板划线,在相同条件下培养作为阳性对照;挑取菌落,溶解至1 mL PBS(pH 7.4)中,制备为菌悬液,取少量菌悬液,滴加至载玻片上进行革兰染色,取B群标准菌株平板上菌落作为阳性对照,双球形的菌株进行PCR鉴定和分群。
1.6 PCR鉴定和分群 挑取单菌落为模板进行PCR检测。首先对流脑通用基因荚膜转运基因(crgA)和铜-锌超氧化物歧化酶基因(sodC)进行扩增,确定为Nm阳性菌落;再对各血清群特异性基因进行扩增,以确定血清群。扩增体系为:2×taq DNA聚合酶预混液5μL,引物(10μmol/L)各0.2μL,模板0.2μL,无菌水加至10μL。以标准菌株(B群)的crgA和sodC基因作为阳性对照,无菌水作为阴性对照。反应条件:95℃10 min;95℃30 s,56℃30 s,72℃1 min,共29个循环;最后72℃延伸5 min。引物由上海捷瑞生物工程有限公司合成,引物序列、靶基因及扩增片段长度见表1[5]。
1.7 统计学分析 采用Excel软件对检测数据进行录入整理,计算带菌率,分析各血清群分布情况。

表1 引物序列、靶基因及扩增片段长度Tab.1 Primer sequence,target gene and lengths of amplified fragments
2 结果
2.1Nm菌株的分离鉴定 咽拭子样本接种于巧克力双抗平板后培养24~48 h,Nm阳性菌株可生长为湿润,略带灰色半透明的圆形菌落,见图1。挑取单菌落进行革兰染色镜检,可鉴定为红色,双球形的革兰阴性菌,见图2。
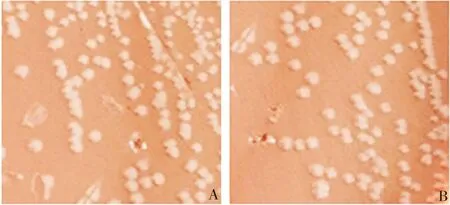
图1 咽拭子样本涂板后培养24 hFig.1 Pharyngeal swab samples spread and cultured for 24 h
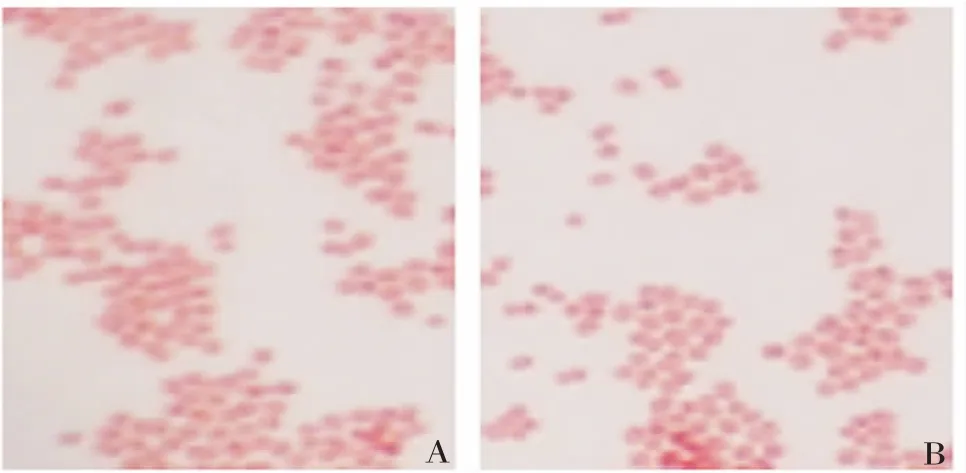
图2 细菌培养后经革兰染色镜检(×100)Fig.2 Microscopy of bacterial culture after Gram staining(×100)
2.2 血清学分群PCR检测结果显示,Nm阳性菌株可见crgA和sodC基因条带,见图3。阳性菌株经血清学分群,A群可见400 bp的orf-2基因条带,B群可见180 bp的synD基因条带,C、Y、W135群分别可见250、120和120 bp的siaD基因条带,X群可见120 bp的ctrA基因条带,见图4。
2.3 调查结果1 076份咽拭子样本中,经细菌培养和PCR检测共鉴定出Nm阳性样本17份,带菌率为1.58%,其中B群菌株14份,C群菌株2份,X群菌株1份。

图3 Nm crgA(A)和sodC(B)基因的PCR产物电泳图Fig.3 Electrophoretic profile of PCR products of Nm crgA(A)and sodC(B)genes
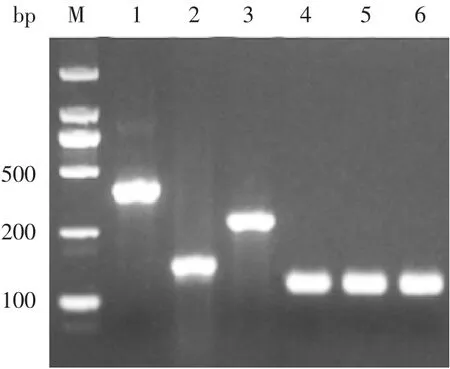
图4 Nm特异性分群基因PCR产物电泳图Fig.4 Electrophoretic profile of PCR products of Nm specific clustering genes
3 讨论
Nm所导致的流脑是一种急性的呼吸道感染疾病,临床诊断通常以出现发热、呕吐、头痛为依据,该病多发于儿童,起病急,人群隐性感染多,发病率和病死率均较高。对于健康人群流脑的携带情况进行调查,可有效监测流脑的流行趋势,及时采取措施,有效预防流脑疫情发生。目前对流脑的实验室检测方法较多,包括细菌分离培养、免疫学检测、普通PCR检测、Real-time PCR检测等。PCR是一种较常用的检测方法,具有灵敏度较高,检测快速,准确的优点,前期通过对于实验方法的探索,证实PCR法对于流脑检出的灵敏度可达1 copy/mL。其中细菌分离培养的方法虽繁琐且耗时长,咽拭子标本若不及时涂板,易导致标本失效,但这种方法可通过平板扩增,使菌种得以保留,为后续流脑疫苗的进一步研究提供材料。由于正常人群口腔中有葡萄球菌、链球菌、大肠埃希菌、白色念珠菌等几百种细菌类型,咽拭子接种于抗性巧克力平板,平板上生长的菌群类型相较于无抗性的平板更单一,更有利于筛选出Nm,因此,本研究采用了含双抗的巧克力平板,提高了检出概率。同时,联合PCR法准确确定了样本中携带的Nm的血清型。crgA和sodC基因是Nm保守的调控基因,可用于阳性菌株的鉴别,但不能用于血清学分群。编码唾液酸转移酶的siaD基因对于不同血清群的Nm具有特异性,因此可用于NmB、C、Y、W135等血清群的分群,A群Nm的荚膜多糖不是唾液酸,因此对于A群Nm荚膜表达基因的第2个ORF序列进行扩增,可特异性地检出A群Nm。
中国曾在1959、1967、1977和1985年发生了4次流脑大流行[2],1980年以来,A群流脑多糖疫苗开始在我国接种,使得流脑暴发率显著降低,自2008年《扩大免疫规划实施方案》实施,流脑疫苗作为免费一类疫苗,接种人群大幅增加,但2008年以前出生的人群大多无流脑疫苗免疫史,有必要对这类人群进行流脑带菌率调查,有效预测流脑传播和暴发趋势。本次调查结果显示,保山市18~22岁健康人群中Nm携带率为1.58%,与新疆等中国其他地区报道的调查数据相比[6],保山市健康青年人群Nm携带率处于较低水平。
中国历史上流行的流脑菌株以A群为主[6],由于A群和A+C群Nm疫苗的广泛使用,A、C群流脑病例呈持续下降趋势,由于B群流脑疫苗尚未广泛接种,目前中国流脑血清群分布以B群为主[7]。云南省近年来在健康人群中发现的Nm菌群有A、B、C群,人群抗体水平不高,对流脑的免疫力较弱[8]。在本次调查中,B群在Nm阳性样本中所占比例最高,C群次之,未发现A群Nm阳性样本,这与文献报道一致[7]。另外,本次调查发现1例X群阳性样本,这是首次在云南省健康人群中分离出X群流脑菌株。X群Nm自20世纪90年代以来在非洲流行[9-10],中国少有X群Nm的报道[11],此次分离出X群阳性菌株,表明X群Nm在中国西南地区已出现,因此,关注流脑菌群变迁,加强监测,及按计划接种流脑疫苗仍今后流脑防控工作的关键。
