蒙药肉桂对脂多糖诱导血管内皮细胞凋亡的保护作用及其机制
2021-05-19宋利华任向宇杨航殷兆丽孙晓琳李恋福泉包丽丽
宋利华,任向宇,杨航,殷兆丽,孙晓琳,李恋,福泉,包丽丽
1.内蒙古医科大学基础医学院,内蒙古 呼和浩特010059;
2.内蒙古医科大学附属医院,内蒙古呼和浩特010050
血管内皮细胞是构成动脉、静脉和毛细血管的单细胞层,在血管腔内的循环血液和血管壁之间形成一道屏障,可维持血管结构和功能的稳定[1]。当血管内皮细胞受损时,其功能与平衡稳定性被破坏,诱发脓毒症、糖尿病、动脉粥样硬化和血管炎等多种疾病[2-5]。脂多糖(lipopolysaccharide,LPS)又称为内毒素,位于革兰阴性菌细胞外膜的主要成分,是重要的毒力因子[6],可通过诱导组织细胞释放TNF-α、IL-6等细胞因子,促进血管内皮细胞的黏附以及炎症反应,进而引起内皮细胞的损伤[7]。
肉桂(cinnamon)又称嘎必拉音·哈利苏,为樟科樟属植物肉桂(Cinnamomum cassia Presl)的干燥树皮,是重要的香料和药材,属于传统蒙药里的镇赫依药物,具有多种生物活性,包括抗菌、抗氧化、抗炎、抗癌、降血糖、抗心血管疾病等作用[8-10],临床上常用于糖尿病、肾病、肿瘤以及心血管系统疾病等的治疗[9]。
本研究以LPS作为诱导剂,构建人脐静脉血管内皮细胞(human umbilical vein endothelial cells,HUVECs)损伤模型,观察肉桂对LPS诱导的HUVECs损伤的保护性作用,并探讨其可能的机制。
1 材料与方法
1.1 肉桂 肉桂购自安国市荣华本草中药材有限公司。
1.2 细胞株HUVECs由内蒙古大学阿拉坦高勒教授惠赠。
1.3 主要试剂LPS和DMSO购自美国Sigma-Aldrich公司;PBS和青-链霉素购自美国HyClone公司;胎牛血清和DMEM高糖培养基购自以色列Biological Industries公司;胰蛋白酶购自美国Gibco公司;CCK-8试剂盒购自美国Apexbio公司;TNF-α ELISA试剂盒购自上海江莱生物科技有限公司;RTPCR试剂盒购自上海翊圣科技有限公司;RNAiso Plus购自日本TaKaRa公司;BCA蛋白定量分析试剂盒购自江苏凯基生物技术股份有限公司;兔抗PARP多克隆抗体和兔抗p-mTOR多克隆抗体购自美国ImmunoWay Biotechnology公司;兔抗GAPDH多克隆抗体购自美国Bioworld Technology公司;HRP标记的山羊抗兔IgG购自沈阳万类生物科技有限公司;ECL化学发光试剂购自上海雅酶生物科技有限公司。
1.4 细胞培养HUVECs用含10%胎牛血清、100 U/mL青霉素和100μg/mL链霉素的DMEM高糖培养基,于37℃,5% CO2细胞培养箱中培养。
1.5 肉桂水提物的提取及肉桂溶液的制备 称取100 mg肉桂粉碎至粉末状,加入蒸馏水浸泡24 h,超声仪破碎5 min,用纱布过滤除去残渣后,500×g离心10 min,取上清,分装于圆底烧瓶中,于乙醇冷冻机上冷冻2 h;待肉桂溶液完全冻于烧瓶壁上后,将烧瓶取下,安装于冷冻干燥机上,冷冻干燥24 h。将冻干的肉桂取出,称重,计算提取率。无菌条件下取适量的DMSO溶液,加入装有肉桂水提物的离心管内,反复吹打,使肉桂完全溶解(肉桂工作液中DMSO浓度小于0.1%),用0.22μm滤膜过滤,分装,置-20℃保存。每次加药前用无血清的DMEM高糖培养基稀释至目标浓度。
1.6 LPS诱导浓度的筛选 取对数生长期的HUVECs,按5×103个/孔接种于96孔板,将细胞分为空白对照组(不接种细胞)、阴性对照组(接种细胞不加LPS)、不同浓度(0.01、0.1、1、10、20μg/mL)LPS处理组,每组设4个复孔。给药24 h后,弃上清,每孔加入100μL无血清培养基和10μL CCK-8试剂,继续培养1~4 h。酶标仪检测450 nm波长处各孔吸光度值,并按下式计算细胞存活率。

1.7 肉桂给药浓度的筛选 取对数生长期的HUVECs,按5×103个/孔接种于96孔板,将细胞分为空白对照组(不接种细胞)、阴性对照组(接种细胞不加肉桂)、不同浓度(0.5、2、5 mg/mL)肉桂处理组,每组设4个复孔。给药24 h后,弃上清,每孔加入100μL无血清培养基和10μL CCK-8试剂,继续培养1~4 h。酶标仪检测450 nm波长处各孔吸光度值,并计算细胞存活率(公式同1.6项)。
1.8 肉桂对LPS诱导的HUVECs存活率影响的检测 待HUVECs融合度达75%~85%时,按5×103个/孔接种于96孔板,将细胞分为对照组、LPS组和LPS+肉桂组,对照组加入无血清DMEM培养基培养;LPS组用含筛选浓度LPS的无血清培养基培养24 h;LPS+肉桂组预先加入筛选浓度的LPS孵育24 h,再加入筛选浓度的肉桂培养24 h;弃上清,每孔加入100μL无血清培养基和10μL CCK-8试剂,继续培养1~4 h。酶标仪检测450 nm波长处各孔吸光度值,并计算细胞存活率(公式同1.6项)。
1.9 肉桂对LPS诱导的HUVECs培养上清中TNF-α含量影响的检测 采用ELISA法。取对数生长期的HUVECs,按3×105个/孔接种于6孔板,细胞分组及处理同1.8项,收集各组细胞培养上清液,按TNF-αELISA试剂盒说明书操作,在酶标仪450 nm波长处测定各孔吸光度值,检测细胞培养上清中TNF-α的含量。
1.10 肉桂对LPS诱导的HUVECs中PARP(116 kD)、UCP2基因mRNA水平影响的检测 采用实时荧光定量PCR法。细胞分组及处理同1.8项,用RNAiso Plus提取各组细胞总RNA,逆转录合成cDNA,按照RT-PCR试剂盒说明操作,检测各组细胞PARP(116 kD)、UCP2基因mRNA水平。反应条件为:95℃预变性30 s;95℃变性3 s,退火/延伸72℃32 s,40个循环。用融点曲线进行循环后分析,在60~95℃之间测定,每个样本设3个复孔。以βactin为内参,使用2-△△Ct法进行相对定量分析。引物序列见表1。引物由生工生物工程(上海)股份有限公司合成。
1.11 肉桂对LPS诱导的HUVECs中PARP(89 kD)、p-mTOR蛋白表达水平影响的检测 采用Western blot法。细胞分组及处理同1.8项,使用RIPA裂解液提取各组细胞总蛋白,BCA蛋白定量分析试剂盒对提取的蛋白进行定量,取30μg蛋白样品经8%和12%的SDS-PAGE胶分离后,湿转至PVDF膜上,将膜放于含5%脱脂奶粉的封闭液中,置于室温摇床上封闭1 h;分别加入PARP(1∶2 000稀释)、p-mTOR(1∶2 000稀释)、GAPDH(1∶10 000稀释)抗体,于4℃冰箱孵育过夜;1×TBST洗膜3次,10 min/次,加入HRP标记的山羊抗兔IgG(均为1∶10 000稀释),于摇床上室温孵育1 h;1×TBST清洗3次,10 min/次,用ECL化学发光显色液进行显色,在暗室里用X光胶片进行压片,曝光并用显影液显影,扫描底片后用Gel-pro Analyzer 4.0分析软件分析灰度值。重复3次试验。
1.12 统计学分析 采用SPSS 22.0统计学软件进行数据分析,计量资料以均数±标准差表示,组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 LPS诱导浓度的筛选 随着LPS浓度的增加,HUVECs的存活率逐渐下降,浓度为1、10、20μg/mL的LPS作用24 h后,与对照组相比,组间差异有统计学意义(F=27.150,P分别为0.029、0.000 1和0.000 1),表明LPS对HUVECs存活率的抑制作用呈浓度依赖性,见图1。选择1μg/mL作为LPS诱导浓度。
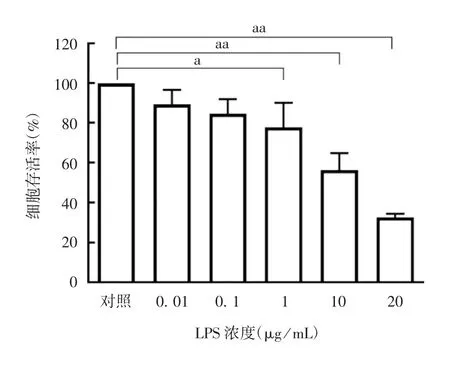
图1 CCK-8法检测不同浓度LPS对HUVECs存活率的影响Fig.1 Determination of effects of different concentrations of LPS on survival rate of HUVECs by CCK-8 method
2.2肉桂给药浓度的筛选 不同浓度肉桂对HUVECs的存活率无显著影响,组间差异无统计学意义(F=3.836,P=0.113 8),见图2,因此选择2 mg/mL作用24 h作为肉桂给药条件。
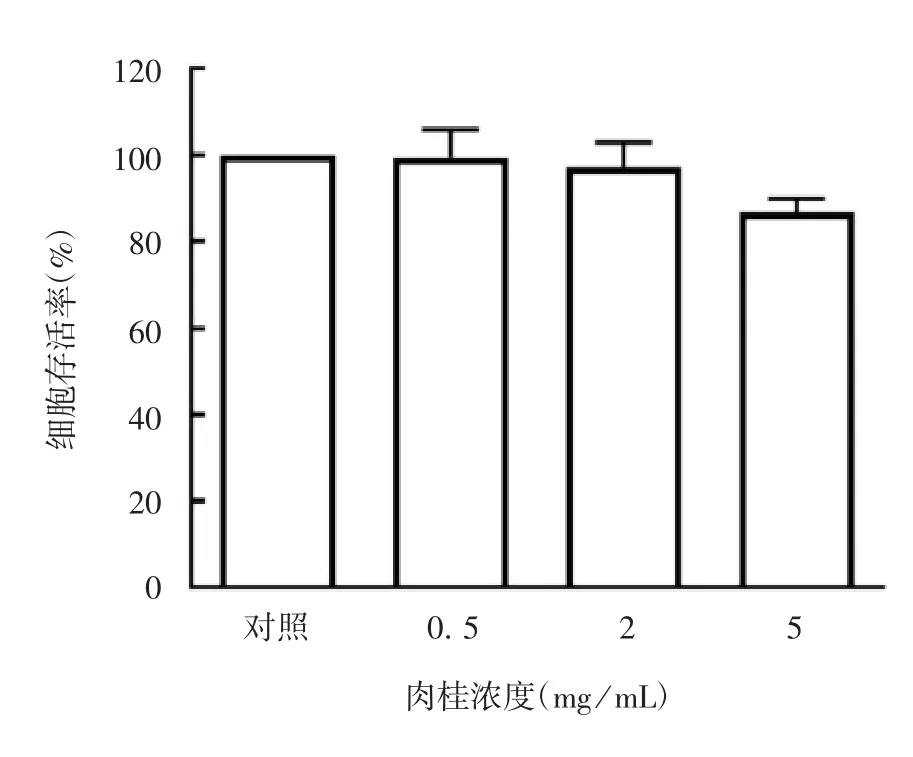
图2 CCK-8法检测不同浓度肉桂对HUVECs存活率的影响Fig.2 Determination of effects of different concentrations of cinnamon on survival rate of HUVECs by CCK-8 method
2.3 肉桂对LPS诱导的HUVECs存活率的影响与对照组相比,LPS组HUVECs的存活率显著降低(F=17.13,P=0.021);与LPS组相比,LPS+肉桂组细胞存活率显著升高(F=17.13,P=0.029),见图3。表明肉桂对LPS诱导的细胞损伤具有一定的保护作用。
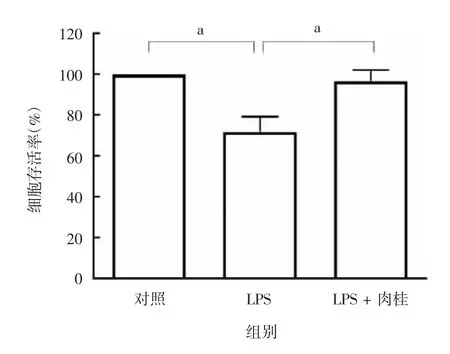
图3 CCK-8法检测各组HUVECs的存活率Fig.3 Determination of survival rate of HUVECs in various groups by CCK-8 method
2.4 肉桂对LPS诱导的HUVECs培养上清中TNF-α含量的影响 与对照组相比,LPS组HUVECs培养上清液中TNF-α含量显著升高(F=2 436,P=0.000 1);与LPS组相比,LPS+肉桂组TNF-α含量显著降低(F=2 436,P=0.000 1),见图4。表明肉桂可显著降低LPS诱导的HUVECs分泌细胞因子TNF-α。
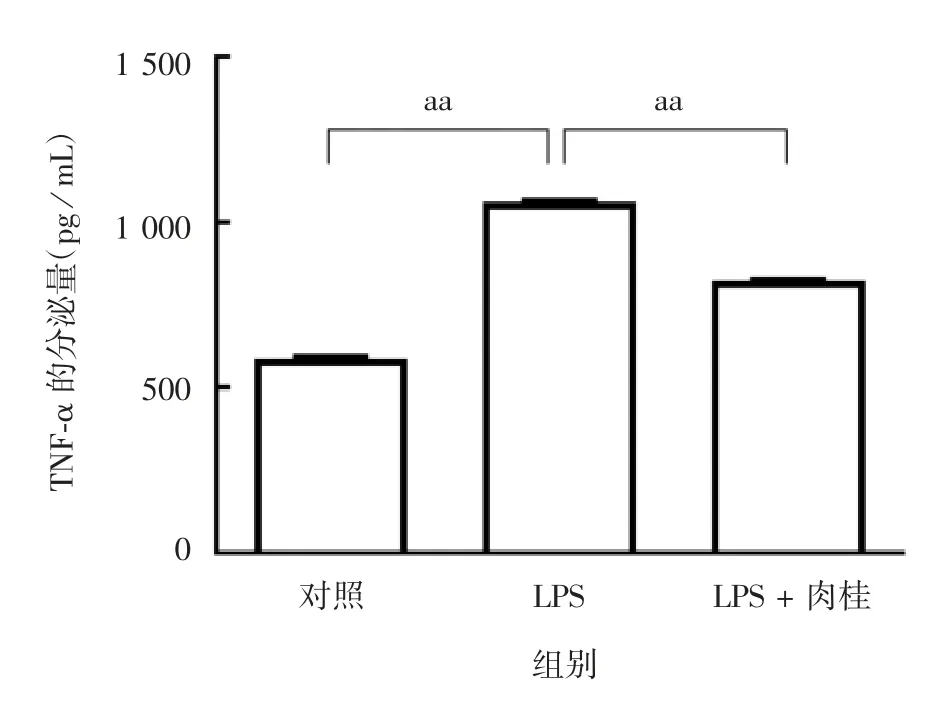
图4 ELISA法检测各组HUVECs培养上清中的TNF-α含量Fig.4 ELISA of TNF-αcontent in culture supernatant of HUVECs in various groups
2.5 肉桂对LPS诱导的HUVECs中PARP(116 kD)、UCP2基因mRNA水平的影响 与对照组相比,LPS组HUVECs中PARP(116 kD)和UCP2基因mRNA水平显著降低(F分别为12.09和17.86,P分别为0.002 6和0.024 9);与LPS组相比,LPS+肉桂组PARP(116 kD)和UCP2基因mRNA水平显著升高(F分别为12.09和17.86,P分别为0.006 6和0.000 4),见图5。表明肉桂对LPS诱导的细胞凋亡具有保护性作用。
2.6 肉桂对LPS诱导的HUVECs中PARP(89 kD)、p-mTOR蛋白表达的影响 与对照组相比,LPS组HUVECs中PARP(89 kD)和p-mTOR蛋白的表达水平显著升高(F分别为196.8和21.12,P分别为0.008和0.013);与LPS组相比,LPS+肉桂组PARP(89 kD)和p-mTOR蛋白的表达水平显著降低(F分别为196.8和21.12,P分别为0.000 5和0.037),见图6和图7。表明肉桂对LPS诱导的细胞凋亡具有保护性作用,且具有m-TOR依赖性。
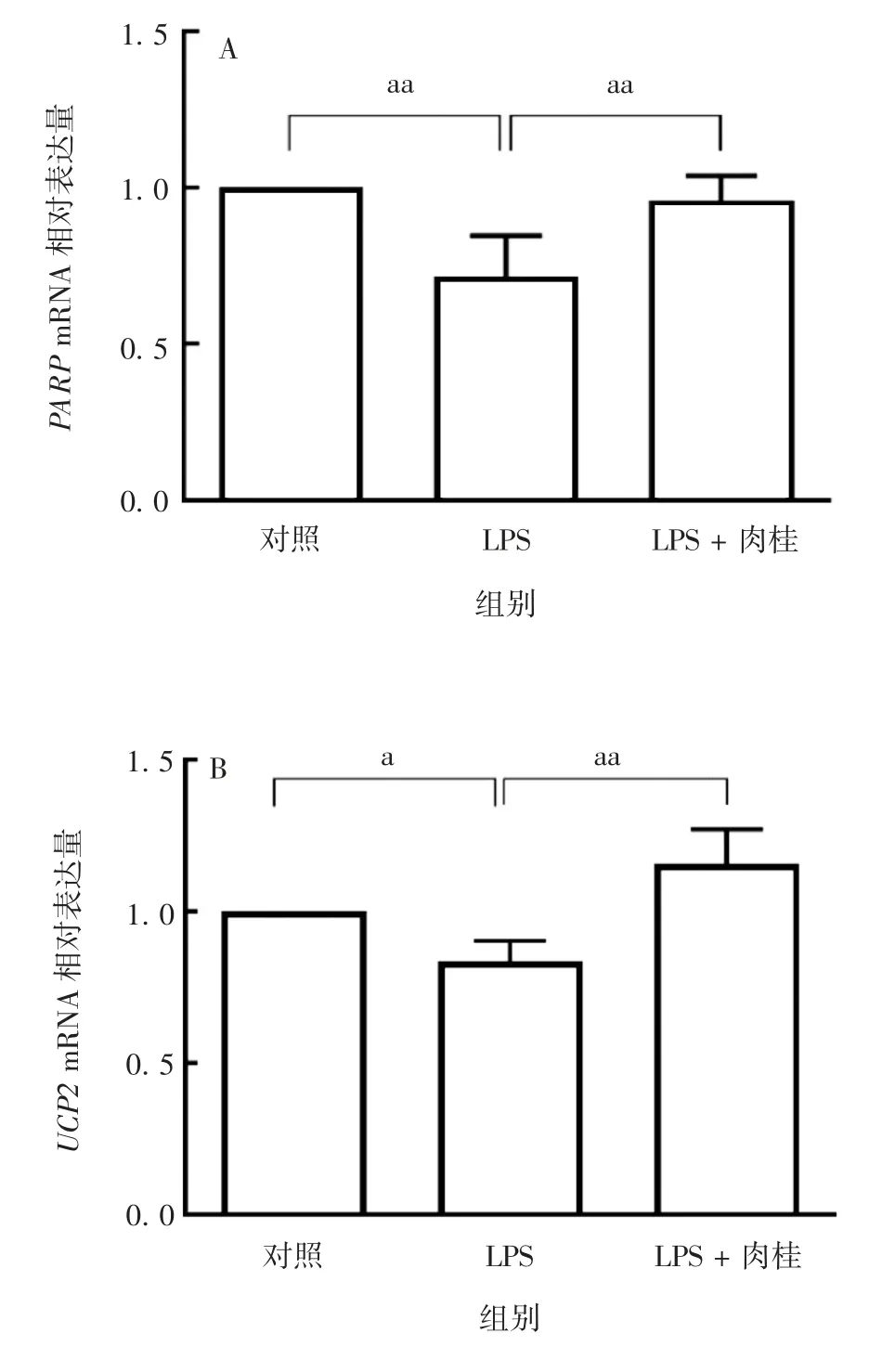
图5 实时荧光定量PCR法检测各组HUVECs中PARP(116 kD)(A)和UCP2(B)基因mRNA水平Fig.5 Transcription levels of PARP(116 kD)(A)and UCP2(B)mRNAs in HUVECs of various groups by real-time fluorescence quantitative PCR

图6 Western blot检测各组HUVECs中PARP(89 kD)和p-mTOR蛋白的表达Fig.6 Western blotting of expressions of PARP(89 kD)and p-mTOR proteins in HUVECs of various groups

图7 各组HUVECs中PARP(89 kD)(A)和p-mTOR(B)蛋白的表达水平Fig.7 Expression levels of PARP(89 kD)(A)and p-mTOR(B)proteins in HUVECs of various groups
3 讨论
炎症是血管内皮细胞损伤的主要原因,LPS在体内外均是炎症反应的触发因素,可诱导巨噬细胞系统产生TNF-α、IL-6等细胞因子,进而调节并影响内皮细胞的功能[11]。血管内皮细胞的凋亡和功能障碍在动脉粥样硬化、血管炎和脓毒症等炎症相关疾病发病机制中起重要作用[2]。细胞凋亡是细胞损伤的主要形式之一,其特征是半胱氨酸天冬酶(cysteine aspartic acid-specific proteases,Caspase)的激活,这是一种高度特异的蛋白酶,可裂解广泛的细胞内底物。PARP(poly ADP-ribose polymerase)蛋白相对分子质量为116 kD,是真核细胞内的一种DNA修复酶,细胞发生凋亡时可被caspase 3剪切为89 kD的小片段,PARP被剪切是细胞凋亡的重要指标[12]。细胞凋亡可分为3种途径,包括死亡受体途径、线粒体途径和颗粒酶B途径。
蒙药肉桂及其活性成分具有多种生物活性。研究发现,肉桂水提取物体外可降低LPS处理的巨噬细胞TNF-αmRNA水平[13]。本研究采用LPS诱导HUVECs损伤,探讨蒙药肉桂对LPS诱导细胞凋亡的保护性作用机制,结果表明,肉桂可通过抑制116 kD PARP的水解、TNF-α等炎症因子的释放及调控UCP2的表达水平而降低细胞凋亡。当细胞受到刺激时,线粒体内外膜之间通透性转运孔(mitochondrial permeability transport pore,MPT)开放,可使线粒体膜的通透性增加、线粒体肿胀,线粒体稳定性的破坏使细胞色素C等因子释放入胞浆,继而引发细胞凋亡。UCP2作为一种线粒体内膜上的蛋白,具有抑制MPT开放,阻止线粒体途径的细胞凋亡发生的作用[14]。研究发现,胰腺癌细胞中,抑制UCP2会以ROS依赖的机制激活Akt/mTOR通路,导致caspase介导的癌细胞凋亡的发生[15]。肉桂作用于血管内皮细胞,可能是通过线粒体途径,促进细胞内UCP2 mRNA水平的表达,减少mTOR的磷酸化,进而调节细胞凋亡的发生。
综上所述,本研究表明,蒙药肉桂对LPS诱导的血管内皮细胞损伤具有保护性作用,其作用机制可能是通过抑制线粒体途径而减少细胞凋亡的发生。因此,肉桂在心血管疾病的预防及治疗领域具有一定的临床意义及应用价值。
