中国荷斯坦奶牛TLR1和CBLB基因SNP位点筛选及分析
2021-05-19刘娟韩硕邹紫雯李鑫丽罗林沈冰蕾
刘娟,韩硕,邹紫雯,李鑫丽,罗林,沈冰蕾
黑龙江八一农垦大学动物科技学院,黑龙江大庆163319
单核苷酸多态性(single nucleotide polymorphisms,SNP)主要是指由于单个碱基的改变引起基因组水平上的DNA序列多态性。SNP主要有2种表现形式:一种称为转换,即一个嘌呤被另一个嘌呤所代替,或一个嘧啶被另一个嘧啶所代替;一种称为颠换,即一个嘌呤被一个嘧啶所代替,或一个嘧啶被一个嘌呤所代替。转换和颠换比例约为2∶1,且多发生在T碱基与C碱基之间[1]。现阶段检测SNP的方法为将DNA混合后进行基因PCR扩增全长测序,与原序列进行比对找出SNP位点。
Toll样受体(Toll-like receptor,TLR)作为动物机体重要的模式识别受体,广泛存在于各类免疫细胞表面[2]。Toll样受体1(Toll-like receptor 1,TLR1)作为TLR家族的主要成员之一,对于引发和调节病原微生物的病原体的免疫反应具有重要作用。目前已发现TLR1基因可定位在6号染色体上,具有丰富的遗传多态性。研究表明,TLR1基因与中国荷斯坦奶牛的许多炎症相关疾病相关[3],具有显著影响泌乳性状和临床乳房炎的数量性状位点。OPSAL等[4]发现,挪威红牛TLR1基因第272位的C>T突变对乳房炎发生无影响。李春苗等[5]发现,中国荷斯坦奶牛TLR1基因mRNA区有4个SNP位点,且第1 596位的G>A突变位点产生的不同基因型对体细胞数影响极显著。
泛素化修饰是蛋白质转录后的重要调节形式,泛素化的过程与一系列的催化酶有关。包括泛素激活酶(E1)、泛素结合酶(E2)、泛素连接酶(E3)[6]。其中E3泛素连接酶是整个泛素化过程中最重要的部分,并且决定了泛素化的特异性。Cbl原癌基因B(Cbl proto-oncogene B,CBLB)是一种E3泛素连接酶,最初通过抑制T细胞和B细胞受体信号而被确定为适应性免疫应答的负调节因子。CBLB通过控制参与T细胞刺激的关键分子来限制T细胞抗原受体(T cell receptor,TCR)的激活[7],对于维持外周T细胞耐受性比较重要,并且其缺失会导致TCR信号转导增加,从而导致自身免疫[8]。最近的研究揭示了CBLB在NK细胞、肥大细胞、整联蛋白信号传导和树突细胞中的其他作用,将CBLB功能的范围扩展至先天免疫系统的细胞。由于CBLB对T细胞活化、耐受诱导和TH2/9细胞分化至关重要[9]。在没有CBLB情况下增强的抗真菌免疫力可能会导致适应性T细胞应答增强。因此,CBLB是先天性抗真菌免疫的第一个负调节因子,抑制CBLB可能通过失调适应性免疫而引起不该出现的副作用,但其在先天免疫反应中的作用尚不清楚。
本研究对中国荷斯坦奶牛的TLR1和CBLB基因进行SNP检测并对其进行生物信息学分析,为中国荷斯坦奶牛的遗传改良提供依据。
1 材料与方法
1.1 样品300头中国荷斯坦奶牛均购自黑龙江省绥化市裕达牧业有限公司。每头牛尾静脉采血10 mL,用柠檬酸钠抗凝处理后置-40℃保存。利用DNA提取试剂盒[购自天根生化科技(北京)有限公司]提取冻存的奶牛血液基因组DNA,经1%琼脂糖凝胶电泳和Nandrop2000仪检测DNA质量和浓度,于-40℃保存。
1.2 引物设计、合成及目的基因扩增 参照NCBI数据库中收录的牛(Bos taurus)TLR1基因CDS区(NM_001046504.1)及CBLB基因18外显子(NM_001205923.2)序列分别设计特异性引物。TLR1-F序列:5′-ATGCCTGACATCCTCTCACT-3′,TLR1-R序列:3′-TTAATTTATTTCTGCTGCTTTTTCC-5′,目的片段长度预计为2 148 bp;CBLB-F序列:5′-GCTTATGACATGGGGTGGGA-3′,CBLB-R序列:3′-AGCATCTTGTAAATGGGAGAAAT-5′,目的片段长度预计为1 240 bp。引物由哈尔滨适合生物有限公司合成。采用DNA混池法进行PCR扩增。扩增体系(25μL):DNA混池模板1μL,上、下游引物各1μL,2×Power Taq PCR Master Mix 12.5μL,用灭菌蒸馏水补充至25μL。反应条件:95℃预变性5 min:94℃变性30 s,TLR1基因59℃退火30s、CBLB基因62℃退火30 s,72℃延伸30 s,共35个循环;72℃延伸10 min;4℃保存。PCR产物经1%琼脂糖凝胶电泳0.5 h后,用凝胶成像系统进行检测。
1.3 序列测定及分析 将PCR产物送至尔滨适合生物有限公司进行纯化后双向测序。使用chromas软件、MEGA 6软件对测序结果进行拼接,确定中国荷斯坦奶牛TLR1和CBLB基因的SNP位点。利用MWSnap软件对SNP位点的峰图高度进行测量,并按下式估算各个SNP位点的等位基因频率。

式中,F表示等位基因B或C在SNP位点中的等位基因频率;B和C表示等位基因在SNP位点中的峰高。
1.4 生物信息学分析 中国荷斯坦奶牛TLR1和CBLB基因mRNA二级结构运用在线程序(RNA fold web server服务器)预测。分别运用在线分析软件AAcompldent(https://web.expasy.org/protparam/)、expasy(https://web.expasy.org/protscale/)、Net-NGlyc1.0(http://www.cbs.Dtu.dk/services/NetNGlyc/)、NPS@pages(https://npsa-prabi.ibcp.fr/cgibin/secpred_gor4.pl)以及在线程序SWISS MODEL,对其编码的蛋白质理化性质、疏水性和亲水性、N-糖基化位点、二级结构、三级结构进行分析。
2 结果
2.1TLR1和CBLB基因PCR产物鉴定TLR1基因CDS区外显子和CBLB基因的18外显子PCR扩增产物经1%琼脂糖凝胶电泳分析,可见引物特异性效果较好,PCR产物单一,有明显的目的条带,大小与预期一致,见图1。
2.2TLR1和CBLB基因测序结果 利用chromas软件和MEGA 6软件对测序结果进行拼接后,在TLR1基因CDS区发现4个SNP位点,分别为C1424A、A1475C、G1496A和G1550A。其中C1424A位点由苯丙氨酸(Phe)变为亮氨酸(Leu),G1496A位点由色氨酸(Trp)变为不翻译。A1475C和G1550A位点氨基酸未发生改变。CBLB基因18外显子区发现1个SNP位点,为G222406T,并且该位点由天冬氨酸(Asp)转变为酪氨酸(Tyr)。见图2。

图1 中国荷斯坦奶牛TLR1和CBLB基因PCR产物电泳图Fig.1 Electrophoretic profile of PCR products of TLR1 and CBLB genes of Chinese Holstein cows

图2 中国荷斯坦奶牛TLR1和CBLB基因测序及SNP位点比对Fig.2 TLR1 and CBLB gene sequencing and SNP locus comparison of TLR1 and CBLB genes
2.3 SNP位点等位基因频率估算TLR1基因4个SNP位点突变前后的等位基因频率均有明显差异,而CBLB基因SNP位点突变前后等位基因频率差值为0.024 8,该SNP位点突变前后差异较小,见表1。
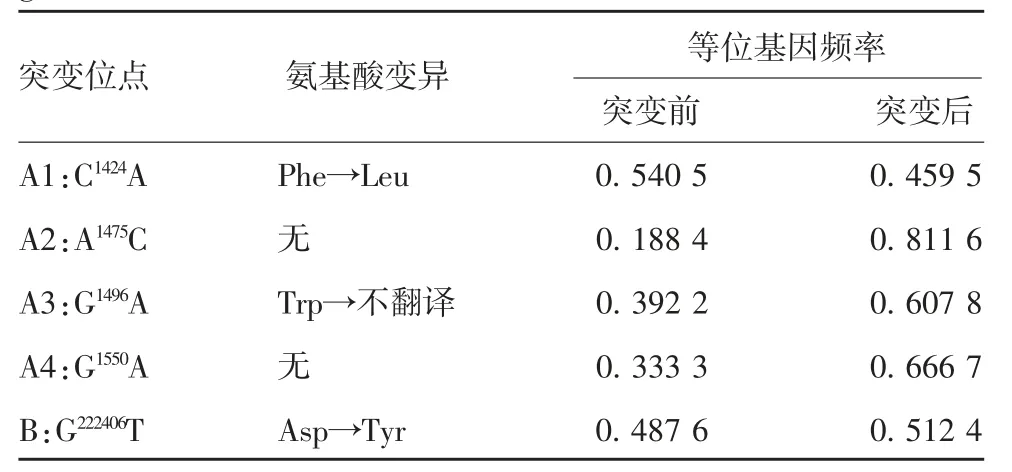
表1 中国荷坦奶牛TLR1和CBLB基因SNP位点及等位基因频率Tab.1 SNP loci and allele frequencies of TLR1 and CBLB genes of Chinese Holstein cows
2.4TLR1和CBLB基因mRNA二级结构预测 在线程序(RNA fold web server服务器)预测结果显示,TLR1基因参考序列mRNA二级结构最小自由能为-502.80 kcal/mol,而4个SNP位点C1424A、A1475C、G1496A和G1550A的mRNA二级结构最小自由能分别为-500.30、-504.90、-498.10和-498.50 kcal/mol。其中C1424A、G1496A和G1550A的最小自由能均有所增加,而A1475C的最小自由能有所降低;CBLB基因参考序列mRNA二级结构最小自由能为-201.40 kcal/mol,突变后G222406T位点最小自由能为201.20 kcal/mol,最小自由能有所下降。见图3。因此,mRNA的二级结构稳定性可能发生改变,从而可能对蛋白质的翻译发生影响。
2.5TLR1和CBLB基因编码蛋白质的理化性质分析 预测TLR1和CBLB基因编码蛋白均属于不稳定蛋白,见表2。因为氨基酸频率决定翻译速度,而TLR1基因编码蛋白质由727个氨基酸组成,其中Leu频率最高,为14.2%,Trp频率最低,为1.4%,这两种氨基酸频率差值为12.8%,见表3。CBLB基因编码蛋白质由983个氨基酸组成,其中脯氨酸(Pro)频率最高,为12.6%,Trp频率最低,为0.8%,这两种氨基酸频率差值为11.8%,见表4。
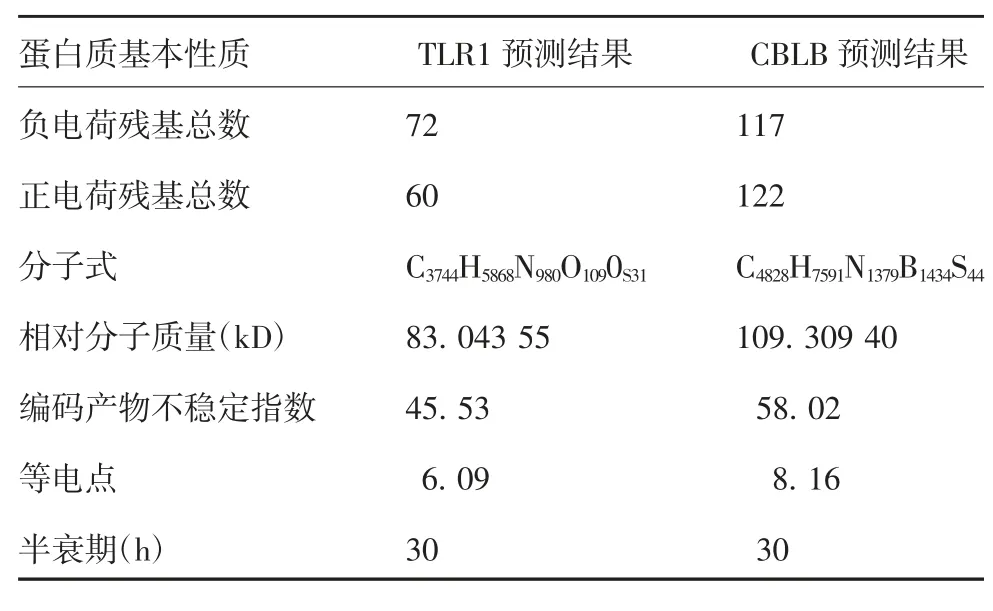
表2 中国荷斯坦奶牛TLR1和CBLB蛋白质理化特性Tab.2 Physicochemical properties of TLR1 and CBLB proteins of Chinese Holstein cows

图3 中国荷斯坦奶牛TLR1和CBLB基因mRNA二级结构突变前后对比Fig.3 Secondary structures of mRNA of TLR1 and CBLB genes of Chinese Holstein cows before and after mutation
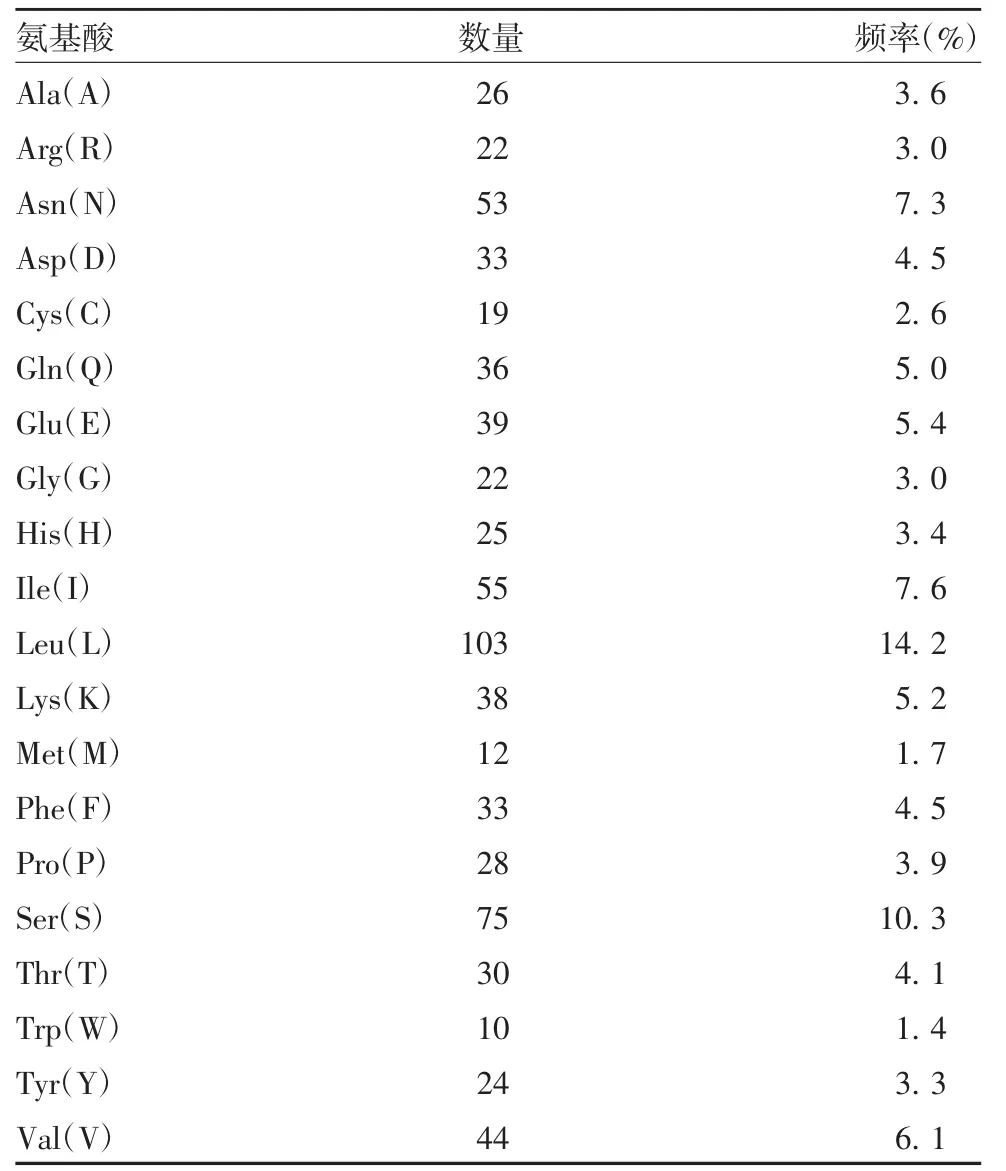
表3 中国荷斯坦奶牛TLR1蛋白质氨基酸的组成Tab.3 Amino acid composition of TLR1 protein of Chinese Holstein cows

表4 中国荷斯坦奶牛CBLB蛋白质氨基酸的组成Tab.4 Amino acid composition of CBLB protein of Chinese Holstein cows
2.6TLR1和CBLB基因编码蛋白质的疏水性及亲水性预测和分析 预测TLR1和CBLB蛋白质均属于非可溶性蛋白。TLR1蛋白第523位的Val疏水性最强(+3.367),第700位Glu疏水性最弱(-2.800),亲水性氨基酸占整条氨基酸肽链的47.04%,疏水性氨基酸占整条氨基酸肽链的52.96%,总体表现为疏水,见图4A;CBLB蛋白第26位的Ile疏水性最强(+1.800),第138位Gln疏水性最弱(-3.422),亲水性氨基酸占整条氨基酸肽链的26.75%,疏水性氨基酸占整条氨基酸肽链的73.25%,总体表现为疏水,见图4B。

图4中国荷斯坦奶牛TLR1和CBLB蛋白质疏水性(A)及亲水性(B)预测分析Fig.4 Prediction of hyrophobicity(A)and hydrophilicity(B)of TLR1 and CBLB proteins of Chinese Holstein cows
2.7TLR1和CBLB基因编码蛋白质的N-糖基化位点分析TLR1编码蛋白质中有6个潜在的N-糖基化位点,分别为Asn76、Asn187、Asn293、Asn306、Asn368和Asn443,见图5A;CBLB编码蛋白质中有4个潜在的N-糖基化位点,分别为Asn142、Asn602、Asn744和Asn797,见图5B。
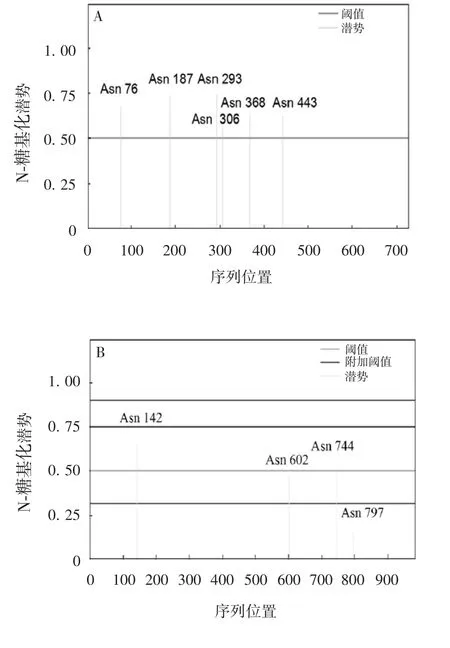
图5 中国荷斯坦奶牛TLR1(A)和CBLB(B)蛋白质N-糖基化位点预测分析Fig.5 Prediction of N-glycosylation sites of TLR1(A)and CBLB(B)proteins of Chinese Holstein cows
2.8TLR1和CBLB基因编码蛋白质的二级结构预测TLR1基因CDS区的C1424A和G1496A位点为错义突变,见表1。预测发现,突变前后蛋白质的二级结构发生轻微改变,突变前的蛋白质二级结构中,α-螺旋(h)占29.76%,β-折叠(e)占18.28%,无规则卷曲(c)占51.96%;突变后的蛋白质二级结构中,α-螺旋(h)占29.80%,β-折叠(e)占17.25%,无规则卷曲(c)占52.95%。突变后,a-螺旋和无规则卷曲比例分别增加了0.04%和0.99%,而β-折叠比例减少了1.03%。见图6A和图6B。
CBLB基因18外显子的G222406T位点为错义突变,见表1。预测发现,突变前后蛋白质的二级结构发生轻微改变,突变前的蛋白质二级结构中,α-螺旋(h)占28.30%,β-折叠(e)占15.09%,无规则卷曲(c)占56.60%;突变后,无规则卷曲(c)占56.45%,无规则卷曲降低了0.15%。见图6C。
2.9TLR1和CBLB基因编码蛋白质的三级结构预测TLR1和CBLB蛋白质突变前后有明显变化,与蛋白质二级结构的结果相一致,见图7。

图6中国荷斯坦奶牛TLR1和CBLB蛋白质二级结构突变前后对比Fig.6 Secondary structures of TLR1 and CBLB proteins of Chinese Holstein cows before and after mutation
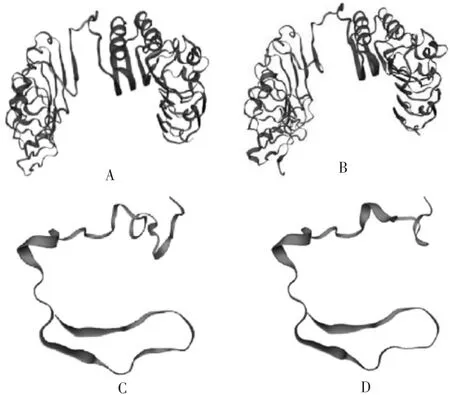
图7 中国荷斯坦奶牛TLR1和CBLB蛋白质三级结构突变前后对比Fig.7 Tertiary structures of TLR1 and CBLB proteins of Chinese Holstein cows before and after mutation
3 讨论
近年来,对Toll样受体家族的基因多态性的研究成果日益增多。有研究表明,Toll样样受体在激活免疫中发挥重要作用[10]。TLR1基因在动物中的研究已经被大量报道。其中VAHANA等[11]发现,TLR1基因在水牛肝脏、肺脏、脾脏、心脏中表达量较高,而在肾脏、卵巢中的表达量较低或者不表达。但陈亚冰等[12]研究发现,TLR1基因在牦牛肾脏和卵巢中的表达量也较高,并且提出了这一现象可能与TLR1基因在牦牛中的局部免疫有关。RUAN等[13]在2个杂交系及7个纯系品种(品系)鸡的TLR1-1、TLR1-2基因发现14个SNP位点,TLR1-2基因发现13个SNP位点,说明不同品种之间存在抗病性差异。RUSSELL等[14]发现,该基因5′端-79 T>G和3′端UTR区+2 463 C>T能够显著影响奶牛临床型乳房炎的发生。王梦琦等[15]研究发现,TLR1基因的突变影响中国荷斯坦奶牛的日产奶量和体细胞评分,并且发现TLR1-245 G>T突变与中国荷斯坦奶牛临床型乳房炎的发生显著相关。
目前对CBLB基因的研究多集中在人类疾病中,LOESER等[16]研究表明,CBLB在感染过程中会对T细胞反应产生负调节作用,其缺失会增强CD8+T细胞介导的肿瘤免疫。OU等[17]研究表明,CBLB在控制慢性病毒感染和肿瘤中显示出优势。NANJAPPA等[18]研究表明,CBLB可作为灭活酵母疫苗接种后增强抗真菌CD8+T细胞反应的潜在靶标,从而增强对致命性真菌性肺炎的抵抗力。CBLB缺乏小鼠容易发展自身免疫,绝大部分的研究表明,这类小鼠对多发性硬化(MS)的动物模型—实验性自身免疫性脑脊髓炎(experimental autoimmuune encephalomyelitis,EAE)有很高的易感性[19-20]。PEER等[21]研究表明,CBLB通过阻止单糖体蛋白(granulocyte-macrophage colony stimulating factor,GM-CSF)在T细胞中过度产生的致病作用来限制自身免疫。XIAO等[22]研究表明,CBLB是全身性念珠菌病的潜在药物靶标。
关于CBLB基因的SNP位点的报道相对较少,DONIZ-PADILLA[23]等在系统性红斑狼疮患者发现了CBLB2126(A/G)SNP,并且证明该位点与系统性红斑狼疮存在显著性相关。通过DAVID在线软件可以确定CBLB基因参与牛的炎症反应过程。本研究采用DNA混池对中国荷斯坦奶牛CBLB基因18外显子进行PCR扩增的方法,成功检测到了1个SNP位点(G222406T),并且该突变位点为错义突变,氨基酸的改变会导致蛋白质功能发生改变。
蛋白质是基因运行生物学功能的重要分子,其一级、二级、三级及更高级结构相互影响,从而发挥特定生理功能。本研究通过对300头中国荷斯坦奶牛TLR1基因SNP位点的鉴定及mRNA二级结构预测发现,该基因中C1424A、G1496A、G1550A和A1475C 4个SNP位点的产生,导致其最小自由能改变,最终可能会导致mRNA蛋白质的稳定性降低。本研究中因为C1424A和G1496A的错义突变,导致α-螺旋从29.76%增加至29.80%,β-折叠从18.28%降低至17.25%,无规则卷曲从51.96%增加至52.95%。CBLB基因G222406T SNP位点的产生,导致其最小自由能均有所降低,最终可能会导致mRNA蛋白质的稳定性降低,本研究中因为该位点属于错义突变,导致无规则卷曲从56.60%降低至56.45%,由于中国荷斯坦奶牛TLR1和CBLB蛋白质二级结构中无规则卷曲占主要地位,当蛋白质二级结构发生改变时,TLR1和CBLB蛋白质三级结构同样会发生改变从而影响蛋白质的稳定性及其功能。蛋白质的糖基化修饰是真核生物的一种最普遍的翻译后修饰方式,多存在于细胞外环境的蛋白质中,据统计,体内50%~70%的蛋白质可发生糖基化修饰,越来越多的数据表明,糖基化作为一种主要的翻译后修饰对蛋白质功能具有重要影响[24-25]。N-糖基化位点存在的越多,发生异常的可能性越大,对机体的相关免疫应答有关。
综上所述,本研究通过对中国荷斯坦奶牛TLR1基因CDS区和CBLB基因18外显子的SNP位点鉴定和蛋白质结构的预测发现,TLR1基因4个SNP位点中2个错义突变和CBLB基因SNP位点的错义突变可能会导致蛋白质的结构发生改变,从而影响其功能的改变。300头中国荷斯坦奶牛TLR1和CBLB基因5个SNP位点的发生,可能影响奶牛炎症疾病的发生发展,为中国荷斯坦奶牛炎症相关免疫调节疾病的研究奠定了基础,该5个SNP位点可作为中国荷斯坦奶牛抗病育种的候选遗传标记。
