核苷磷酸化酶酶活力检测方法的建立
2021-05-19唐艳吴涛王成孟月
唐艳,吴涛,2*,王成,孟月
(1.通辽梅花生物科技有限公司,内蒙古 通辽 028024;2.廊坊梅花生物技术开发有限公司, 河北 廊坊 065001)
肌苷(inosine),又名次黄苷、次黄嘌呤核苷,是由次黄嘌呤与核糖结合而成的核苷类物质。生产方法有两种;一种是以枯草芽孢杆菌发酵法制备[1],另一种是以腺嘌呤及硫胺素双重营养缺陷型的变异芽孢杆菌株,发酵制备得到肌苷[2-3]。肌苷能参与体内物质代谢和能量代谢,具有良好的药用功效[4-5],可治疗视网膜炎、视神经萎缩、抑郁症[6]、糖尿病[7],可保肝、护肝,也可抢救肝昏迷[8]。肌苷酸由化学合成、酶法合成[9]、发酵法制得[10],具有独特的增鲜风味[11-13],能有效地增强口感和食欲。
核苷磷酸化酶在最适宜的条件下[14-15]具有与肌苷、鸟苷共同作用的能力,生成肌苷酸二钠、鸟苷酸二钠、呈味核苷酸二钠,通过高效液相色谱方法测定其含量[16-17]。核苷酸常用作食品添加剂和医药中间体,其中,嘌呤核苷[18]如肌苷和鸟苷,可通过发酵及核苷的磷酸化法大规模地生产核苷酸。目前,主要有两种磷酸化方法[19-20];一种是化学磷酸化法,使用磷酸酰氯(POCl3);另一种是酶磷酸化法,使用大肠杆菌的肌苷激酶。化学磷酸化的过程相对复杂,需要两个反应器,用于发酵和化学反应;酶的磷酸化过程比较简单,在同一个反应器中进行发酵。酶的磷酸化法替代化学磷酸化法生产核苷酸是目前的趋势,污染小,成本低,可营造健康的生产作业环境。因此,核苷磷酸化酶产品质量的判定十分重要,是生产工序的判定依据,酶活力检测具有十分重要的意义,本文详细地介绍了酶活力检测的方法。
1 材料与方法
1.1 材料与仪器
1.1.1 药材
肌苷、鸟苷、磷酸、三聚磷酸钠、肌苷酸二钠标准品(Sigma 优级纯)、鸟苷酸二钠标准品(Sigma优级纯)、磷酸、乙腈(色谱纯)、磷酸二氢钾(分析纯)。
1.1.2 器材
1200高效液相色谱仪 Agilent Technologies公司;电子天平(精度±0.00001 g)、pH计 梅特勒-托利多公司;Milli-Q超纯水机、水浴锅等。
1.2 实验方法
1.2.1 酶解水浴反应
1.2.1.1 底物配制
称取5 g肌苷(鸟苷)、5 g三聚磷酸钠,完全溶解,用水定容至500 mL,配成10 g/L溶液,并用磷酸调pH至 4.50,作为底物。
1.2.1.2 体系预热
分别吸取10 mL底物于试管中,置于35 ℃水浴中,预热15 min。
1.2.1.3 酶液制备
将发酵液以10000 r/min离心5 min,去除清液与表面杂质,将菌体配成100 g/L 酶液。
1.2.1.4 水浴操作
向试管中分别移取一定体积酶液,与底物充分混匀,进行水浴反应,操作要迅速。
1.2.1.5 计算肌苷酸二钠(鸟苷酸二钠)生成量
每10 min取样,100 ℃灭活5 min,冷却后稀释25倍,进行液相检测,计算肌苷酸二钠(鸟苷酸二钠)的生成量。
1.2.2 液相检测
1.2.2.1 流动相配制
流动相A:0.02 mol/L磷酸二氢钾溶液(pH为4.5±0.01),称取2.7218 g磷酸二氢钾,置于1000 mL烧杯中,加入1000 mL超纯水,在磁力搅拌器上搅拌至磷酸二氢钾完全溶解,然后用磷酸调节pH 至4.5,过滤,待用。
流动相B:乙腈。
1.2.2.2 色谱条件
色谱柱:Polaris 5 C18-A (250 mm×4.6 mm),流动相A∶流动相B为99.5∶0.5(V/V),等度洗脱,柱温:40 ℃,流速:1 mL/min,紫外检测器(λ=254 nm),进样量:2 μL。
1.2.2.3 前处理
a.标品配制
配制一系列不同浓度的肌苷酸二钠、鸟苷酸二钠标准溶液:浓度分别为0.1,0.2,0.4,0.6,0.8,1.0 g/L。
b.样品处理
将灭活的反应液冷却至室温,稀释25倍,用0.22 μm滤膜过滤,上机检测IMP(GMP)含量。
1.2.2.4 测定
将处理好的待测样品及不同浓度的标准品上机测序列,进行色谱分离测定IMP(GMP)含量。
1.2.3 酶活计算
根据不同浓度的肌苷酸二钠标品及峰面积制作标准曲线方程,将样品的峰面积带入标准曲线中,计算(IMP)的含量(g/L),根据外标法测定IMP含量值,进而计算出磷酸化酶的活力。
酶活单位:用单位时间内单位体积中底物的减少量或产物的增加量来表示。在特定条件下,1 min内转化1 μmol底物(或产物增加)所需的酶量为一个活力单位(U)。
2 结果与分析
2.1 酶反应条件考察
分别以10 g/L肌苷和10 g/L鸟苷为底物,同时考察酶反应时间及加酶量。
2.1.1 磷酸化酶水解肌苷结果
以10 g/L肌苷为底物,酶添加量分别为0.5,1,2 mL,反应60 min,检测肌苷酸二钠含量,见表1。
由表1可知,底物浓度为10 g/L,0.5 mL反应最佳,在60 min时没有逆反应,此酶具有可逆反应,酶添加量为2 mL时,逆反应迅速,见图1。

图1 IMP含量趋势图Fig.1 The trendgram of IMP content
2.1.2 磷酸化酶水解鸟苷结果
底物10 g/L鸟苷替换肌苷,酶添加量为0.5,1,2 mL,反应30 min,测定鸟苷酸二钠(GMP)含量,见表2。
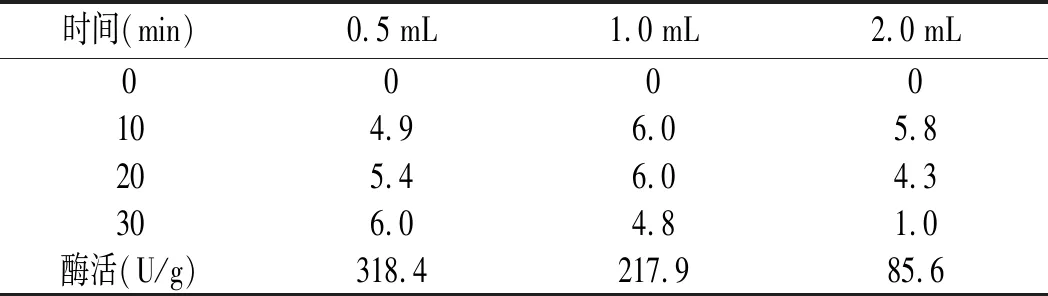
表2 酶活力结果-GMP含量(g/L)Table 2 The results of enzyme activity-GMP content (g/L)
由表2可知,底物浓度为10 g/L,0.5 mL酶液反应30 min结束,此酶与鸟苷底物反应时,1 mL酶液在20 min开始有逆反应,酶添加量为2 mL时,在10 min有逆反应且反应迅速,见图2。

图2 GMP含量趋势图Fig.2 The trendgram of GMP content
考虑底物浓度的影响,鸟苷溶解度低,10 g/L底物不能完全溶解,在水解过程中容易产生底物浓度不均匀,影响检测结果,将底物浓度下降为5 g/L,酶添加量分别为0.5,1,2 mL,测定GMP含量,见表3。

表3 酶活力结果-GMP含量(g/L)Table 3 The results of enzyme activity-GMP content (g/L)
由表3可知,0.5 mL酶液反应30 min结束,此酶与鸟苷底物反应时,2 mL酶液10 min已经有逆反应且明显,见图3。

图3 GMP含量趋势图Fig.3 The trendgram of GMP content
通过以上实验,考虑鸟苷比肌苷溶解度差,检测结果存在不稳定性,逆反应剧烈。可判定选用肌苷为底物,酶解水浴反应比鸟苷效果好,溶解迅速,结果准确。水解条件:底物浓度为10 g/L肌苷,为保证无逆反应,确定酶添加量为0.5 mL,反应时间10 min。
2.2 菌体状态实验考察
发酵菌体用水溶解制成酶液后,发现有黏稠、细胞裂解现象,因此采用增大溶液离子浓度,控制细胞裂解,为不引入其他离子,用三聚磷酸钠溶液增大离子浓度。保持与底物浓度一致,不破坏反应体系,采用10 g/L的三聚磷酸钠溶液配制酶液。选取5组实验进行对比研究,测定酶活,见表4。

表4 菌体状态及酶活力结果Table 4 The results of bacterial status and enzyme activity
增大酶液中的离子浓度,避免了细胞裂解,酶液的状态很好,无黏稠现象,酶活明显增加,可有效地避免细胞裂解现象,使酶反应充分表达,有效地提升酶液质量,提高酶液活力。因此用10 g/L的三聚磷酸钠溶解菌体替代水溶解菌体方案,可解决菌体黏稠现象、细胞裂解问题。
2.3 液相条件考察
2.3.1 色谱柱选择
采用ZORBAX Eclipse XDB-C18色谱柱测定核苷酸含量,新色谱柱测定峰图正常,由于色谱柱不耐高水相,50针后柱子逐渐塌陷,出峰异常,见图4。

图4 ZORBAX Eclipse XDB-C18 色谱峰图Fig.4 The chromatogram of ZORBAX Eclipse XDB-C18注:鸟苷酸二钠、肌苷酸二钠、肌苷、鸟苷分不开。
更换色谱柱Polaris 5 C18-A(250 mm×4.6 mm),色谱柱耐高水相,已使用2000针左右,测定核苷酸峰图依然正常,峰形好,耐用,见图5。
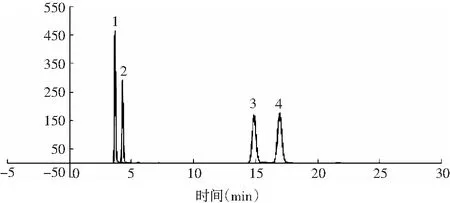
图5 Polaris 5 C18-A 色谱峰图Fig.5 The chromatogram of Polaris 5 C18-A注:1为鸟苷酸二钠,2为肌苷酸二钠,3为肌苷,4为鸟苷。
2.3.2 检测波长的选择
采用紫外分光光度计,在波长190~400 nm范围内,对肌苷、鸟苷、肌苷酸、鸟苷酸进行扫描,最终判定检测波长为254 nm。
2.3.3 稀释倍数的选择
将酶解液稀释10,25,50,100倍上机测定,由于标准曲线中间点为500 mg/L,酶解反应产物肌苷酸二钠稀释浓度在曲线中间点,最终判定稀释倍数为25倍,无论酶液质量如何,产物均在标准曲线范围内。
2.3.4 线性及检出限
将肌苷酸二钠标准品配成不同浓度0,0.1,0.2,0.4,0.6,0.8,1.0 g/L,采用此色谱条件进行色谱分离测定。结果表明:曲线为y=4237.5x-0.6885,相关线性R2=0.9999,可以看出此方法测定肌苷酸二钠具有较好的线性相关性,见图6,最小检出限为0.4 mg/L。

图6 标准曲线图Fig.6 The standard curve
2.3.5 精密度
取5组酶解液,每组连续进样10次,测定IMP含量。结果表明:RSD在0.5%以内,说明此方法测定IMP具有较高的精密度,具体结果见表5。

表5 精密度实验结果Table 5 The results of precision test
2.3.6 加标回收率及准确度
取5组酶解反应终止的稀释液各0.5 mL,分别向其中加入0.5 g/L的IMP标准溶液0.5 mL,混匀上机检测IMP含量,同时测定加标前样液的IMP含量及0.5 g/L的IMP标准品含量,并计算酶活。结果表明:加标回收率在99.6%~100%之间,0.5 g/L标准品测定结果为0.5001 g/L。结果显示:此方法具有较高的加标回收率及准确度,能准确地测定肌苷酸二钠含量,具体结果见表6。

表6 加标回收率及准确度实验结果Table 6 The results of recovery rates and accuracy test
3 结论
核苷磷酸化酶可与肌苷、鸟苷作用生成IMP、GMP,但反应后期出现逆反应,生成的产物能转化为底物肌苷、鸟苷。工艺控制时,酶的添加量及反应时间的控制非常重要,加酶量少,反应不彻底;加酶量大,产生逆反应,终点判定至关重要。通过上述实验得出最佳酶反应条件:温度35 ℃,pH 4.50,加酶量0.5 mL,反应时间10 min,底物浓度10 g/L,菌体浓度100 g/L(10 g/L三聚磷酸钠溶解菌体),最优液相色谱方法,采用Polaris 5 C18-A (250 mm×4.6 mm)色谱柱,以0.02 mol/L磷酸二氢钾∶乙腈为99.5∶0.5(V/V)为流动相,1 mL/min等度洗脱,紫外检测器(λ=254 nm),进样量2 μL。此方法测定结果准确,回收率>99.5%,重复性好,RSD<0.5%,是一种有效测定磷酸化酶活力的检测方法。核苷磷酸化酶酶活力检测方法的建立解决了酶磷酸化工艺制取鲜味剂终点判定问题,能准确地判定酶液产品质量,应用于生产,可创造更高价值。
