添加糖和乳酸菌对东北酸菜发酵效果的影响
2021-05-19何家乐吴幻刘梦绮李劲姜博文吴昊杨洪岩
何家乐,吴幻,刘梦绮,李劲,姜博文,吴昊,杨洪岩
(东北林业大学 生命科学学院,哈尔滨 150040)
酸菜是我国东北地区的传统发酵蔬菜,传统腌制方法是将新鲜白菜洗净后,浸入装有盐水的陶缸中,码至顶端后用腌菜石压实,经过30 d左右的自然发酵即可食用。随着生活节奏的加快,酸菜传统的小家小户制作已经逐渐向规模化、商业化过渡。目前的商业化酸菜生产仍然主要依靠自然发酵,普遍存在发酵周期长和质量不稳定等问题[1]。
微生物是引起蔬菜发酵体系一系列物理化学变化的主要因素[2],控制发酵体系的微生物才能从根本上控制发酵周期和发酵产品质量。在我们之前的研究中,已经对酸菜发酵体系中的微生物进行了系统解析,结果显示:在酸菜发酵体系中包含Acinetobactersp.,Pseudomonasfragi,Klebsiellasp.,Citrobactersp.,Betaproteobacteriasp.和乳酸菌等微生物种属,Leuconostocmesenteroides,Lactobacilluscurvatus,L.plantarum和L.oligofermentans是发酵中的主体微生物[3]。通过研究发现接种Lactobacillus在发酵体系内占据主导,显著加速发酵进程和提高发酵质量[4-5]。
碳水化合物是所有活生物体中细胞碳和能量的主要来源。乳酸菌是酸菜发酵中的主要微生物[6],可以利用各种可溶性碳水化合物作为底物生产有机酸。因此,添加碳水化合物有利于乳酸菌的生长。在制作酸菜时,当乳酸菌接种剂不易获得时,经验上会向发酵体系内添加糖,以营造利于酸菜本源乳酸菌生长的环境,从而加速发酵进程,然而加糖对发酵体系理化及微生物产生的影响尚不明确。在本研究中,为了明确在酸菜发酵过程中添加糖对发酵体系的影响,设置不添加对照、添加蔗糖处理和添加乳酸菌3个处理,通过对发酵体系理化及微生物学特征的研究明确加糖对发酵体系的影响,为酸菜的规模化生产提供了技术指导。
1 材料与方法
1.1 接种与发酵
白菜发酵参照参考文献[5]所描述的方法。简要描述如下:收获白菜,风干萎蔫2 d,修剪、清洗后层层码入250 L陶缸中,然后用腌菜石压实,盐与糖或菌剂随水加入陶缸中,盐的添加比例为总白菜重的1%(W/W),糖的添加比例为总白菜重的0.5%(W/W)。对于乳酸菌接种处理,根据课题组前期的研究成果,选用Lactobacilluscurvatus与Lactobacillusoligofermentans混合接种剂处理。两菌株在优势培养基上培养24 h(OD600=1.5)后,以5800×g离心3 min,除去上清液后,将细胞重悬于无菌蒸馏水中,并以3∶1的比例混合。接种率为1×106菌落形成单位(CFU)/g新鲜白菜。所有处理设3次重复,于18 ℃下发酵30 d,分别在发酵的第0,6,12,18,24,30天进行采样。
1.2 取样
在每个取样时间点,从陶缸表面下第3层取出白菜,用榨汁机匀浆后取汁液约0.5 mL用于微生物菌落计数;取30 mL于4 ℃下5800×g离心10 min后,将所得沉淀重悬于2 mL提取缓冲液(10 mmol/L Tris-HCl和40 mmol/L EDTA,pH 9.0)中。将每处理3个重复样品合于一管,冻存于-20 ℃用于DNA提取及后续高通量测序分析。离心所得上清液(0.7 mL)加入0.3 mL乙腈(高效液相色谱(HPLC)级,Dikma,加利福尼亚州莱克福里斯特,美国),涡旋后,静置10 min,随后10800×g离心10 min,用0.22 μm过滤器过滤,上清液保存在-20 ℃,用于HPLC分析。取白菜由外向内数第二层叶片,于105 ℃烘干粉碎过2 mm目筛,用于可溶性糖(WSC)的测定。
1.3 微生物计数与理化指标分析
乳酸菌和一般细菌菌落计数采用平板稀释法。乳酸菌在MRS[7]琼脂上30 ℃培养2 d,其他一般细菌在营养琼脂上在37 ℃培养2 d。使用pH计(B-212,Horiba,Kyoto,日本)进行pH测量。可溶性糖采用蒽酮比色法[8]。有机酸采用高效液相色谱(HPLC)法(Waters,Milford,MA,美国)。使用高亲和力阳离子交换柱(Aminex HPX-87H,300 mm×7.8 mm,Bio-Rad,Hercules,CA,美国)进行色谱分离。柱温为40 ℃,流速为0.6 mL/min,流动相中的H2SO4浓度为5 mmol/L,所有样品均运行30 min。使用R软件进行统计分析。显著性水平为p<0.05。
1.4 DNA提取和高通量测序
总DNA的提取采用试剂盒法(Omega,USA)。建库引物选择515F(5'-GTGCCAGCMGCCGCGG-3')和907R(5'-CCGTCAATTCMTTTRAGTTT-3')[9]。利用双末端测序(Paired-End)法构建小片段测序文库,质检合格后用MiSeq Illumina测序平台测序(美吉生物有限公司,上海,中国)。
1.5 数据处理及生物信息学分析
使用QIIME处理和分析高通量测序数据。基于QIIME中的Uchime算法[10],使用Usearch删除嵌合序列。按97%的序列相似性进行操作分类单元(OTU)划分。使用QIIME软件对样本的Alpha多样性指数(Ace,Chao 1,Shannon,Simpson和Coverage)进行分析。此外,使用R软件的Vegan包进行了主成分分析。原始序列数据NCBI数据库登录号为SRX1078336。
2 结果与分析
2.1 酸菜发酵过程中的pH动态
本研究设置3个处理,无添加对照、添加蔗糖处理和添加乳酸菌处理。3个处理的pH动态见图1。在发酵开始时,加糖和乳酸菌处理的pH值下降速度均快于对照(p<0.05)。从发酵的第6天起,加糖处理的pH低于对照的pH(p<0.05),并且在整个发酵期间均显著低于其他处理(p<0.05)。
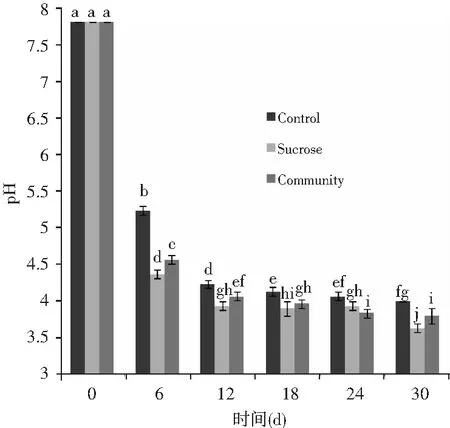
图1 酸菜发酵pH动态Fig.1 The pH values' dynamic changes of sauerkraut during fermentation注:Control表示无添加对照;Sucrose表示加糖处理;Community表示加乳酸菌处理;字母不同代表显著性不同(p<0.05)。
2.2 酸菜发酵过程中的有机酸动态
利用HPLC检测到的乳酸、乙酸和丙酸动态见图2。

图2 酸菜发酵过程中的有机酸动态Fig.2 The organic acids' dynamic changes of sauerkraut during fermentation注:Control表示无添加对照;Sucrose表示加糖处理;Community表示加乳酸菌处理;字母不同代表显著性不同(p<0.05)。A表示乳酸,B表示乙酸,C表示丙酸。
添加LAB处理乳酸水平最高。蔗糖添加处理中的乳酸水平高于对照,但低于乳酸菌接种处理(p<0.05)。在发酵的前12 d,对照中的乙酸水平最高,随后是加糖处理(p<0.05)。乳酸菌接种处理中的乙酸水平在整个发酵期间最低。在本研究中还检测到丙酸,随着发酵的进行,丙酸的浓度增加。在第30天时,所有处理丙酸的浓度大于1.0 g/L。
2.3 酸菜发酵过程中的微生物菌落动态
使用平板稀释法进行微生物菌落计数,见图3。在发酵的前12 d,乳酸菌增加明显(p<0.05),此后各处理之间的乳酸菌变化不再显著。在发酵的第6天,对照中的乳酸菌明显少于其他处理(p<0.05)。在所有处理中,经过18 d的发酵,一般细菌的数量均显著减少(p<0.05)。直至第24天,所有处理的一般细菌数量没有显著差异。

图3 酸菜发酵过程中的微生物菌落动态Fig.3 The microbial colonies' dynamic changes of sauerkraut during fermentation注:Control表示无添加对照;Sucrose表示加糖处理;Community表示加乳酸菌处理;字母不同代表显著性不同(p<0.05)。A表示乳酸菌,B表示一般细菌。
2.4 酸菜发酵过程中的可溶性糖动态
发酵体系对可溶性糖(WSC)的消耗见图4。在发酵的第6~30 d,可溶性糖的水平显著下降,最明显的变化发生在前18 d。添加乳酸菌处理的WSC下降最快(p<0.05)。在第30天时,WSC的浓度约为3.0 g/100 g干物质。
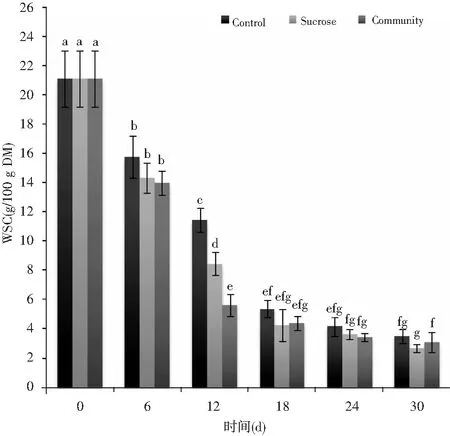
图4 酸菜发酵过程中的可溶性糖动态Fig.4 The soluble sugar's dynamic changes of sauerkraut during fermentation注:Control表示无添加对照;Sucrose表示加糖处理;Community表示加乳酸菌处理;字母不同代表显著性不同(p<0.05)。WSC表示可溶性糖,DM表示干物质。
2.5 门、属水平上的微生物群落组成
通过高通量测序分析,总共获得了247850个有效序列,每个样品的平均值为16523(标准差=4616)。物种丰富度Alpha多样性指数见表1。每种处理的生物分类组成见图5(A为门水平,B为属水平)。
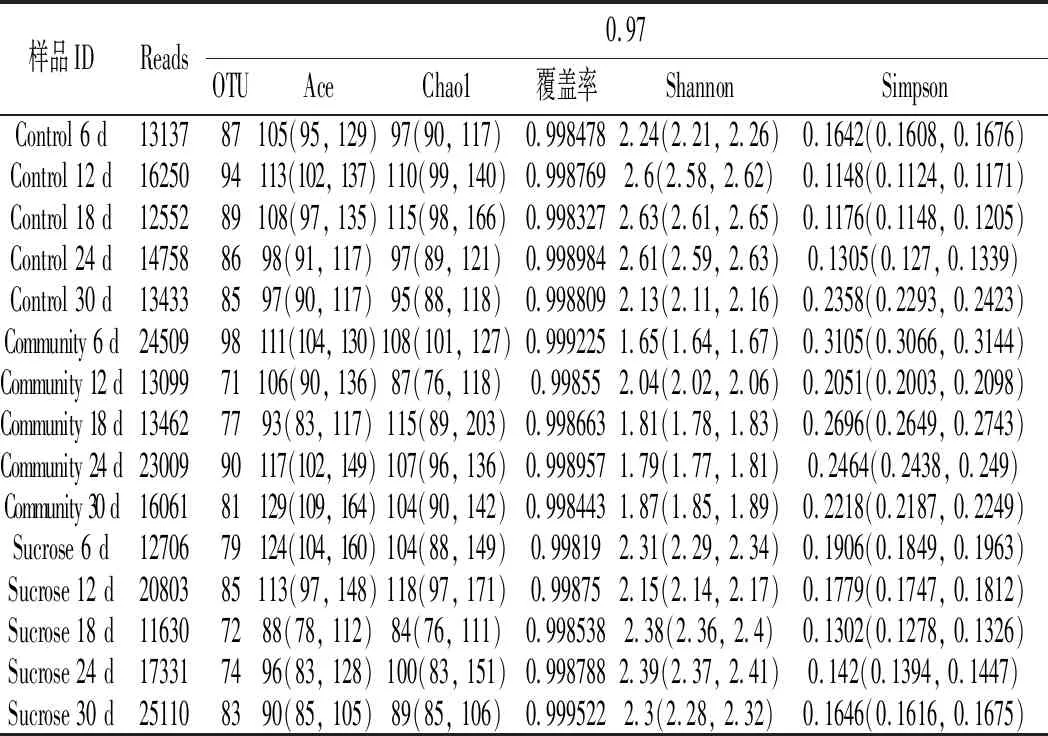
表1 酸菜样品OTU丰富度、样品覆盖度和多样性指数Table 1 The OTU richness, sample coverage rates and diversity indexes of sauerkraut samples
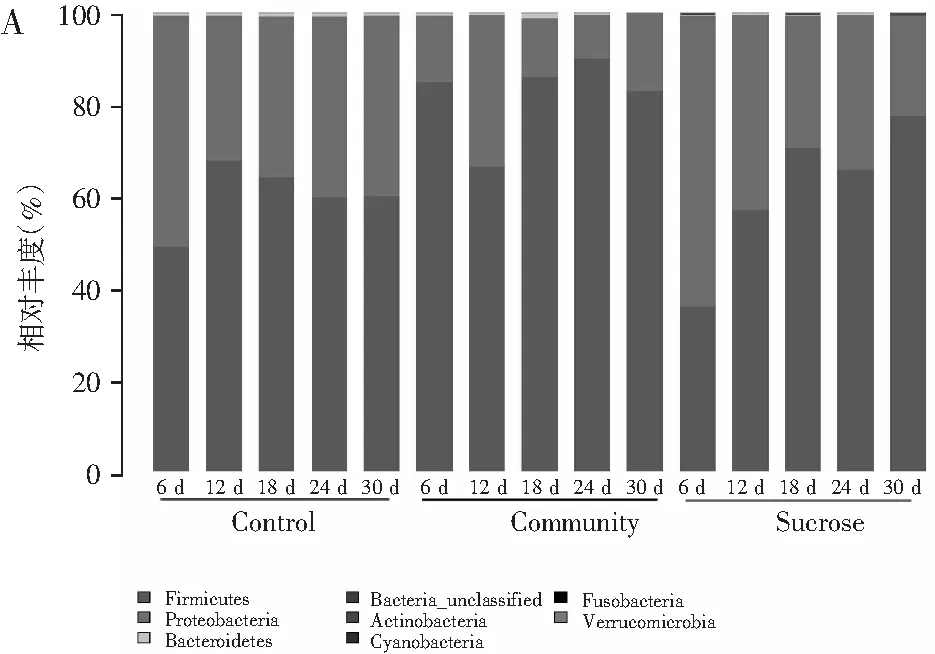
图5 细菌门水平、属水平的群落组成多样性Fig.5 The community composition diversity at phylum level and genus level注:未鉴定出的序列统一标记为No_Rank;Control表示无添加对照;Sucrose表示加糖处理;Community表示加乳酸菌处理。
由图5可知,在这3种处理中,检测到的门包括Firmicutes,Proteobacteria,Bacteroidetes,Actinobacteria,Cyanobacteria,Fusobacteria和Verrucomicrobia等。在所有处理中,Firmicutes和Proteobacteria占据优势。在乳酸菌接种处理中,厚壁菌门优势最为明显。
在属水平上,主要检测到Lactobacillus,Lactococcus,Enterobacter,Pseudomonas,Leuconostoc,Enterobacteriaceae_unclassified,Acinetobacter和Arcobacter。在对照中,Lactobacillus,Lactococcus,Pseudomonas,Leuconostoc和Enterobacteriaceae是主要菌属;在乳酸菌接种处理中,Lactobacillus占据绝对优势。在对照处理中,在发酵的第30天,Lactococcus的最高比例达到29.7%,在发酵的第18天,Lactobacillus的最高比例达到45.9%。在发酵的第12天,Leuconostoc的最高相对含量达4.6%。在乳酸菌接种处理中,在发酵的第12天,Lactobacillus的相对丰度达到66.4%,之后Lactobacillus的比例达到≥80%以上。
在糖添加处理中,Lactobacillus的相对丰度在发酵过程中不断增加。在发酵的第30天,Lactobacillus的相对丰度从第6天的13.8%增加到54.7%。在发酵的前18 d,Lactococcus的比例持续增加,最大值达到22.9%,在发酵第30天比例下降到9.9%。在加糖处理中,Enterobacter比例比其他处理高,在发酵第6天的相对丰度为39.3%,在发酵第30天其相对丰度为14.1%。加糖处理中Leuconostoc的比例也是所有处理中最高的,其最大值为12.7%。
通过PCA分析,比较了3个处理中15个样品的细菌群落结构,见图6。

图6 酸菜样品发酵过程中的细菌群落主成分分析Fig.6 The principal component analysis of bacterial colonies of sauerkraut samples during fermentation注:Control表示无添加对照;Sucrose表示加糖处理;Community表示加乳酸菌处理。
由图6可知,无添加处理和乳酸菌接种处理在PC1轴分开,说明接种微生物可以解释两处理菌落组成不同的54.08%;加糖处理与对照处理在PC2轴分开,说明加糖处理可以解释两处理微生物群落结构差异的21.39%;除第6天样品外,接种处理与加糖处理在PC2轴分开,表明接种和加糖处理对于发酵后期微生物结构的影响更为显著。
3 讨论
3.1 加糖酸菜发酵的理化动态解析
由于地域和季节不同,世界各地生产的发酵蔬菜的种类也存在很大差异,但发酵作为蔬菜的保藏方式由来已久[11]。与其他类型的发酵食品一样,发酵蔬菜内含有各种微生物,乳酸菌在整个发酵过程中起着主导作用。它们代谢原材料的化学成分,以改善风味和材料质地并帮助提高消化率。此外,乳酸菌还可以产生抑菌化合物从而显示益生特性[12]。我们以前的研究显示,在传统自然发酵过程中,pH值和可溶性糖含量的下降主要发生在发酵的前12 d,乳酸积累主要发生在前18 d,在第12天观察到乙酸浓度的增加。在本研究中,对照的发酵是自发的,其发酵的理化变化与先前的研究一致。然而,与对照相比,其他两种处理的理化变化更为剧烈。蔬菜发酵过程中发生的物理化学变化是由微生物变化引起的[13],所以不同处理理化变化不同的结果表明添加乳酸菌或蔗糖会显著影响微生物的代谢能力及水平。
3.2 基于高通量测序的微生物多样性分析
基于传统分离培养技术鉴定微生物多样性存在很多局限,从样品中直接提取核酸后进行高通量测序已经成为分析自然生态系统中微生物多样性的重要工具[14]。在本研究中,通过高通量测序分析了酸菜中细菌群落的多样性。在门的水平上,主要包括Firmicutes,Proteobacteria,Bacteroidetes,Actinobacteria,Cyanobacteria,Fusobacteria和Verrucomicrobia等(见图5)。通常在水果、蔬菜和发酵乳中检测到Firmicutes,Proteobacteria,Bacteroidetes和Actinobacteria等[15-16],而Cyanobacteria和Fusobacteria在海草、植物的根系中多有发现[17],Verrucomicrobia在瘤胃中更为常见[18-19],这些结果说明酸菜发酵体系中微生物群落多样性丰富。在属水平上,检测到了Lactobacillus,Lactococcus,Enterobacter,Pseudomonas,Leuconostoc,Enterobacteriaceae_unclassified,Acinetobacter和Arcobacter等,该结果与我们先前对自发酸菜发酵过程中细菌属的研究一致。在较低水平检测到的其他属包括Weissella,Aeromonas,Comamonas,Saccharibacillus,Shewanella,Kluyvera,Flavobacterium,Chryseobacterium,Janthinbacterium,Aquabacterium和Rhodococcus。
3.3 接种微生物和加糖对酸菜发酵微生物动态的影响
在蔬菜和水果的发酵过程中,控制乳酸发酵的方法主要有两种:使用本源或异源发酵剂。从水果和蔬菜附着的本源微生物中选择发酵菌种更值得推荐,因为本源菌在延长保质期、改善制品营养和感官特性方面更具有优势[20]。本研究中所用的乳酸菌接种剂来源于酸菜本身。接种后,可以迅速在发酵体系内定殖,使Lactobacillus成为最主要属。
每个植物物种都有特定优势和恒定的微生物群[21]。乳酸菌是蔬菜原材料上的本源菌群的一小部分(2.0~4.0 log CFU/g)[22]。已从不同类型的蔬菜中鉴定到Leuconostoc,Lactobacillus,Weissella,Enterococcus和Pediococcus等异型发酵和同型发酵种。当条件合适时,新鲜蔬菜可能会自发进行乳酸发酵。对于酸菜发酵,主要的微生物是乳酸菌。乳酸发酵的底物是WSC,葡萄糖、果糖和蔗糖是其中的典型代表[23]。在本研究中,我们将蔗糖添加到发酵系统中以观察其对微生物群落的影响。在添加蔗糖处理中,各种细菌属的相对丰度与对照相比显著不同。Lactobacillus的相对丰度在整个发酵过程中持续增加,在第30天约占细菌总数的54.7%。Lactococcus,Enterobacter,Leuconostoc特别是Enterobacter显著增加,肠杆菌属兼性厌氧菌,在发酵开始时即已启动。肠细菌种类的相对丰度在第6天最高(39.3%,见图5),但到第30天已开始下降(相对丰度为14.1%)。已有研究表明,未加工的蔬菜中可能存在凝固酶阳性葡萄球菌和其他肠细菌,其细胞密度低,由于面临微生物竞争而使生长受到抑制,在某些特殊情况下可能致病[24]。因此综合本研究结果,加糖与添加乳酸菌两种处理比较,接种乳酸菌可以更好地控制酸菜发酵,获得相对更安全的酸菜产品。
4 结论
在本研究中,为了明确加糖对酸菜发酵效果的影响,将乳酸菌或蔗糖添加到发酵体系中,分析发酵体系的理化及微生物动态。从理化指标来看,添加乳酸菌或蔗糖可以更快地降低发酵系统的pH。接种乳酸菌处理乳酸的浓度更高。微生物分析表明,乳酸菌接种剂可以在发酵系统中栖息并占主导地位。蔗糖的添加一定程度上支持肠杆菌的生长,加糖与加乳酸菌比较,接种乳酸菌更有利。本研究结果为东北酸菜生产的规模化、规范化提供了技术参考。
