西达本胺联合干扰素α对人皮肤T细胞淋巴瘤细胞系Hut78的协同作用及其分子机制的研究
2021-05-19谷晓广刘永生续言凤李孟曙
谷晓广,刘永生,续言凤,李孟曙
蕈样肉芽肿和Sézary 综合征属于皮肤T 细胞淋巴瘤,其中蕈样肉芽肿是皮肤T 细胞淋巴瘤中最常见的类型[1]。目前的研究显示,蕈样肉芽肿和Sézary综合征的发病机制中肿瘤细胞的不断扩增主要依赖于对凋亡的抵抗而不是过度的增殖[2]。因此,临床上进展期的蕈样肉芽肿患者对主要通过抑制细胞增殖的常规化疗的治疗方法是高度抵抗的。目前针对蕈样肉芽肿特别是进展为肿瘤期的患者和恶性程度更高的Sézary 综合征患者治疗方法非常有限,系统性化疗的缓解率不高。寻求一种高效的药物和药物组合是目前治疗蕈样肉芽肿和Sézary 综合征的关键。西达本胺是具有全新化学结构的选择性组蛋白去乙酰化酶抑制剂(HDAC-I),其对组蛋白的抑制具有特殊性,只针对第Ⅰ大类组蛋白去乙酰化酶(HDAC)的亚型-HDAC2 和HDAC3,而上述两种亚型与肿瘤的发生和肿瘤的进展是高度相关的[3]。干扰素(IFN)-α目前是蕈样肉芽肿治疗的一线治疗药物,特别是针对斑片和斑块期等早期蕈样肉芽肿具有非常高效的控制肿瘤进展的作用。即使蕈样肉芽肿进展至肿瘤期以及恶性程度更高的Sézary 综合征患者,应用IFN-α也是有效的[4]。本研究通过观察西达本胺和IFN-α 单独和联合应用对蕈样肉芽肿和Sézary 综合征相关人皮肤T 细胞淋巴瘤细胞系Hut78 增殖抑制和凋亡的影响,检测Hut78 细胞凋亡相关基因的表达,探究西达本胺联合IFN-α 治疗蕈样肉芽肿和Sézary 综合征的可能分子机制。
1 材料和方法
1.1 材料
Hut78 细 胞 系(ATCC 号:TIB-161),RPMI1640培养基(美国GIBCO 公司),胎牛血清(美国GIBCO公司),MTS(美国Promega 公司),FITC-AnnexinV凋亡检测试剂盒(美国BD 公司),cDNA 合成试剂盒(加拿大Fermentas 公司),荧光定量试剂盒power SYBR®Green PCR Master Mix(美 国Applied Biosystems 公司),IFN-α(北京凯因生物技术有限公司),西达本胺(深圳微芯生物科技有限公司,货号:H20140129)。
1.2 方法
1.2.1 细胞培养 Hut78细胞在37℃, 5% CO2孵育箱中培养传代,培养基为RPMI1640,其中含有10%的胎牛血清和1%的青链霉素。
1.2.2 采用细胞增殖检测法(MTS 法)测定细胞增殖取对数生长期细胞(浓度2×104/ml)培养在每孔含1 ml 培养基6 孔板中。西达本胺设4 个浓度组:0.3、0.6、1.2、2.4 µmol/L,IFN-α 设4 个浓度组:3 000、5 000、10 000、20 000 U/ml,再设一个联合组:1.2 µmol/L西达本胺联合10 000 U/ml IFN-α,加入等量培养基作为空白对照组作用于Hut78 细胞24、48、72 h。在各个时间点混匀细胞,然后取100 µl 细胞混悬液加至96 孔板中,并且每个浓度做3 个副孔,每孔中加20 µl 预先配置好的MTS 溶液,37℃孵箱中孵育2 h,96 孔板在分光光度仪中测定490 nm 处的吸光度。以上实验重复3 次,取平均数。
1.2.3 细胞体外克隆形成能力检测 使用甲基纤维素培养基(MethoCult CFC,StemCell Technologies)对Hut78细胞的体外克隆形成能力进行分析,CFC可以使单个细胞克隆原位进行增殖,进而形成单细胞克隆细胞群落。分别设3个浓度组:1.2 µmol/L西达本胺组、10 000 U/ml IFN-α组以及联合组,加入等量培养基作为空白对照组先分别处理Hut78细胞24 h,每个浓度组平皿细胞在显微镜下计数103个细胞。将细胞加入CFC中并振荡,然后应用带钝端针头的注射器将混合好的细胞接种到培养皿中,上述培养皿放置在37℃, 5% CO2点孵育箱中培养14 d,再使用倒置显微镜和计数皿计数和评估集落类型。上述实验重复3次取平均值。
1.2.4 流式细胞仪检查细胞凋亡 在对数生长期内,计数Hut78 细胞(2 ×104/ml)接种于6 孔板中,每孔1 ml。实验组分别每孔加入1.2 µmol/L 西达本胺,10 000 U/ml IFN-α,1.2 µmol/L 西达本胺联合10 000 U/ml IFN-α,每孔10 µl,加入等量培养基作为空白对照组培养24 h。不同浓度组计数5×105个细胞,使用冷的PBS 缓冲液冲洗细胞2 次,将Hut78细胞重新以1×106/ml 的浓度悬浮在结合缓冲液中。将100 µl 细胞悬液转移到5 ml 试管中,每管中加入5 µl 的FITC 偶联AnnexinV 和5 µl PI。轻轻混匀细胞,避光孵育15 min。每管中加入结合缓冲液400 µl,在1 h 内用流式细胞仪上机进行检测。应用FlowJo8.0软件进行数据分析,统计FITC 阳性细胞的百分率。上述需重复3 次,取其平均值。

表1 凋亡相关基因Fas、FasL、Caspase3、Caspase8、内参GAPDH的引物序列
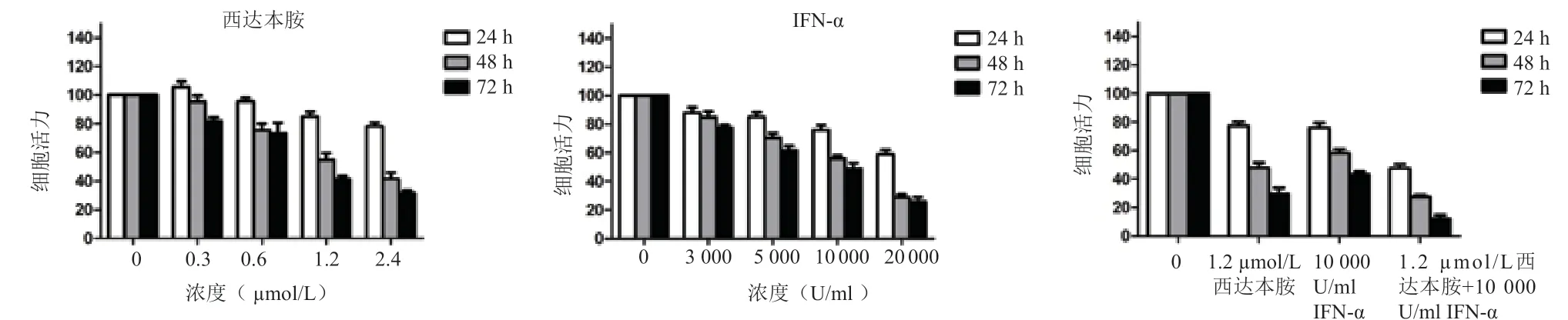
图1 西达本胺和IFN-α单独以及联合对Hut78细胞体外增殖的影响
1.2.5 实时荧光定量聚合酶链反应(real-time PCR)检测细胞凋亡相关基因mRNA 的表达 1.2 µmol/L西达本胺组,10 000 U/ml IFN-α 组,1.2 µmol/L 西达本胺联合10 000 U/ml IFN-α 组及加入等量培养基作为空白对照组培养24 h 后,分别计数各组Hut78细胞5×105个,高速离心后弃去上清,然后加入Trizol®Reagent 提取细胞RNA,并逆转录为cDNA。再以cDNA 为模板,加入选取的目的基因引物,各引物序列见表1。使用power SYBR®Green PCR Master Mix 试剂盒,运用实时荧光定量PRC 检测仪进行实时荧光定量PCR,与此同时扩增内参GAPDH基因作为定量PCR 的对照。各目的基因mRNA 的表达值=(目的基因Ct 值-内参基因Ct 值)/内参基因Ct 值×104,每个样本分别重复3 管,最终结果取平均值,上述实验结果需重复3 次。
1.3 统计学方法
采用SPSS17.0 软件,计量资料以(±s)表示,组间差异采用单因素方差分析(one-way ANOVA),各组间均数比较采用LSD-t检验进行两两比较,P<0.05 为差异有统计学意义。
2 结果
2.1 西达本胺和IFN-α单独以及联合对Hut78细胞体外增殖的影响
由图1 可见,与空白对照组相比,西达本胺0.3、0.6、1.2、2.4 µmol/L 各浓度组,细胞的增殖速度均出现显著降低。在3 个时间段24 h,48 h 及72 h 差 异均有统计学意 义(F24h=56.45,F48h=121.74,F72h=301.11,P均<0.05)。与空白对照组相比,IFN-α 3 000、5 000、10 000 、20 000 U/ml 各浓度组细胞的增殖速度均表现为显著降低。在3 个时间段24 h,48 h 及72 h 差异均有统计学意义(F24h=21.43,F48h=53.38,F72h=182.71,P均<0.05)。与空白对照组相比1.2 µmol/L 西达本胺、10 000 U/ml IFN-α、1.2µmol/L 西达本胺联合10 000 U/ml IFN-α 处理组细胞的增殖速度也均表现为显著降低。在3 个时间段24 h、48 h 及72 h 差异均有统计学意义(F24h=44.21,F48h=38.32,F72h=51.38,P均<0.05)。上述结果显示联合药物处理组对Hut78 细胞的增殖抑制作用均比单药处理组对Hut78 细胞的增殖抑制作用更显著。
2.2 西达本胺和IFN-α单独以及联合对Hut78细胞体外克隆形成能力的影响
通过CFC 检 测1.2 µmol/L西达本胺、10 000 U/ml IFN-α、1.2 µmol/L 西达本胺联合10 000 U/ml IFN-α 处理组对Hut78 细胞的体外克隆形成能力,先用1.2 µmol/L 西达本胺、10 000 U/ml IFN-α 以及联合组分别处理Hut78 细胞24 h,再行细胞计数103接种于CFC 上,14 d 后倒置显微镜计数形成的细胞群落。结果显示,与空白对照组相比,1.2 µmol/L 西达本胺、10 000 U/ml IFN-α、1.2 µmol/L 西达本胺联合10 000 U/ml IFN-α 处理组Hut78 的体外克隆形成能力明显降低,其中联合组对细胞的体外克隆形成能力抑制最明显,与单药1.2 µmol/L 西达本胺组、10 000 U/ml IFN-α 组相比差异均具有统计学意义(P<0.05)(图2)。
2.3 西达本胺和IFN-α单独以及联合对Hut78细胞凋亡的影响
1.2 µmol/L 西达本胺组、10 000 U/ml IFN-α 组、1.2 µmol/L 西达本胺联合10 000 U/ml IFN-α 处理组的Hut78 细胞凋亡比例均显著高于空白对照组,差异有统计学意义(P均<0.05)。药物联合组的细胞凋亡比例均高于1.2 µmol/L 西达本胺、10 000 U/ml IFN-α等单药组,差异有统计学意义(P均<0.05)(图3)。

图2 西达本胺和IFN-α单独以及联合对Hut78细胞体外克隆形成能力的影响
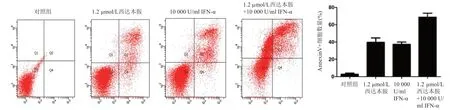
图3 西达本胺和IFN-α单独以及联合对Hut78细胞凋亡的影响
2.4 西达本胺和IFN-α单独以及联合对Hut78细胞凋亡相关基因的影响
采用1.2 µmol/L 西达本胺、10 000 U/ml IFN-α、1.2µmol/L 西达本胺联合10 000 U/ml IFN-α 处理Hut78细胞24 h,实时荧光定量PCR 对凋亡相关基因Fas、FasL、Caspase3、Caspase8 的相对表 达 量 进行测量。结果显示,与空白对照组相比、1.2 µmol/L 西达本胺、10 000 U/ml IFN-α、联合组Fas、Caspase8、Caspase3 基因相对表达量差异均有统计学意义(P均<0.05),联合组Fas、Caspase3、Caspase8 基因相对表达量均高于1.2 µmol/L 西达本胺、10 000 U/ml IFN-α 单药组相对表达量,差异具有统计学意义(P均<0.001)。而FasL的相对表达量无明显变化,各治疗组与对照组相比差异无统计学意义(P=0.842)(图4)。
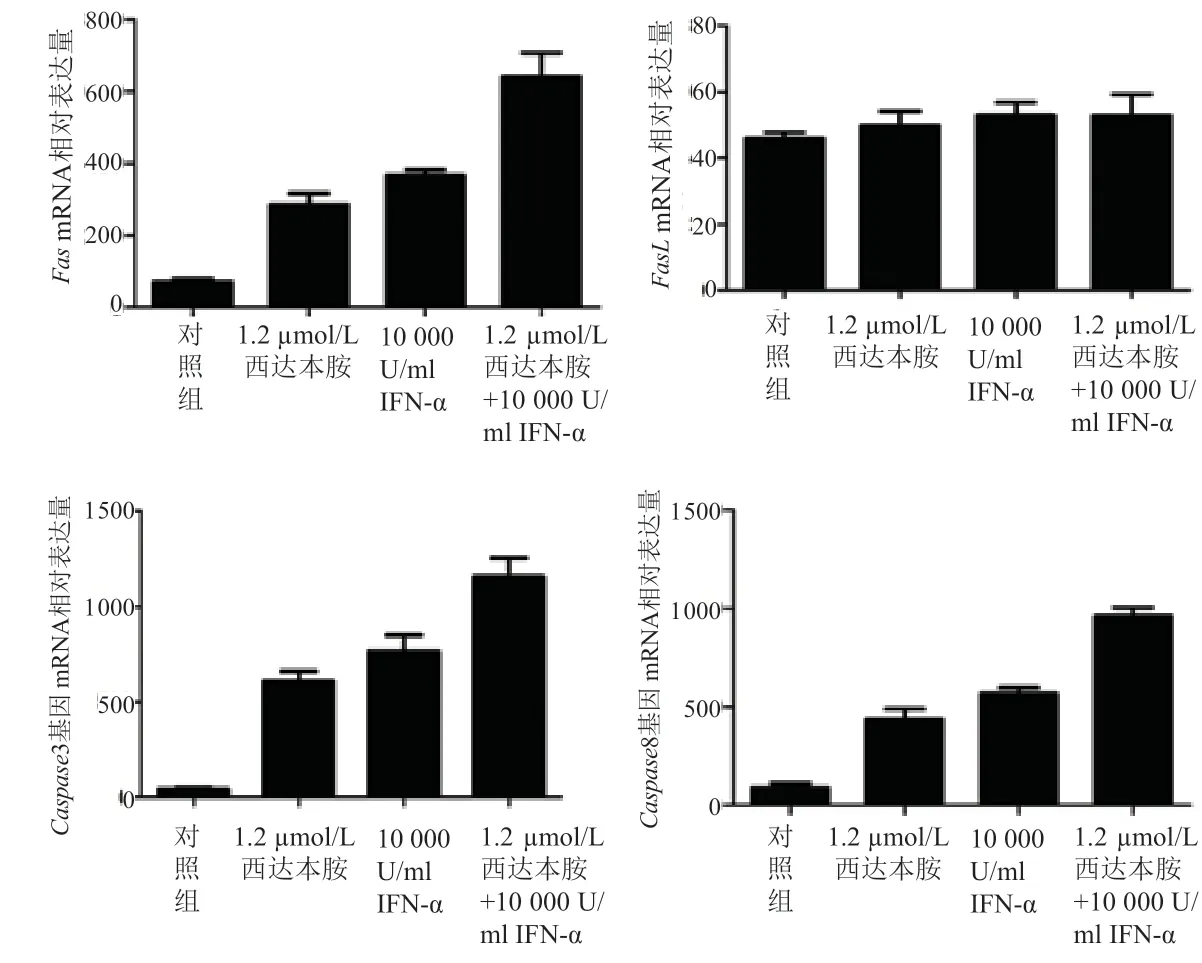
图4 西达本胺和IFN-α单独以及联合对Hut78细胞凋亡相关基因表达的影响
3 讨论
目前表观遗传学调控药物去乙酰化酶抑制剂(HDAC-I)已经成功应用于皮肤T 细胞淋巴瘤,特别是蕈样肉芽肿和Sézary 综合征的临床治疗[5]。研究显示HDAC-I 可以通过多种机制抑制肿瘤的发生和发展,对血管生成相关基因表达的下调和抗血管生成基因的表达的激活,进而负向调节肿瘤血管的生成而实现[6]。第二种机制系通过诱导细胞周期停滞进一步促进细胞凋亡,而这种生物学作用的核心是通过上调染色质中组蛋白的乙酰化水平活化基因表达而实现的[7]。目前美国食品药品监督管理局(FDA)已经批准非选择性针对HDAC 表观遗传的小分子药物——一种去乙酰化酶抑制剂伏立诺他(vorinostat)应用于皮肤T 细胞淋巴瘤的治疗。临床研究表明,口服伏立诺他对其他常规抗肿瘤药物治疗失败的皮肤T 细胞淋巴瘤患者依然有效[8]。西达本胺是我国本土研究机构自主研发的高选择性HDAC 抑制剂,其特异性地针对HDAC 的某些亚型,这也是该药物相对于同类药物伏立诺他的一大优势,其主要抑制HDAC2 和HDAC3,而HDAC2 和HDAC3 是与肿瘤发生和发展高度相关的第Ⅰ大类HDAC 亚型。临床试验显示该药物对皮肤T 细胞淋巴瘤的抗肿瘤活性非常高,且其临床不良反应轻微[3]。有学者运用西达本胺对非霍奇金淋巴瘤患者进行了Ⅰ期临床研究,结果显示大部分患者的部分缓解率达到90%[9]。本研究也显示不同浓度西达本胺作用Hut78 细胞后,其能明显抑制Hut78 细胞的增殖,并呈时间和浓度依赖性,西达本胺在诱导细胞凋亡的同时可引起凋亡相关基因Fas、Caspase3、Caspase8表达的升高,推测西达本胺可能通过上调Hut78 细胞表面的Fas表达触发了细胞的FasL-Fas 细胞凋亡信号通路。
重组人IFN-α 很早就应用于对皮肤T 细胞淋巴瘤的治疗[10]。目前在临床上IFN-α 已经成为治疗蕈样肉芽肿和Sézary 综合征的一线药物,对斑片、斑块、肿瘤期蕈样肉芽肿以及恶性程度很高的Sézary 综合征患者均具有很好的治疗效果[11]。大量关于IFN-α治疗肿瘤作用机制方面的研究显示,IFN-α 可以通过抑制肿瘤细胞的增殖进而诱导其凋亡达到抗肿瘤的目的[12]。个别研究显示,IFN-α 和常规化疗药物联合应用能显著提高对血液系统恶性肿瘤的抗肿瘤活性[13]。但是目前其对于治疗皮肤T 细胞淋巴瘤的具体机制报道还比较少。本研究采用不同浓度组的IFN-α 处理Hut78 细胞,结果显示IFN-α 对Hut78 细胞的体外增殖具有明显的抑制作用,伴随着药物浓度的不断递增,这种抑制作用逐渐增强,这种抑制的趋势呈现为时间和剂量依赖性。
综上所述,与单用IFN-α 相比,西达本胺与IFN-α 联合应用对Hut78 细胞的增殖和克隆形成抑制、凋亡诱导作用更加明显,并对凋亡相关基因Fas、Caspase3、Caspase8 表达的升高作用均明显高于单用IFN-α,显示西达本胺联合IFN-α 能明显提高抑制皮肤T 细胞淋巴瘤细胞系Hut78 的生长率,初步揭示了西达本胺抑制皮肤T 细胞淋巴瘤细胞系Hut78生长的可能分子机制。
