转化生长因子-β受体在男性雄激素性脱发患者头皮毛囊中的表达意义
2021-05-19董佳辉万苗坚
董佳辉,万苗坚,计 斌
雄激素性脱发(androgenetic alopecia,AGA)是一种比较常见的脱发性疾病。目前已经认识到,AGA 是在遗传背景上由雄激素触发和介导的进行性脱发性疾病,其发病的时间、进程和严重程度又受其他因素的影响,如睡眠、情绪等[1]。AGA 发病的分子机制尚未完全阐明,且现有的治疗方法效果不十分满意。研究表明,AGA 的发病还可能与一系列信号通路异常有关。其中转化生长因子-β1(transforming growth factor-β,TGF-β1)/β2 可能是AGA 中雄激素与受体作用后的下游分子之一,抑制毛囊外毛根鞘细胞增殖,诱导分化和凋亡,参与AGA 的发病[2]。而TGF-β 必须与细胞膜上高亲和性TGF-β 受体(TGF-β receptor,TGF-βR)结合才能发挥生物学效应[3]。因此,为了明确AGA 发病机制,有必要了解AGA 患者毛囊中TGF-βR 表达情况。
1 材料与方法
1.1 材料
1.1.1 标本来源 15 例男性AGA 为广州粤秀整形机构乐鬃毛发移植中心接受毛发移植的患者,Hamilton分型为Ⅳ~Ⅴa 型,年龄23 ~46 岁,平均(34.6±7.8)岁,近3 个月未系统使用抗雄激素药物和局部使用任何育发类产品或药物治疗,头皮正常完整,无细菌、真菌等感染性疾病及皮炎湿疹等炎症性皮肤病。对实验内容知晓并签署知情同意书。健康志愿者5 例均为男性,作为对照组,年龄(33.0±6.2)岁,为头皮外科手术患者,无AGA 现症及家族史,毛发生长正常。
1.1.2 取材部位选择及方法 AGA 患者头皮分枕部非脱发区、脱发过渡区、脱发区三个区域,每个区域用同一钻孔刀(slot pouch Ø3 mm,Micro-Tools Europe,Germany)各取3 块头皮组织,每块体积3 mm×3 mm×5 mm。对照组取原手术区在额顶部位的含毛囊头皮组织,分成每块体积3 mm×3 mm×5 mm。
1.1.3 实验分组 实验分组为①对照组、②AGA 枕部非脱发区组、③AGA 脱发过渡区组、④AGA 脱发区组。
1.1.4 主要试剂及仪器 兔抗人TGF-βRⅠ多克隆抗体(Abcam 公司);小鼠抗人TGFRⅡ单克隆抗体(Santa Cruz 公司);SP 二抗(上海长岛公司);Olympus 81i光学显微镜等。
1.2 方法
1.2.1 标本制作 新鲜组织取材后立即用10%甲醛固定。将固定的标本组织分离成只含1 ~2 根毛发的小组织,再进行常规脱水、浸蜡、包埋,包埋时尽量使毛囊纵轴与蜡块面平行,切片时尽量以毛囊纵轴为方向,以3 μm 厚度进行连续切片。
1.2.2 免疫组化染色 每个毛囊的切片分别进行TGFβRⅠ和TGF-RⅡ免疫组化染色。石蜡切片经二甲苯10 min,共2 次;100%,95%,85%,80%乙醇各5 min,1 次;蒸馏水冲洗5 min,共3 次;3% H2O2室温下10 min,1 次;蒸馏水冲洗5 min,1 次;0.01 mol/L枸橼酸盐缓冲液高压修复,自然冷却至室温后,PBS冲洗5 min,共3 次;10%正常山羊血清室温封闭10 min,倾去,勿洗;分别滴加TGF-βRⅠ多克隆抗体(1:50稀释,用PBS 稀释)和TGF-βRⅡ单克隆抗体(1:50稀释,用PBS 稀释),以PBS 代替一抗做阴性对照,放入湿盒内4℃过夜(>14 h);室温复温30 min,PBS 冲洗5 min,共3 次;滴加生物素标记二抗,37℃孵育30 min;PBS 冲洗5 min,共3 次;滴加显色底物DAB,镜下观察,适时终止反应;苏木素复染15 ~30 s,流水冲洗5 ~10 min;常规脱水、透明、封片。
1.2.3 结果判定和记录 均以生长期毛囊为观察对象。TGF-βRⅠ和TGF-βRⅡ免疫组化阳性着色表现为胞膜和胞质染成褐色。光学显微镜下观察见细胞中出现浅黄至棕褐色颗粒视为阳性细胞,凡细胞显色强度与背景无明显差别者则为阴性细胞。每组至少观察30 个毛囊,分别记录毛囊中TGF-βRⅠ和TGF-βRⅡ染色强度(阴性为-,浅褐色为+,黄褐色为2+,棕褐色为3+)、分布和阳性毛囊数。
1.3 统计学方法
数据分析与统计学处理采用SPSS16.0。采用多组有序多分类资料的秩和检验和χ2检验。设定双侧P<0.05 为统计学上有显著差异。
2 结果
2.1 TGF-βRⅠ在毛囊中的表达
正常对照组和AGA 患者各组标本生长期毛囊均有TGF-βRⅠ的表达,表达于整个外毛根鞘,以浅褐色~黄褐色为主,毛囊内毛根鞘和真皮乳头均未见明显表达(图1,图2)。各组毛囊TGF-βRⅠ的表达见表1。各组毛囊中TGF-βRⅠ表达无显著性差异(H=0.648,P>0.05)。
2.2 TGF-βRⅡ在毛囊中的表达
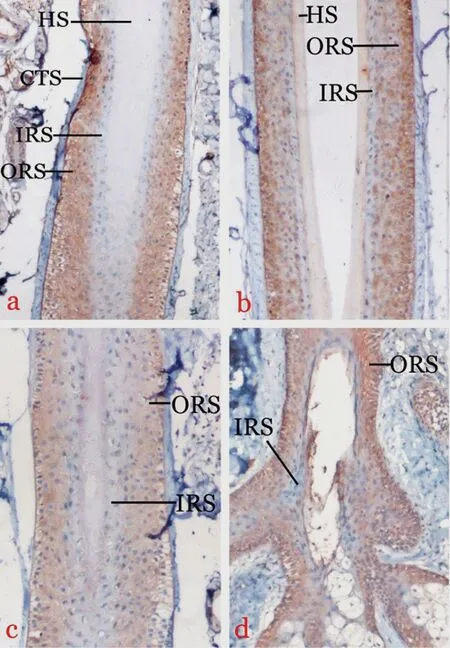
图1 各组毛囊中TGF-βRⅠ的表达(SP法染色×200)

图2 各组毛囊真皮乳头TGF-βRⅠ的表达(SP法染色×200)
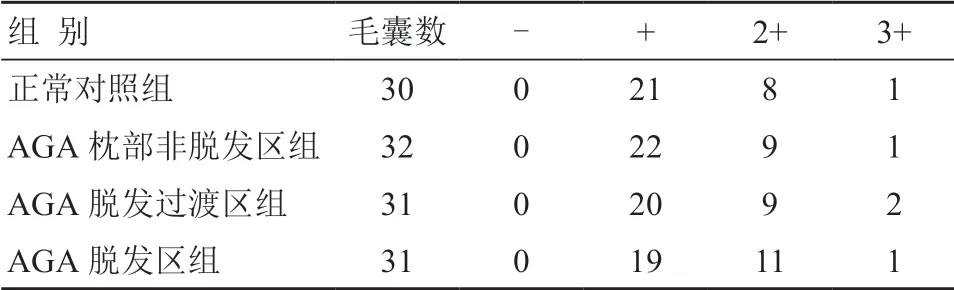
表1 各组毛囊中TGF-βRⅠ的表达 (个)
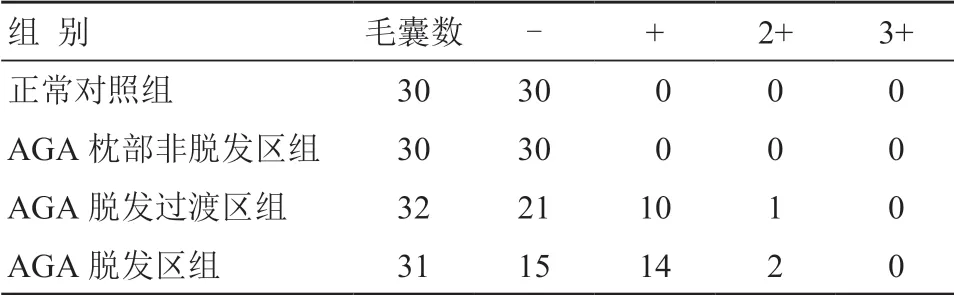
表2 各组毛囊中TGF-βRⅡ的表达 (个)
在正常对照组和AGA 枕部非脱发区组毛囊中均未见TGF-βRⅡ表达;AGA 脱发过渡区组有34.4%(11/32)的毛囊其外毛根鞘可见有轻度TGF-βRⅡ表达,以浅褐色为主;AGA 脱发区组有51.6%(16/31)的毛囊其外毛根鞘可见有轻度TGF-βRⅡ表达,以浅褐色为主;各组毛囊的内毛根鞘和真皮乳头均未见TGF-βRⅡ表达(图3,4)。TGF-βRⅡ在各组毛囊中的表达情况见表2。
合并表2 中+和2+数据,然后进行二分类资料比较的χ2检验,比较各组毛囊中TGF-βRⅡ表达阳性毛囊率。正常对照组和AGA 枕部非脱发区组与AGA 脱发过渡区组及脱发区组比较差异均有统计学意义(P过渡区=2.538×10-4<0.05;P脱发区=1.482×10-6<0.05),AGA 脱发过渡区组和脱发区组间比较差异无统计学意义(χ2=1.911,P>0.05)。
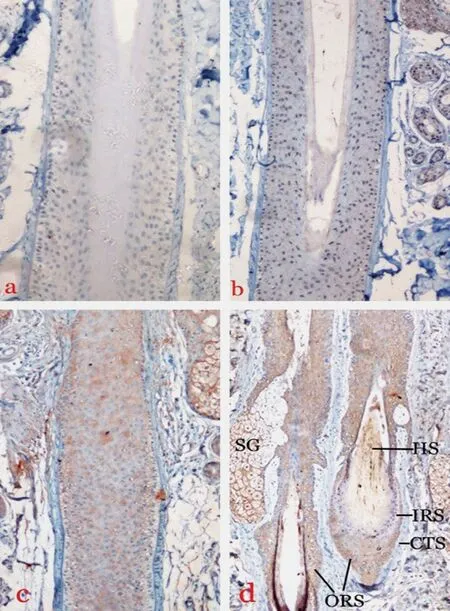
图3 各组毛囊中TGF-βRⅡ的表达(SP法染色×200)
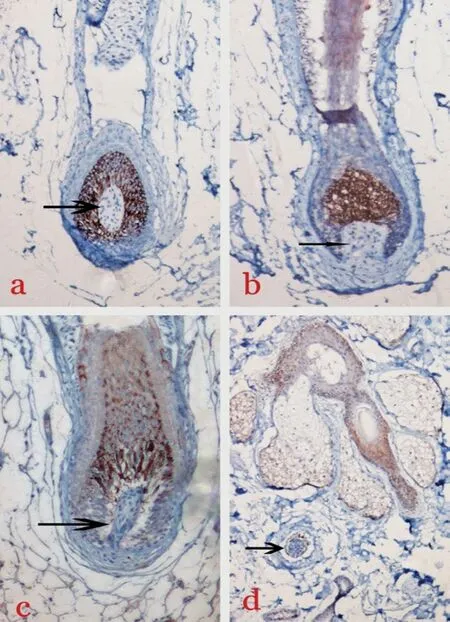
图4 各组毛囊真皮乳头TGF-βRⅡ的表达(SP 法染色×200)
3 讨论
AGA 患者受累毛囊表现为毛囊由生长期提前进入退行期,毛囊生长期逐渐地进行性缩短,毛囊再生不完全,逐渐微型化,毛发则逐渐变短、变细,毫毛化,至最终形成秃发[4]。因此,明确诱导毛囊进入退行期和抑制毛囊再生的分子机制对了解和防治AGA 至关重要。实验证实,多种细胞因子参与了毛囊退行期的调控,如Fas,TGF-β,肿瘤坏死因子(TNF)-α,成纤维细胞生长因子(FGF)-5,胰岛素样生长因子(IGF)-1,神经营养素等[5,6]。TGF-β 是参与人类毛囊退行期调控的重要因子之一,在人类毛囊周期循环中起着重要的作用,调控着毛囊细胞的增殖、分化和凋亡,从而维持和改变着毛囊的形态[7]。
研究发现,雄激素可刺激AGA 患者脱发区毛囊真皮乳头细胞分泌更多TGF-β1/β2,并使其活性增加,它们均是毛囊退行期强诱导剂,抑制毛囊外毛根鞘角质形成细胞增殖,诱导其分化和凋亡,使毛囊生长期缩短,毛囊提前出现退行期改变[2,8,9]。TGF-β 被认为可能是雄激素在AGA 发病中的下游分子机制之一。TGF-β必须与细胞膜表面的TGF-βRⅠ和TGF-βRⅡ一起结合才能发挥其作用,这两种受体是信号传导所必需的,且是信号转导途径的首要环节,只与一种受体结合是无效的[3]。目前关于AGA 患者毛囊中TGF-βRⅠ和RⅡ的表达情况,鲜见文献报道。所以对AGA 患者毛囊TGF-βR 表达的研究是非常必要的,可进一步从TGF-βR 角度探讨TGF-β 信号通路的在AGA 发病中的可能作用。
本实验结果发现,TGF-βRⅠ表达于各组毛囊整个外毛根鞘,而内毛根鞘和真皮乳头未见表达,各组间TGF-βRⅠ表达是无差异的。这与文献报道的正常人生长期毛囊中TGF-βRⅠ表达的结果一致[10]。提示,TGF-βRⅠ在AGA 毛囊中的表达没有异常,TGFβRⅠ的表达不是AGA 发病的因素,在AGA 发病中可能处于从属的地位。在正常对照组和AGA 枕部非脱发区组毛囊均未见有TGF-βRⅡ的表达;AGA 脱发过渡区组毛囊中,有34.4%(11/32)的毛囊其外毛根鞘可见有TGF-βRⅡ表达;AGA 脱发区组毛囊中,有51.6%(16/31)的毛囊其外毛根鞘可见有TGF-βRⅡ表达;各组毛囊的内毛根鞘和真皮乳头均未见有TGF-βRⅡ表达。结果表明,在男性AGA 患者脱发区和脱发过渡区有毛囊同时表达TGF-βRⅠ和RⅡ。因此,从TGF-βR 角度来看,提示这些毛囊中可能存在TGF-β 信号通路活化的迹象。结合既往研究,雄激素可刺激AGA 患者脱发区毛囊真皮乳头细胞分泌更多TGF-β1/β2,并使其活性增加[2,8,9],进一步提示AGA患者受累毛囊存在TGF-β 信号通路活化的迹象。
至于AGA 患者脱发区和脱发过渡区生长期毛囊出现TGF-βRⅡ的异常表达的原因,还不清楚。AGA是在遗传背景上发生的脱发性疾病,脱发的部位主要发生在前额—顶部,而两鬓和枕部不受影响,脱发部位的特殊性与脱发区毛囊和头皮的雄激素受体、Ⅱ型5-α 还原酶和二氢睾酮(DHT)水平特异性升高有关[11]。AGA 毛囊TGF-βRⅡ异常表达与AGA 脱发部位的特殊性存在一定的一致性,也与AGA 患者头皮毛囊雄激素受体、Ⅱ型5-α 还原酶和DHT 部位特异性增高一致。因此,推测AGA 脱发区和脱发过渡区毛囊TGF-βRⅡ异常表达可能与遗传有一定的关系。TGF-βRⅡ在男性AGA 患者脱发区和脱发过渡区生长期毛囊存在异常表达,参与了这些部位毛囊的病变过程,而在枕部非脱发区毛囊未见有TGF-βRⅡ,说明该部位生长期毛囊不存在TGF-β 信号通路活化,同时该部位毛囊中雄激素受体、Ⅱ型5-α 还原酶和DHT 水平也低,雄激素也不能刺激该部位毛囊真皮乳头细胞产生过多的抑制性细胞因子TGF-β1/β2,这就进一步解释了为何毛囊从枕部移植到前额-顶部脱发区能成活且不再发生AGA 样的毛囊组织病理改变的原因。
各组毛囊真皮乳头细胞均未表达TGF-βRⅠ和TGF-βRⅡ,提示该部位可能不受TGF-β 信号通路的影响,这可能是AGA 受累毛囊真皮乳头长期保留[12]的机制之一。
综上,男性AGA 患者脱发过渡区和脱发区的部分生长期毛囊存在TGF-β 信号通路活化的迹象,其中TGF-βRⅠ表达可能不是男性AGA 发病主要的因素;TGF-βRⅡ的异常表达可能在男性AGA 发病中起重要的作用。它与TGF-βRⅠ一起活化TGF-β 信号通路,使生长期毛囊中细胞增殖活性下降,毛囊生长受到抑制,毛囊渐微型化至最终形成脱发。这为今后从TGF-βR 封闭的角度开发新的治疗AGA 手段提供了重要的理论依据。特别是TGF-βRⅡ,或从TGF-β1/β2 拮抗剂角度两个方面,来阻断TGF-β 信号通路在AGA 中的异常活化,从而为治疗AGA 开辟新的途径。
