龙鹿胶囊通过SIRT1/eNOS 信号通路对糖尿病大鼠勃起功能障碍的影响
2021-05-19夏雨果曾文彤张蜀武
夏雨果 陈 秋 高 坪 曾文彤 张蜀武
1. 成都中医药大学附属医院泌尿外科(四川成都 610072);2. 成都中医药大学附属医院内分泌科(四川成都 610072)
由糖尿病诱发的勃起功能障碍称为糖尿病勃起功能障碍(diabetes mellitus erectile dysfunction,DMED)[1],其发病率逐年升高,成为影响男性性功能的重要因素,目前治疗效果欠佳, 中医药对DMED 有独特疗效,本文研究龙鹿胶囊对DMED 大鼠勃起功能的影响并探讨其作用机制,为中医药治疗DMED 提供理论基础。
材料与方法
一、实验动物及主要试剂仪器
本动物实验通过成都中医药大学附属医院伦理委员会批准,SPF 级雄性SD 大鼠 (约6-7 周龄, 体重200-350 克)购自成都达硕实验动物公司;龙鹿胶囊原药购自天津和治药业集团有限公司。 实时荧光定量仪(ThermoFisher,美国),STZ、焦碳酸二乙酯(DEPC)(sigma, 美国),Trizol (invitrogen 公司),SYBR Premix Ex Taq II Kit、PrimeScript RT reagent Kit (宝生生物工程大连有限公司),Sirt1、β-actin 引物 (上海生工合成);大鼠NO、SOD、MDA Ellisa 检测试剂盒 (上海茁彩生物科技有限公司),Sirt1、eNOS、β-actin 抗体(美国Affinity 公司),BCA 蛋白浓度测定试剂盒 (南京凯基生物公司),ECL 发光试剂盒 (美国Thermo 公司), 蛋白Marker (美国NEB 公司),PVDF 膜 (美国Hybond 公司);浓缩型DAB 试剂盒、羊抗兔二抗(北京中衫金桥生物有限公司), 大鼠ICP/MAP 测定使用BL-420 生物机能实验系统(成都泰盟科技有限公司),免疫组化采图及分析使用Image-Pro Plus 6.0 (美国Media Cybernetics 公司)。
二、DMED 大鼠模型的建立
6-7 周龄70 只雄性SD 大鼠适应性饲养1 周后,测大鼠随机血糖作为基线, 由电脑随机排位抽取10 只大鼠作为正常组, 余60 只作为实验组。 实验组腹腔注射60mg/kg STZ 诱导1 型糖尿病,正常组大鼠注射等量的生理盐水, 注射后7 天取大鼠尾静脉血测定随机血糖,以血糖>16.7mmol/L 作为糖尿病成模标准[2],未成模的大鼠补注射1 次STZ, 注射浓度为30mg/kg, 注射后3天再按以上标准筛选模型。 将大鼠饲养于SPF 环境,自由饮水,定时喂养,用灯光行人工昼夜调节,糖尿病大鼠饲养10 周后, 依照本课题组前期的筛选方法[3]筛选DMED 大鼠,将APO 按100μg/kg 皮下注射于大鼠颈部皮肤,观察30 分钟,摄像机记录大鼠有无勃起以及勃起次数,其中未见勃起者筛选为DMED 大鼠。大鼠阴茎勃起的标准为:龟头露出充血,包皮后退,阴茎膨大增长。
三、实验分组及给药
原随机分配的正常组不变, 将筛选成功的DMED大鼠42 只随机分为3 组,每组14 只,最终分组情况如下:A:正常组;B:DMED 组,即糖尿病勃起功能障碍模型组,仅对大鼠灌胃等量的生理盐水;C:龙鹿胶囊组:即按每日360mg/kg 的龙鹿胶囊原药(为临床常用剂量的6 倍)对DMED 大鼠进行灌胃;D:西地那非组:即按每日5mg/kg 的西地那非对DMED 大鼠进行灌胃。 给药后2 周及4 周测定大鼠体重及血糖, 给药4 周后测定ICP/MAP 评估大鼠勃起功能,测量完成后取大鼠阴茎组织进行病理学及分子生物学检测。
四、阴茎海绵体内压(ICP)及平均颈动脉压(MAP)的测定
各实验组给药4 周后进行ICP/MAP 测定, 各组大鼠ICP/MAP 测定前24 小时停止给药, 测定日晨禁食,予以10%水合氯醛6ml/kg 腹腔注射对大鼠进行麻醉,常规消毒铺巾,参考陈婉媚等[4]报道方法,先暴露颈总动脉,将22 号蝶形插管插入颈总动脉固定后与BL-420生物机能实验系统连接测定MAP 值。 解剖分离大鼠阴茎,将24 号蝶形针插入阴茎海绵体连接传感器测定基础ICP,再分离出阴茎根部的海绵体神经,将BL-420 生物机能实验系统的电极钩住海绵体神经, 电刺激神经诱导勃起,测定勃起状态下ICP 值。
五、免疫组化测定eNOS 在细胞中的表达
将10%的甲醛固定的组织经全自动脱水机脱水,包埋,切片,将切片经脱蜡浸入3%甲醇双氧水10min,PBS 洗3 次, 每次5min, 柠檬酸盐缓冲液加温至沸腾,PBS 洗净后加入封闭液浸泡20min, 然后加入兔抗鼠eNOS 孵育过夜,滴加生物素化二抗,37℃30 min,PBS洗3 次后DAB 显色,透明树胶封片,光镜下采图,结果使用Image-Pro Plus 6.0 进行分析。
六、qPCR(定量PCR)测定mRNA 表达
取出冷冻保存的阴茎组织称取100mg, 按说明书依次加入Trizol、氯仿、异丙醇等试剂提取总RNA,将提取的总RNA 使用DNA Eraser Buffer 试剂盒去除DNA,纯化RNA,将得到的RNA 用PrimeScript RT Enzyme Mix I 试剂盒进行逆转录反应,反应完成后加入引物进行PCR 扩增, 引物序列如下:SIRT1 上游引物:tggcagtaacagtgacagtggcacat,SIRT1 下 游 引 物:tcagctccagatcctccagcacactc;β-actin 上 游 引 物 :gaagatcaagatcattgctcct,β-actin 下游引物:tactcctgcttgctgatcca; eNOS上 游 引 物:agctggatgaagccggtgac,eNOS 下 游 引 物:cctcgtggtagcgttgctga, 反应条件设置为95℃预变性30s,95℃变性5s,55℃退火30s,72℃反应30s 充分延伸并采集荧光, 以上反应循环40 次, 最终结果采用2-ΔΔCT 方法进行分析。
七、Western blot 检测蛋白表达
取液氮冻存小鼠阴茎组织于37℃水浴中解冻,按1:10 的比例加入RIPA 裂解液后用灭菌后的小剪刀剪碎,置碎冰上裂解10min;收集裂解液并离心取上清液,用BCA 蛋白测定法检测样品中的总蛋白浓度。 将配制好的30%聚丙烯酰胺凝胶加入电泳液, 根据所测蛋白浓度用移液枪按浓度加入60μg 蛋白量加至样孔中进行电泳,电泳结束后将分离的蛋白转膜至PVDF 膜,将膜置入含有牛奶的TBS-T 中封闭,加入一抗孵育过夜,其中一抗浓度按β-actin 1:5000、 SIRT1 1:500、eNOS 1:500 的比例进行稀释, 次日加入羊抗兔二抗进行孵育,最后进行显影、定影、拍照。 用Quentity One 进行目的条带分析, 目的蛋白相对表达量=目的蛋白积分光密度值(IOD)/内参积分光密度值(IOD)。
八、ELLISA 测定SOD、MDA、NO 的表达
将冷冻保存的组织解冻并匀浆,按照ELLISA 说明书于空白孔加入显色剂A、B 和终止液。 标准品中加入标准品50μL,待测样品孔中加入样本50μL,然后均加入辣根过氧化物酶100μL,37℃温育60 min,洗涤后加入TAB 底物显色,以空白孔调零,用酶标仪在450nm波长下测定吸光度(OD 值),计算样品浓度。
九、统计学分析
实验结果
一、体重与血糖变化
建模开始前, 各组大鼠基线体重、 血糖无明显差别,无基线误差,随着大鼠生长周期的延长,大鼠的体重逐渐增加,但正常组大鼠体重增加更多,注射STZ4周后糖尿病大鼠体重明显低于正常组, 而在相同时间点,DMED 组、龙鹿胶囊组、西地那非组大鼠体重均明显低于正常组(P<0.01),但DMED 组、龙鹿胶囊组、西地那非组大鼠体重无明显差别。 注射STZ 后1 周DMED 组、 龙鹿胶囊组、 西地那非组大鼠血糖明显升高,高于正常组(P<0.01),其值达到大鼠糖尿病诊断标准,使用龙鹿胶囊后,大鼠血糖值无明显变化。

表1 各组大鼠体重的变化
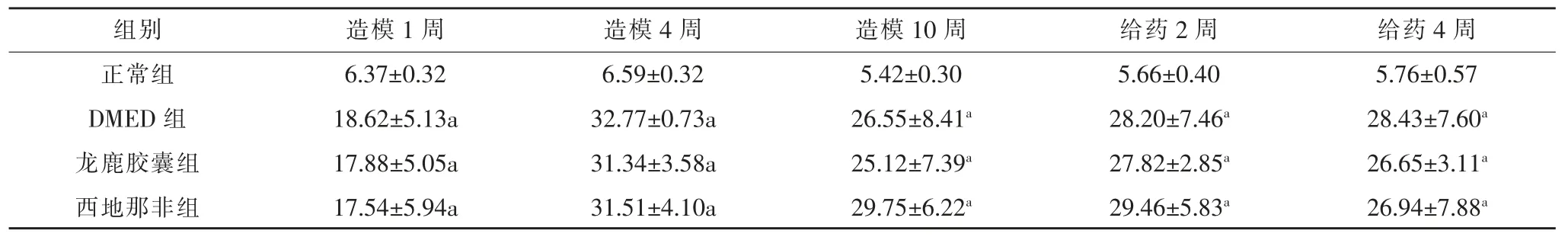
表2 各组大鼠血糖变化
二、各组大鼠阴茎组织中SOD、MDA、NO 的表达水平
与正常组相比,DMED 组大鼠阴茎组织中MDA的含量明显升高 (P<0.01),SOD、NO 的含量明显降低(P<0.01)。 与DMED 组相比,龙鹿胶囊组SOD、NO 水平明显升高(P<0.05,P<0.01)、同时也高于西地那非组(P<0.05)。 但龙鹿胶囊组MDA 水平低于DMED 组(P<0.05),与正常组无统计学差异,如表3 所示。
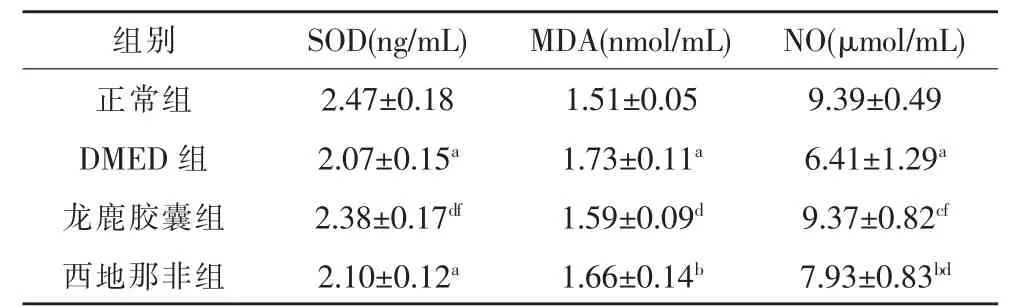
表3 ELLISA 检测各组大鼠SOD、MDA、NO 的表达水平
三、ICP/MAP 测定结果
经颈动脉测得各组大鼠动脉血压无明显差异(P>0.05), 西地那非组DMED 组及龙鹿胶囊组的基础ICP 值低于正常组(P<0.01)。诱导勃起后DMED 组ICP值仍明显低于正常组(P<0.01);龙鹿胶囊组勃起后ICP值虽低于正常组(P<0.05),但明显高于DMED 组(P<0.01),而且也高于西地那非组(P<0.01),如表4 所示。

表4 各组治疗后ICP/MAP 比较结果
四、各组大鼠阴茎组织SIRT1、eNOS mRNA 表达的变化
定量PCR 结果显示,DMED 组阴茎组织SIRT1 mRNA 相对表达量低于正常组(P<0.01),但龙鹿胶囊组SIRT1 mRNA 表达水平明显高于DMED 组 (0.79±0.12 vs 0.39±0.14,P<0.01),与正常组表达水平无明显差别(P>0.05)。龙鹿胶囊组的eNOS mRNA 表达量虽低于正常组(P<0.05),但明显高于DMED 组(P<0.01),也高于西地那非组(P<0.05),如图1 所示。
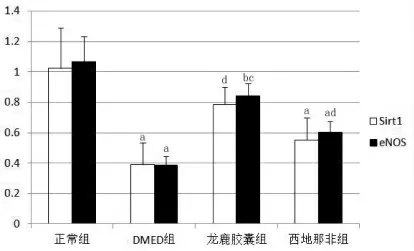
图1 SIRT1、eNOS 的mRNA 表达柱状图
五、SIRT1、eNOS 蛋白在各组大鼠阴茎组织的表达水平
结果显示DMED 组的SIRT1 及eNOS 的表达量显著低于正常组(P<0.01),龙鹿胶囊组SIRT1 的表达量虽低于正常组(P<0.05),但高于DMED 组及西地那非组(P<0.05)。龙鹿胶囊组eNOS 蛋白表达量显著高于DMED 组(0.99±0.05 vs 0.50±0.19,P<0.01),也高于西地那非组(0.99±0.05 vs 0.76±0.06,P<0.05),与正常组无明显差别(P>0.05),如图2 所示。

图2 western blot 检测SIRT1、eNOS 蛋白表达
六、免疫组化评估eNOS 在阴茎海绵体中的分布
大鼠阴茎eNOS 免疫组化切片中底物为白色,阴性细胞呈蓝色,阳性细胞呈黄色或棕黄色,正常组eNOS阳性细胞表达较多,主要分布于血管周围内皮细胞,位于细胞浆。 DMED 组eNOS 平均光密度值较正常组明显降低(P<0.01),龙鹿胶囊组eNOS 平均光密度值明显高于DMED 组(P<0.05),与正常组无明显差别(P>0.05)。
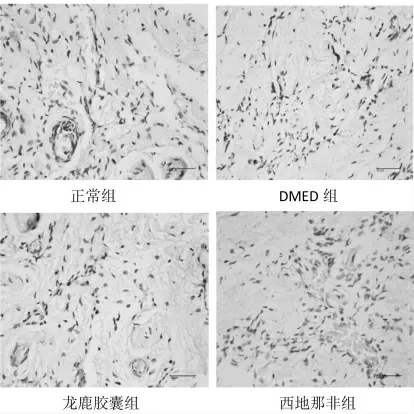
图3 eNOS 免疫组化图
讨 论
近年来随着我国社会经济的发展以及人们生活方式的改变, 高脂饮食及缺少运动导致越来越多的人群患有糖尿病,糖尿病患病率升高且患病年龄年轻化,更易诱发勃起功能障碍, 成为影响男性生活健康及家庭和谐的重要因素, 受到社会学家和医学研究者极大关注。DMED 的发病机制还不是很清楚,目前国内外的研究主要集中在阴茎血管内皮细胞及平滑肌细胞结构功能损害、神经因素、内分泌因素及心理社会因素等四个方面, 特别是阴茎血管内皮细胞的功能障碍与DMED关系最为密切[5]。 阴茎勃起实质上是神经内分泌调节下的血管活动过程, 正常的阴茎勃起依赖于完整的血管内皮结构及良好的功能, 完整的血管内皮细胞可有效地通过NO/cGMP 途径扩张阴茎血管使海绵体充血从而达到有效的勃起[6]。 而糖尿病病人体内的高血糖环境激活氧化应激反应, 过量的氧化应激产物损伤血管内皮细胞引起氧自由基超载、线粒体功能障碍,使内皮细胞释放NO 功能障碍,甚至引起内皮细胞凋亡,从而影响到阴茎的勃起功能[7]。 本研究也证实在糖尿病大鼠阴茎组织中抗氧化物SOD 明显减少,产生过量的MDA,增多的氧化应激产物损伤血管内皮细胞, 使其产生的NO 明显降低, 进一步研究发现其上游抗氧化基因SIRT1 表达被抑制。 因此,通过抑制氧化应激损伤保护阴茎血管内皮细胞是治疗DMED 的有效方法。 目前临床广泛使用的治疗ED 的药物如西地拉非、他达拉非等属PDE5 抑制剂, 主要通过抑制cGMP 的降解松驰平滑肌从而诱导勃起[8],其前提是阴茎血管内皮细胞要产生足够量的NO, 但由于糖尿病患者阴茎内皮损伤严重,大量内皮细胞因氧化应激损伤而凋亡,一氧化氮合酶(eNOS)严重缺乏,而eNOS 在一氧化氮NO 的合成、阴茎勃起的神经内分泌调节中起决定性作用。 因而对PDE5 抑制剂药效不敏感,治疗效果欠佳[9],临床上亟需寻找一种能保护血管内皮细胞的药物, 更有效的治疗DMED。 祖国传统中医药源远流长,治疗ED 有着悠久的历史和丰富的经验,在《黄帝内经》中以“阴痿”、“筋痿”指阳痿一病,如“经筋之病,寒则反折筋急,热则筋弛纵不收,阴痿不用”,“思想无穷,所愿不得,意淫于外,入房太甚,宗筋驰纵,发为筋痿”均是其论述。 “阳萎”之名首见于明代周之干所著《慎斋遗书》:“阳萎多属于寒,锁阳固精,肉苁蓉壮阳,菟丝子添精,杞子升发阳气,或建中汤以温之”等相关的论述。 糖尿病在中医称之为“消渴”,消渴所致阳萎在古籍中亦有论述[10],明代赵献可在《医贯》中论述消渴时就提及“或心烦躁渴,小便频数,或白浊阴痿”;《杂病源流犀烛·三消源流》亦有所述:“有肾消大渴便数,腰膝痛者化源既病,则阳道外衰,故不得隐曲而枯涩,女子不月”[11]。 从古籍中可以看出对阳萎的治疗主要以“肾”为主,以“补”为治法的辨治理论,治肾又以肾气、肾精为着手点,如人参、杜仲、淫羊霍、鹿茸等动植物药成为治疗阳萎的常用中草药,符合“肾藏精,主生殖”的理念。
龙鹿胶囊由人参、鹿茸、淫羊藿、狗鞭、驴鞭、熟地黄、山茱萸、五味子、海龙、附子、补骨脂、肉苁蓉、锁阳、巴戟天、枸杞子、麦冬、山药、当归、黄芪、白术、茯苓、菟丝子、覆盆子、牡丹皮、杜仲、续断等中药组成,具有温肾壮阳、益气滋肾、涩精止遗的功效,临床主要用于元气亏虚之精神萎靡、食欲不振、遗精阳痿、精寒无子;女子宫寒、久不孕育。全方以人参、黄芪大补元气;淫羊藿、肉苁蓉、巴戟天、附子等温补肾阳;熟地黄、枸杞子、麦冬等滋养肾阴;黄芪、白术、当归、牡丹皮健脾补血改善微循环;全方兼顾气、血、阴、阳,并于阴中求阳,所谓善补阳者,必于阴中求阳,则阳得阴助而生化无穷,纵观全方补而不燥,滋而不腻,特别是方中鹿茸、海龙、狗鞭、驴鞭等血肉有情之品的运用,不仅增强了补肾生精之功,也符合张景岳“精不足者补之以味”之理念。 金保方[12]等研究表明龙鹿胶囊不仅具有补肾助阳功效,还能增强机体抗氧化作用, 龙鹿胶囊能有效提高少弱精子患者的精子质量,降低精子DFI,提高精液SOD 水平,有效抗氧化应激损伤。龙鹿胶囊遵循中医理论、组方精妙,其中多种单味中药及其提取物具有明显的抗氧化作用,如人参具有益气补中、生津止渴等功效,常被用来治疗消渴病,其提取物人参皂苷Rg1 有明显的抗氧化及保护血管内皮细胞功能,能降低氧化应激产物的生成,提高机体的抗氧化功能,减少糖尿病并发症的发生[13]。 本方中的其它中药提取物如黄芪多糖、地黄多糖、当归多糖、枸杞多糖等都与细胞的抗氧化能力及抗凋亡密切相关,在试验设计之初我们就推测龙鹿胶囊可能通过保护阴茎血管内皮细胞改善DMED 大鼠的勃起功能。 本课题组前期实验将携带多效生长因子(PTN)基因的脂肪干细胞注射到DMED 大鼠的阴茎海绵体1 周后即能检测PTN 基因高表达,大鼠阴茎新生血管增多,DMED 大鼠受损的勃起功能得到有效恢复[14]。 本课题组通过注射链脲霉素成功构建糖尿病勃起功能障碍动物模型,并用龙鹿胶囊进行灌胃,虽未观察到龙鹿胶囊对糖尿病大鼠血糖有明显影响,但明显增加了抗氧化应激物SOD 的产生、降低氧化应激产物MDA 的生成, 保护了阴茎血管内皮细胞,上调eNOS 的产生,增加血管舒张因子NO 的产生,从而改善DMED 大鼠的勃起功能。
沉默信息调节因子2 相关酶1 (silent information regulator 2-related enzymes 1,Sirtuin 1,SIRT1)是一种依赖烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucletide,NAD)的Ⅲ类组蛋白去乙酰化酶,属于哺乳动物Sirtuin 家族, 有充分证据表明SIRT1 在许多病理生理过程中起着关键作用,如氧化应激反应、细胞能量代谢及细胞周期调节等, 近来研究表明其具有延缓血管内皮细胞衰老,维持血管内皮功能稳定等作用[15]。 它可通过调节内皮源型一氧化氮合酶(endothelial nitric oxide syntheses,eNOS)等的活性促进NO 的生成, 改善内皮依赖的血管舒张活性并延缓内皮细胞的衰老[16]。 因此,对于以内皮功能障碍为主要发病原因的DMED,SIRT1是其潜在的治疗靶点之一,Sener TE 等[17]研究发现白黎芦醇能够改善放疗所致前列腺癌病人的勃起功能,其作用机制就是白黎芦醇可以激活SIRT1 基因, 增加抗氧化应激产物GSH(谷胱甘肽)、SOD 的表达,减少氧化应激产物8-OHdG 的产生, 保护了阴茎血管内皮细胞,使海绵体nNOS 及eNOS 的表达增加,在勃起过程中产生更多的NO 及cGMP,改善放疗所致前列腺癌病人的勃起功能障碍。 本研究中龙鹿胶囊能明显减轻DMED 大鼠阴茎组织的氧化应激损伤, 上调SIRT1 的表达,保护阴茎血管内皮细胞,并激活下游基因eNOS的表达,增加了NO 的产生,同时免疫组化显示上调表达的eNOS 主要分布于海绵体的血管内皮细胞, 体现了结构与功能的一致性,与文献报道相符,同时我们也可观察到阴茎海绵体部分肌纤维结构紊乱甚至纤维化,可能也是影响勃起功能的重要因素,这也是我们下一步研究的重点。
综上,本课题组通过腹腔注射STZ 建立DMED 大鼠模型, 用龙鹿胶囊对DMED 大鼠进行灌胃治疗,结果证明龙鹿胶囊能减轻DMED 大鼠阴茎组织的氧化应激损伤,有效改善DMED 大鼠勃起功能,其主要作用机制是激活了Sirt1/eNOS 信号通路, 改善血管内皮细胞产生NO 的能力。
