合并双肾结石肾积水的HS 外科微创治疗1 例
2021-05-19肖遥韩磊杨波郭杨葛欣
肖遥 韩磊 杨波 郭杨 葛欣
(北部战区总医院肝胆外科 辽宁沈阳 110000)
1 病例资料
患者45 岁中年女性,以乏力3 个月为主诉入院,入院前曾就诊于中国医科大学附属第四医院,行血液基因检测提示:遗传性球形细胞增多症,门诊以“遗传性球形细胞增多症”收入科。既往3 个月前因双肾结石于沈阳市红十字会医院行左侧肾造瘘、左侧经皮肾镜取石。查体:全腹软,全腹无压痛,无反跳痛及肌紧张,未触及包块。肋下可触及肿大脾脏,肝肋下未触及,胆囊未触及,墨菲氏征阴性。辅助检查:2020 年10 月11 日中国医科大学附属第四医院遗传性血液和免疫系统疾病基因检测示:ANK1 基因突变,提示:遗传性球形细胞增多症。
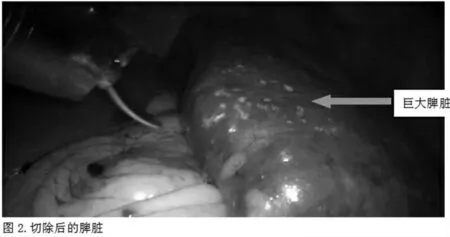
入院后完善CT 检查示(图1):脾增大增厚,约达10 个肋单元,脾下极达腰4 椎体上缘水平,未见异常强化灶。双肾实质可见多发结节状致密影,左肾可见经皮引流管延续至盂管移行处,双肾实质强化欠均匀,右肾实质可见结节状低密度灶,三期无强化。术前相关检查及化验未见手术禁忌,于2020 年12 月14 日在全麻下行腹腔镜脾切除术,术中见(图2):脾脏明显肿大。手术体位为仰卧分腿、头高脚低位,置入Trocar 位置分别为:脐下1cm、剑突下、剑突与脐连线中点、左锁骨中线脐上1cm、左侧腋前线脐上2cm。其中观察孔位于脐下1cm,置入10mm Trocar,剑突下及剑突与脐连线中点为术者操作孔,置入12mmTrocar。左锁骨中线脐上1cm、左侧腋前线脐上2cm 为助手操作孔,置入5mmTrocar。
术中气腹压维持在10mmHg。术中首先进行脾脏的游离,游离脾结肠韧带、脾肾韧带,由于脾脏巨大,脾胃韧带及脾膈韧带显露不佳,仅对显露部分进行游离。考虑到脾蒂离断后可以显著增加脾脏游离度,因此在对可游离的脾脏韧带做最大限度的游离后进行脾蒂的游离。逐支解剖脾门处二级脾蒂血管,分别以2 枚Hemolok 夹夹闭近心端、1 枚Hemolok 夹夹闭远心端后逐支离断二级脾蒂血管。对于解剖出的血管距离无法满足上3 枚Hemolok 夹的二级脾蒂血管,以“4”号丝线于近心端结扎后在远心端及近心端分别上1 枚Hemolok 夹后离断二级脾蒂血管。随着二级脾蒂血管的逐支离断,脾脏下极及中部逐渐显露缺血线。提供脾脏上极血供的二级脾蒂血管迂曲缠绕,分离及其困难。为保证手术安全,术中决定以直线型切割闭合器离断剩余脾蒂。将脾蒂完全离断后脾脏仅与部分脾胃韧带及部分脾膈韧带连接,将剩余的脾脏韧带完全离断,完整切除脾脏。术后予以抗感染、补液、抑酸、镇痛、抗血小板等对症治疗,于2020 年12 月20 日出院。


2 讨论
遗传性球形红细胞增多症(hereditary sphero-cytosis,HS)是一种细胞膜缺陷引起的遗传性溶血性贫血。主要发病机制为编码红细胞膜骨架蛋白的基因突变(参与编码的五个主要基因为ANK1、SPTB、SPTA1、SLC4A1、EPB42),导致红细胞膜骨架稳定性下降,细胞膜进行性自动流失,红细胞由双凹盘状逐渐变为球形。球形红细胞因细胞膜表面积与体积比值下降,膜变形性减退,无法通过脾脏而滞留于脾索内,逐渐破坏溶解。[1]由此引起溶血性贫血、溶血性黄疸、脾肿大等一系列临床表现。[2]目前的治疗技术无法从分子水平修复突变的基因,只能通过脾切除来避免球形红细胞因滞留脾索内而裂解死亡,从而延长球形红细胞的生存周期,减轻贫血、黄疸等一系列溶血性症状,因此,治疗遗传性球形红细胞增多症的唯一有效手段是脾切除。[3]HS 常见的并发症为胆囊结石,临床上超过一半患者伴有胆色素性结石。[4]本例患者的临床特点为ANK1 基因突变引起的HS,虽无胆囊结石并发症,但并发有严重的双肾结石,左肾留置造瘘管。治疗方式包括开腹脾切除及腹腔镜脾切除,两种治疗方式各有利弊:开腹脾切除优点是手术操作难度低,术中对出血等突发状况的处理更简便。缺点是切口大,影响美观,术后住院时间相对长。与之相对应的腹腔镜脾切除手术切口小,更为美观,术后住院时间短。但手术操作难度高,术中对突发状况的处理相对困难。[5]本例患者同时要考虑两种术式对于造瘘管的影响,开腹手术基本无影响,腹腔镜手术气腹可能会造成造瘘管的移位、脱落。考虑到患者造瘘管为腹膜后位入路,腹腔内的气腹压对造瘘管的影响相对较小,患者为中年女性,对切口美观有一定的追求,因此选择腹腔镜脾切除术。术中存在的困难及需要注意的方面主要为:1.游离脾脏:通常遵循由易到难的原则,优先处理容易暴露的脾结肠韧带及脾肾韧带,再处理脾胃韧带及脾膈韧带。因HS 患者脾脏通常较大,如无法满意暴露脾胃韧带,可以在处理脾脏其他韧带及脾蒂后,增加脾脏游离度,最后处理脾胃韧带。[6]2.处理脾蒂:目前临床上对脾蒂的处理主要包括原位二级脾蒂离断(laparoscopic splenectomy by secondary pedicledivision,LSSP)和一级脾蒂离断(laparoscopicsplen-ectomy by Endo-GIA division,LSED)两种方式。第一种方式需要对脾蒂的血管进行逐支的解剖、结扎、切断,优点是止血确切;缺点是操作相对困难,有时二级脾蒂血管迂曲,相互缠绕,会给术者的分离造成很大的困难。第二种方式需要用直线型切割闭合器离断游离后的脾蒂,优点是游离难度较低,只要游离出可以伸入切割闭合器的脾蒂后间隙即可;缺点是如果脾蒂较宽,无法一次将脾蒂切割闭合,可能出现断端仅夹闭半个血管腔,导致出血,同时由于脾蒂中存在动脉与静脉,两种血管的压力不同,以同一种切割闭合的压力去处理不同压力的血管,可能会造成闭合不确切、迟发性出血的情况。[7]笔者认为,两种方式可以结合应用,先用LSSP方式离断容易解剖出来的脾蒂血管,再用LSED 将瘦身后的脾蒂一次性切割闭合。需要注意的是,在进行二级脾蒂血管的结扎时,不要用血管夹夹闭,要一律用丝线结扎,否则一旦出现难以游离的二级脾蒂血管,需要转为LSED 法离断剩余脾蒂血管时,可能会出现切割闭合器的路径上存在血管夹阻碍操作的情况。3.取出脾脏:腹腔镜脾切除的优点是切口美观,如何以尽量小的切口将巨大的脾脏标本从腹腔内取出是收尾工作的重点和难点。通常需要将脾脏切割成条状,再装入取物袋逐条取出。笔者认为在切割过程中如果出现小块的脾组织要及时优先取出,不要在整个脾脏都切割完成置入取物袋后再去逐一寻找碎裂的小块脾组织,以免增加碎脾组织腹腔种植的情况发生。
对于巨脾的切除,如何更好的显露术野,增加可操作空间,降低出血风险,是腹腔镜手术中术者最关心的问题。有研究表明术中优先结扎脾动脉,阻断脾脏的动脉血流,可以有效的缩小脾脏的体积,降低手术难度。具体操作为:应用超声刀打开胃结肠韧带及脾胃韧带,进入小网膜,显露出胰腺体部及尾部,同时显露出其上缘的脾动脉,在胰腺体部及尾部交界处对脾动脉隆起部分进行游离,结扎、离断该处的脾动脉主干,然后使用无损伤钳按摩脾脏,促进脾脏的血液回流,从而缩小脾脏的体积。至此,准备工作完毕,再进行脾脏韧带的游离及脾蒂的离断等切除脾脏的常规操作。缩小的脾脏除了提供更大的操作空间,同时重量也会明显减轻,术者及助手对脾脏韧带的显露程度增加,显露难度下降。由于脾脏的血流被阻断,脾蒂处的血管张力也会相应下降,游离脾蒂过程中,因血管张力过大导致血管破裂出血的风险也会明显降低。[8]因此,笔者认为,优先脾动脉结扎的手术方法在腹腔镜脾切除中有推广的必要性,对于巨脾的微创治疗,该方法有着切实可行的实用价值。
