微流控芯片恒温扩增技术快速检测米饭中的蜡样芽孢杆菌
2021-05-18王珍贺磊肖英平卢先东刘艳红陆雯王首锋
王珍,贺磊,肖英平,卢先东,刘艳红,陆雯,王首锋
(1.绿城农科检测技术有限公司,杭州310052;2.宁波爱基因科技有限公司,浙江 宁波315000;3.浙江省农业科学院,杭州310021;4.浙江大学医学院基础医学系,杭州310058)
据世界卫生组织(World Health Organization,WHO)统计,全球每年有近15 亿人感染食源性疾病,其中70%是由食品中的致病微生物污染引起的[1],而由产毒蜡样芽孢杆菌(Bacillus cereus)引起的食物中毒事件占总的细菌性食物中毒事件的11.4%[2]。蜡样芽孢杆菌是革兰阳性兼性厌氧产芽孢菌,通过产生腹泻毒素和呕吐毒素导致人体食物中毒,可引起恶心、呕吐、腹胀、腹痛及腹泻等不适症状。陆湘华等[3]的研究结果显示,多种食品如蒸煮的米饭和炒饭、调料、干制品(面粉、奶粉等)、豆类食品、肉制品等引起的食物中毒,都与蜡样芽孢杆菌有关。
传统的检测方法主要是采取选择性培养基对蜡样芽孢杆菌进行分离培养,再用生化反应鉴定,不仅耗时长而且操作繁杂,特别是在蛋白质毒素结晶试验中,为了得到丰富的游离芽孢,培养时间甚至需要5~7 d[4]。近年来,蜡样芽孢杆菌快速检测方法发展迅速,主要包括传统检测方法和多种核酸扩增技术(nucleic acid amplification technique,NAAT)。目前报道的有普通聚合酶链式反应(polymerase chain reaction, PCR)、多重PCR(multiplex PCR, mPCR)、实时荧光定量PCR(real-time PCR)、叠氮溴化丙锭-定量PCR(propidium monoazide-quantitative PCR,PMA-qPCR)、微 滴 数 字PCR(microdrop digital PCR,ddPCR)、环介导恒温扩增PCR(loop-mediated isothermal amplification-PCR, LAMP-PCR)及酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)等[5-9]。贾雅菁等[10]使用实时荧光环介导恒温扩增(real-time loop-mediated isothermal amplification,RT-LAMP)技术,在等温(60~65 ℃)条件下,于短时间(80 min)内对牛乳中的蜡样芽孢杆菌实现了快速检测。与普通PCR、荧光定量PCR 技术相比,LAMP的突出优点是扩增效率高且不需要昂贵的精密仪器等,但不足之处是在结果判读时,通过肉眼观察浊度或电泳后梯形条带,存在主观性强、易造成污染的情况[11]。
近年来,核酸检测方法在微流控装置中的集成,为临床、食品安全和环境监测应用开发方便、廉价和高效的诊断工具提供了一种极有前途的方法[12-14]。微流控技术不断与核酸恒温扩增技术相结合,通过设计芯片结构、改进加样模式与检测方式,实现了微生物的核酸提取、扩增、检测一体化,并具有多靶点联检等传统核酸检测方法所不具备的优势,即对仪器依赖程度小、对人员操作要求低、对样品需求量小、检测速度快等优点,适合在各种环境中对食源性致病菌进行检测[15-17]。离心式微流控芯片即时检验(point-of-care testing, POCT)在动物源性成分快速鉴定中已有应用[18],而本研究尝试用离心盘式微流控芯片,利用离心力驱动,通过物理反应区域的合理分配,以蜡样芽孢杆菌hblA基因序列为目的条带设计2对引物;利用LAMP技术,在反应体系中加入荧光染料SYTO-9,在恒温扩增过程中进行实时荧光监测,建立蜡样芽孢杆菌的微流控芯片恒温扩增检测方法。
1 材料与方法
1.1 材料
1.1.1 实验阳性质粒与菌株
实验所用阳性质粒参考蜡样芽孢杆菌溶血素hblA基因序列(GenBank登录号:CP040340.1)片段,委托上海百力格生物科技有限公司合成并连接到载体pUC57上,将构建成功的蜡样芽孢杆菌阳性质粒命名为pUC57-hblA。
实验所用的24 个菌株中,除了蜡样芽孢杆菌(编号:LCLY001)为实验室所分离,其余菌株购自中国医学微生物菌种保藏中心(Center for Medical Culture Collection,CMCC),网址为http://www.cmccb.org.cn/cmccbnew/Germ/Germ_sel.php;北京中科质检生物技术有限公司[美国典型菌种保藏中心(American Type Culture Collection,ATCC)代理商],网址为http://www.bzwzw.com/index.php/List/index/id/72.html;中国工业微生物菌种保藏管理中心(China Center of Industrial Culture Collection,CICC),网址为http://www.china-cicc.org/order.html。菌株信息详见表1。

表1 实验用菌株Table 1 Strains for experiment
1.1.2 试剂
胰酪胨大豆肉汤(tryptic soy booth, TSB)培养基、甘露醇卵黄多黏菌素(mannitol egg yolk polymyxin,MYP)、琼脂(山东省青岛高科技园海博生物技术有限公司);荧光预混液(主要成分为Bst聚合酶、dNTP、SYTO-9等)、核酸提取液[主要成分为Tris-HCl、乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)]、聚丙烯酰胺、盐酸胍等(浙江省宁波爱基因科技有限公司)。实验中所用其他试剂均为分析纯,由广东光华科技股份有限公司提供;所用水均为超纯水。
1.1.3 仪器与设备
Lab dancer S25 漩涡振荡仪(德国IKA 公司);TG16KR 高速冷冻离心机(长沙东旺实验仪器有限公司);HFSafe-1500Lc 生物安全柜(上海力康公司);LRH-250F 型生化培养箱(上海一恒科学仪器有限公司);GI80TW 型高压灭菌器[致微(厦门)仪器有限公司];MA2000 微流控芯片检测仪(浙江省宁波爱基因科技有限公司)。
1.2 方法
1.2.1 引物设计
恒温扩增的特异性取决于引物设计[19-21]。基于蜡样芽孢杆菌溶血素hblA基因序列,在线(http://primerexplorer.jp/e/index.html)设计2 对引物,其中上游引物F3/FIP和下游引物B3/BIP序列见表2。
1.2.2 模板DNA 的制备
取1 mL 含有实验菌株的培养液加入到1.5 mL无菌离心管中,以8 000 r/min 离心5 min,尽量吸弃上清液;加入200 μL 核酸提取液和0.2 g 玻璃珠(直径500~600 μm),剧烈振荡混匀5~10 min,100 ℃恒温加热5 min;以1.2×104r/min离心2 min,转移上清液至新的离心管中。
1.2.3 微流控芯片恒温扩增反应条件
恒温扩增反应体系为5 μL,其中包括微流控芯片的固定体系1.5 μL。用1.2.1节的引物混合工作液固定到微流控芯片后,于65 ℃条件下干燥10 min。每次实验时,先将1.2.2 节中制备的核酸提取物15 μL与荧光预混液10 μL进行混合,再加入到预先固定有引物的微流控芯片的点样孔中,进行恒温扩增。以1.0×104μL-1的蜡样芽孢杆菌基因组DNA为检测靶标,设置恒温扩增反应温度分别为59、61、63.5和65 ℃,其他实验条件相同,反应时间30 min,每30 s 采集一次荧光信号,根据出现的扩增曲线进行实时荧光检测。
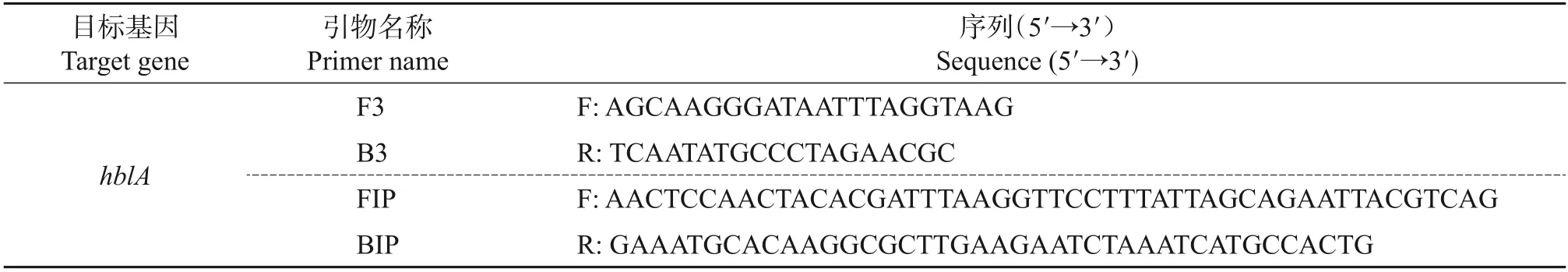
表2 引物序列Table 2 Primer sequences
1.2.4 微流控芯片恒温扩增特异性实验
用1.2.2 节中的方法提取实验菌株的DNA,实验共分成4组,每组8个样品,分别包含蜡样芽孢杆菌、阴性对照和其他6株实验菌株。用1.2.3节中的反应体系和扩增方法对上述标准菌株和实验菌株进行特异性实验,以此来验证各个检测引物的特异性是否满足检测要求。
1.2.5 微流控芯片恒温扩增灵敏度检测实验
分别通过蜡样芽孢杆菌菌液样品与阳性质粒pUC57-hblA样品对微流控芯片恒温扩增灵敏度进行检测。
接种蜡样芽孢杆菌标准菌株于新鲜的无菌胰酪胨大豆肉汤培养基上,在36 ℃条件下培养18 h,随后用无菌生理盐水将菌液稀释至1.7×105、1.7×104、1.7×103、1.7×102、1.7×101CFU/mL 系列浓度,并进行平板菌落计数。分别对每个梯度进行蜡样芽孢杆菌模板DNA的制备,用微流控芯片恒温扩增反应体系和扩增方法对蜡样芽孢杆菌进行灵敏度检测实验。
将蜡样芽孢杆菌阳性质粒pUC57-hblA配置成1×106、1×105、1×104、1×103、1×102、1×101、1×100μL-1的溶液并设置阴性对照,用微流控芯片恒温扩增反应体系和扩增方法对蜡样芽孢杆菌进行灵敏度检测实验。
1.2.6 微流控芯片恒温扩增重复性实验
将含有蜡样芽孢杆菌检测靶点基因的阳性质粒作为实验材料,其浓度为1×104μL-1,进行重复实验,并且计算其变异系数(coefficient of variation,CV),以此来验证检测引物的重复性。
1.2.7 人工污染米饭
选择不含蜡样芽孢杆菌的米饭作为实验样品。取25 g 样品加入到225 mL 无菌生理盐水中混合均匀,再加入1 mL 新鲜的蜡样芽孢杆菌菌液,混合均匀后稀释至5.7×106、5.7×105、5.7×104、5.7×103、5.7×102、5.7×101、5.7×100CFU/mL 系列浓度,并同步计数,分别利用蜡样芽孢杆菌模板制备中的方法提取DNA,用微流控芯片恒温扩增反应体系和扩增方法进行检测。
2 结果与分析
2.1 扩增温度优化
采用微流控芯片联合恒温进行扩增,不需要经过PCR 扩增的变性、退火和延伸等变温过程,整个反应过程在恒温条件下完成。引物等已经预先固定到微流控芯片上,最终微流控芯片反应体系中已包含反应所需的引物。随着反应的进行,在微流控芯片检测仪上进行微流控芯片的恒温扩增,仪器会进行实时荧光检测,根据荧光检测的有效扩增曲线进行判读,任意一孔或者多孔中有标准的S 型扩增曲线,则该孔被判断为阳性,即该样本中含有对应检测孔的核酸;没有扩增曲线的孔被判断为阴性,即该样本不含有对应检测孔的核酸。由于在不同温度条件下,引物自身成环的效率不同,因此,为了提高反应效率,需要对LAMP 引物进行温度优化,以选取最佳的反应条件,结果如图1所示,出现典型曲线的时间仅需15 min。
从中可知:在该引物条件下,LAMP 反应在63.5 ℃有最佳反应效率,且其阈值(CT)最小,荧光值最大。这表明在63.5 ℃条件下,设计的引物自身成环效率更高,反应速率更快。在相同的反应时间内,LAMP反应在该温度条件下有着更多的产物,更有利于检测。

图1 LAMP反应温度优化结果Fig.1 Temperature optimization results of LAMP reaction
2.2 检测方法的特异性
用微流控芯片恒温扩增反应体系和扩增方法,在蜡样芽孢杆菌的微流控检测芯片1~8 号加样孔中,分别加入细菌核酸与荧光预混液的混合物,结果如图2所示。
从中可以看出,在这4组实验中,每组的蜡样芽孢杆菌均为阳性,其他非蜡样芽孢杆菌如鼠伤寒沙门菌、福氏志贺氏菌、金黄色葡萄球菌、副溶血性弧菌等23 种细菌均为阴性。说明所选的蜡样芽孢杆菌引物未与其他细菌出现交叉核酸扩增反应,特异性好。
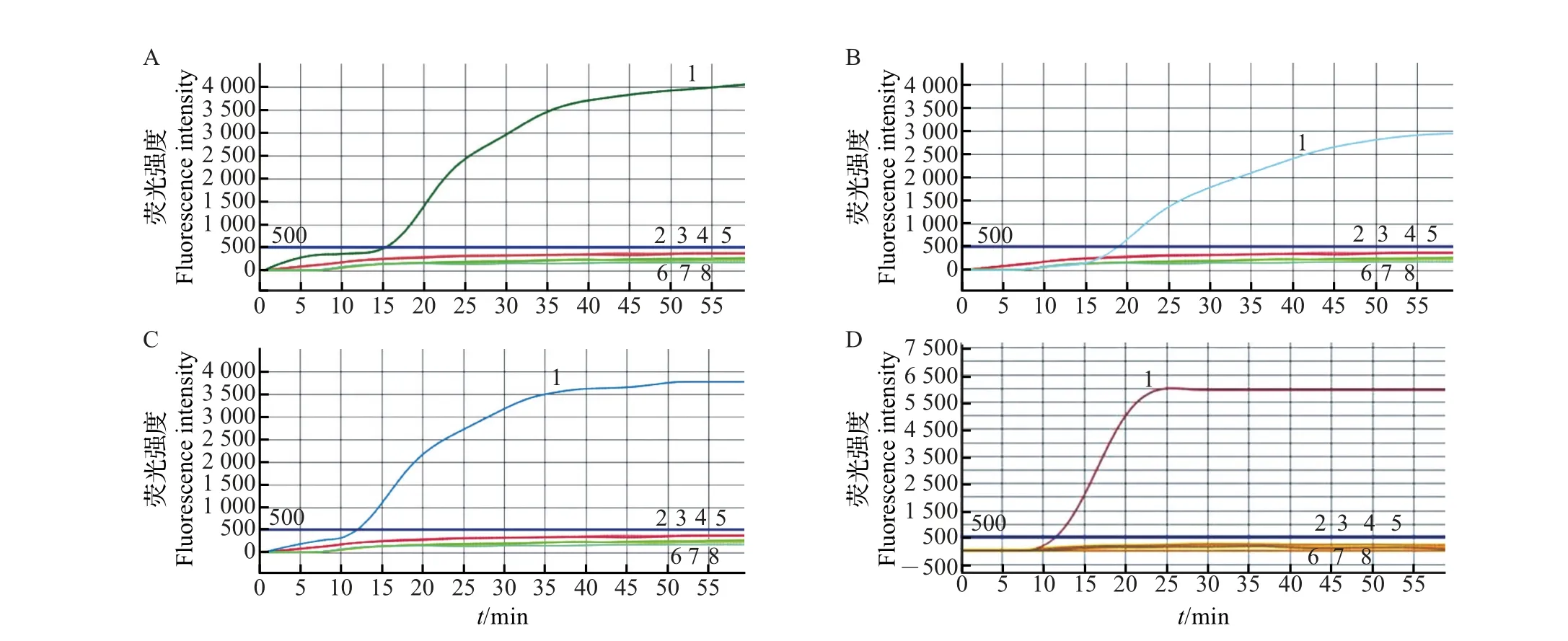
图2 蜡样芽孢杆菌微流控芯片LAMP特异性测试结果Fig.2 Specific testing results of LAMP with microfluidic chip for B.cereus
2.3 检测方法的灵敏度
对蜡样芽孢杆菌菌液样品梯度稀释检测结果如图3 所示。实验结果显示,在170 CFU/mL 浓度以上均能检测出蜡样芽孢杆菌阳性,即灵敏度达170 CFU/mL,等同于荧光定量PCR 产品的检测灵敏度[22-23]。利用微流控体系对蜡样芽孢杆菌菌液进行检测时,最快可在16 min 内获得阳性判定结果;而对于最低检出限浓度的样品,在35 min内可完成反应和结果判定。
对蜡样芽孢杆菌阳性质粒pUC57-hblA进行梯度稀释后的检测结果如图4 所示。结果显示:1×106、1×105、1×104、1×103、1×102、1×101、1×100μL-1蜡样芽孢杆菌阳性质粒pUC57-hblA的最快出峰时间为5 min,最慢为15 min 左右,经过重复实验20 次,得出最低检出限为10 μL-1。
2.4 检测方法的重复性
对同一浓度(1×104μL-1)的蜡样芽孢杆菌质粒进行重复性检测和验证,实验结果如图5 所示。结果显示,对固定有蜡样芽孢杆菌引物的微流控芯片进行8 次重复实验,8 次均出现典型的阳性曲线,且阈值(CT)接近。
从MA2000 微流控芯片检测仪(浙江省宁波爱基因科技有限公司)上分别读取阈值(CT),并根据CT计算变异系数(CV)值,结果如表3所示。从中可知,检测系统对蜡样芽孢杆菌检测的CV<5%,实验重复性良好。
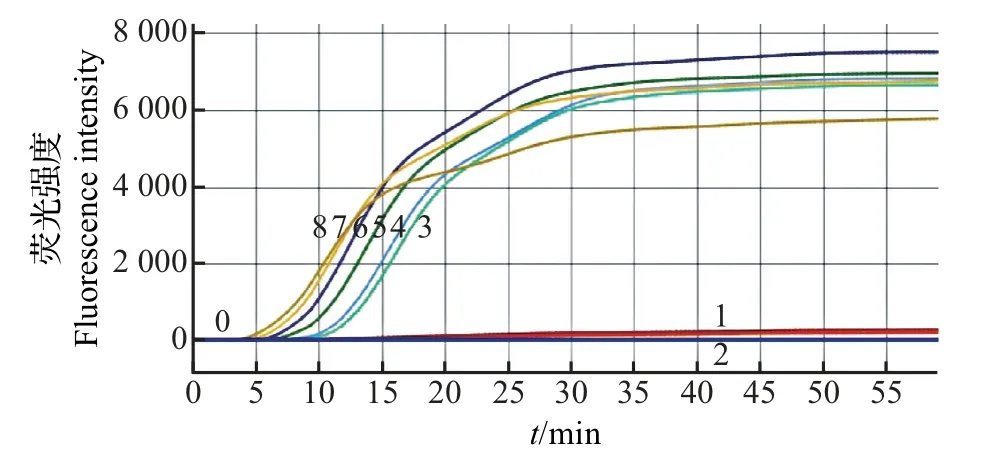
图4 阳性质粒pUC57-hblA 微流控芯片LAMP 反应灵敏度检测结果Fig.4 Sensitivity testing results of LAMP with microfluidic chip for pUC57-hblA
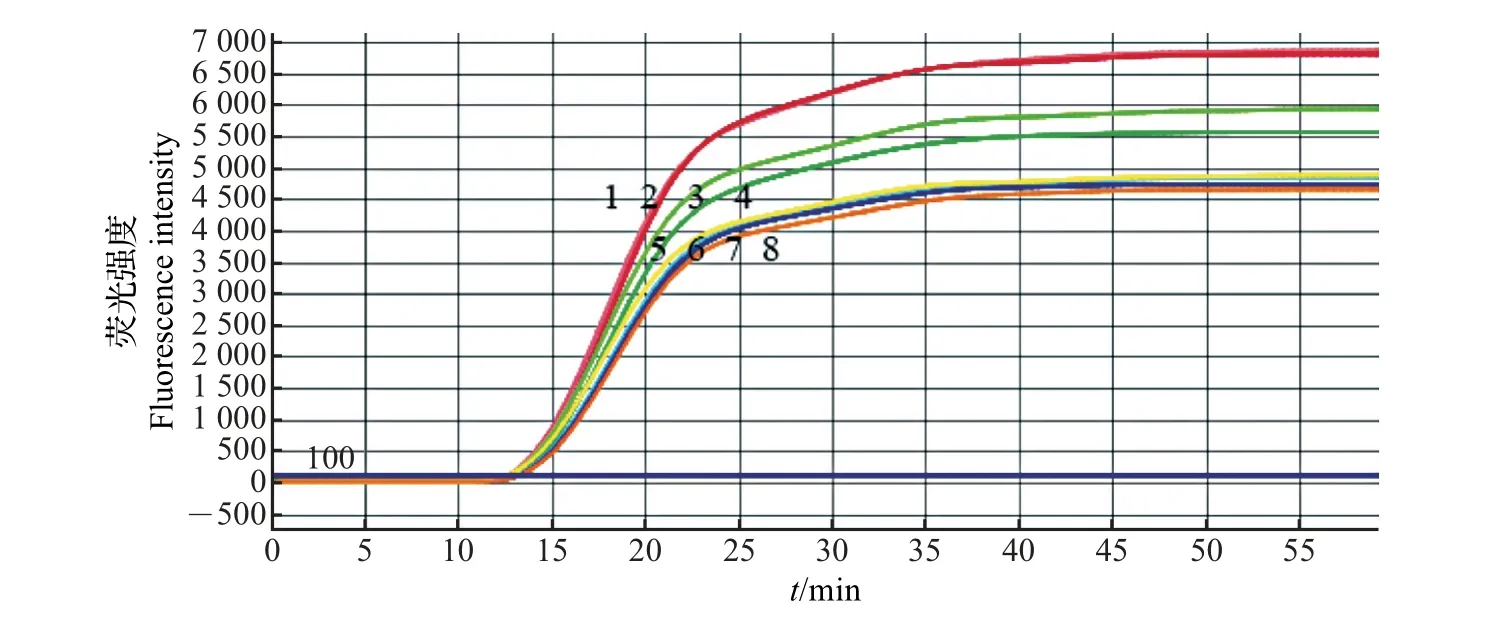
图5 阳性质粒pUC57-hblA微流控芯片LAMP的重复性检测结果Fig.5 Repeatability testing results of LAMP with microfluidic chip for pUC57-hblA
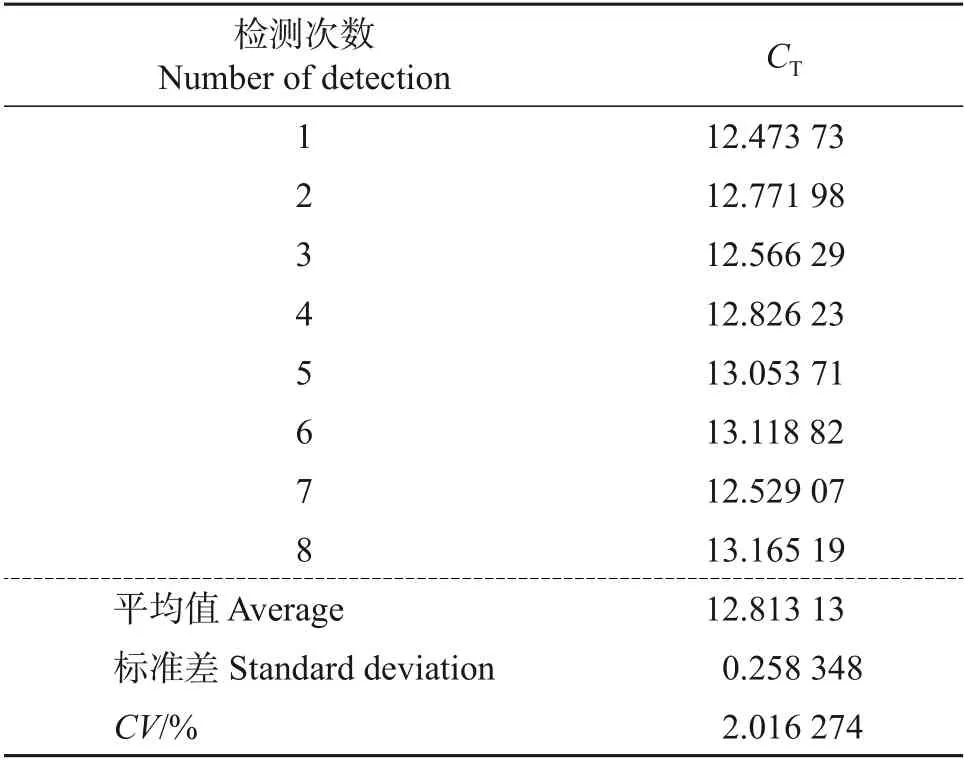
表3 微流控芯片LAMP检测蜡样芽孢杆菌的变异系数分析Table 3 Analysis of the coefficient of variation on the detection of B. cereus by LAMP with microfluidic chip
2.5 人工污染米饭蜡样芽孢杆菌最低检出限
人工污染米饭中的蜡样芽孢杆菌培养后终浓度为5.7×106CFU/mL,梯度稀释后用核酸提取液提取DNA,用微流控芯片恒温扩增反应体系和扩增方法进行微流控芯片恒温扩增检测,结果如图6所示。其中,1~6 号样本检测孔出现扩增峰,仪器判定为阳性,即本实验建立的微流控芯片结合LAMP的检测方法对人工污染米饭中蜡样芽孢杆菌的最低检出限为57 CFU/mL(菌液浓度以稀释10 倍换算,米饭样品中蜡样芽孢杆菌的最低检出限为570 CFU/g),比170 CFU/mL的灵敏度提高了一个数量级。实验结果表明,微流控体系对蜡样芽孢杆菌米饭样品梯度检测,最快可在10 min 内获得阳性判定结果,而对于最低检出限浓度的米饭样品,在45 min出现特征曲线时可判定结果,整个过程不超过1 h。
2.6 微流控芯片
在微流控芯片的制作时,采用微量点样仪将各个核酸引物均匀地点布在微流控芯片上的特定位置区域,芯片反应孔的布局可以设计成多种形状。
如图7所示,每个芯片有8个加样孔,每个加样孔对应编号1、2、3、4 的反应孔,可以实现一个样品的多靶点检测,并设置空白对照与内参对照(即人工合成的靶基因片段)进行环境监控与质量控制,可以有效防止出现假阳性与假阴性的情况,并能减小反应体积,有效降低反应成本。
3 讨论

图6 微流控芯片LAMP检测人工污染米饭中蜡样芽孢杆菌的检出限Fig.6 Limit of detection of B.cereus in artificially polluted rice by LAMP with microfluidic chip

图7 微流控芯片Fig.7 Microfluidic chip
上述实验结果表明,微流控芯片技术与恒温核酸扩增的结合,充分发挥了两者的优点,不仅分析速度快,而且由于不用配制引物部分的反应体系,比传统LAMP 方法更方便;且微流控芯片体积小,消耗的试剂少(微流控芯片法通常为微纳升水平),成本降低。同时,微流控芯片与恒温核酸扩增结合技术的检测灵敏度较高,蜡样芽孢杆菌微流控芯片恒温扩增技术的检测灵敏度为170 CFU/mL,比传统LAMP 方法灵敏度[20]高出10 倍。通过人工污染米饭中的蜡样芽孢杆菌检测结果进一步证实,微流控芯片恒温扩增技术的最低检出限实际能达到57 CFU/mL(570 CFU/g),甚至更低,优于国家标准中推荐的方法(检出限为1.04×102CFU/mL)[22]。核酸提取效率因不同的商业病原菌DNA 提取试剂盒(过滤法和磁珠法)而不同[24],但对质粒的实验研究表明,微流控芯片恒温扩增方法的灵敏度能达到10 μL-1,并且阳性检出时间在10 min 之内,优于大部分同等灵敏度水平的分子生物学快速检测方法(反应时间一般在30 min至8 h内)[25]。
有研究表明,相较于最常用的荧光染料SYBR GreenⅠ[10,26],本研究选择的荧光染料核酸扩增产物的熔解曲线重复性更好,并且对核酸扩增反应的抑制更小[27-28]。hblA基因是一个与腹泻毒素相关的溶血素BL基因(包括hblA、hblB、hblC和hblD)[29]。王振国等[12]、ZHANG 等[30]分别通过扩增hblA、cytK、nheA和hblD基因来对蜡样芽孢杆菌实现快速检测;MÄNTYNEN等[16]发现,通过PCR筛选HblA基因以检测蜡样芽孢杆菌的方法比反向被动胶乳凝集法(reversed passive latex agglutination assay,RPLA)更快,因此,hblA基因是一个用于筛选致病性蜡样芽孢杆菌的常用基因。
传统LAMP 方法最突出的问题是易造成假阳性,而离心光盘式微流控POCT 核酸检测芯片法实现了全封闭操作,可以避免气溶胶的污染,正好弥补了这个缺陷。微流控POCT核酸检测芯片法利用离心力进行驱动,具有主动、可控、可调的优点,很好地将LAMP技术整合于微流控芯片系统。同时,在微流控芯片上设置内参对照,可以监控实验过程是否正常实现了扩增检测反应体系的全封闭化和微量化的功能,从而避免了人员操作造成的人为实验污染。
4 结论
利用蜡样芽孢杆菌公开的hblA基因序列设计2对引物,上游引物为F3/FIP,下游引物为B3/BIP,加入荧光染料SYTO-9,应用微流控芯片通过环介导恒温扩增进行实时荧光读数来快速检测米饭类食品中蜡样芽孢杆菌的方法,其特异性强、灵敏度高,米饭样品中蜡样芽孢杆菌的检出限为570 CFU/g,菌液中蜡样芽孢杆菌的检出限为170 CFU/mL;质粒检出限低至10 μL-1,变异系数CV为2.02%,实验重复性好,可在10~45 min 内出结果,检测速度快,可用于米饭类食品中蜡样芽孢杆菌的快速检测。在多种核酸扩增技术(NAAT)中,LAMP 与微流控芯片结合的核酸扩增检测系统,具备平行检测和多重检测的应用潜力,可为多种致病菌防控的现场即时检验(POCT)提供技术支持,应用前景广阔。
