基于微卫星标记和线粒体DNA监测浙江浆蜂(平湖)的遗传多样性变化
2021-05-18曹联飞林瑞平姜全清符林杰
曹联飞,林瑞平,姜全清,符林杰
(1.浙江省农业科学院畜牧兽医研究所,杭州310021;2.平湖市畜牧兽医站(动物疫病预防控制中心),浙江 嘉兴314200;3.平湖市全清养蜂科技研究所,浙江 嘉兴314200)
浙江浆蜂(Zhejiang Royal Jelly bee)是我国著名的蜂王浆高产型西方蜜蜂遗传资源,由浙江省杭嘉湖地区的蜂农在意大利蜂的基础上,为提高蜂王浆产量,在20 世纪60—80 年代大规模定向选育而形成[1]。浙江浆蜂对于我国蜂王浆产量和出口量长期位居世界首位起着关键作用。浙江浆蜂于2009年通过国家畜禽遗传资源委员会鉴定,并从2013年开始被列入《浙江省畜禽遗传资源保护名录》。
浙江浆蜂的原产地在浙江省嘉兴市平湖地区和杭州市萧山一带,因此又被称为“平湖浆蜂”和“萧山浆蜂”。由于原产地处于沿海区和钱塘江畔,在20世纪蜜粉源丰富,交通相对闭塞,隔离条件较好,从而为浙江浆蜂的形成提供了独特的地理生态环境[1]。然而,随着城市化进程的加快和工业化的发展,嘉兴市平湖地区和杭州市萧山地区已经发展成为重要的工业区,且油菜、紫云英等蜜粉源植物大量减少,使得浙江浆蜂养殖成本大幅度上升,养蜂效益不断下降,且养蜂产业后继无人,导致浙江浆蜂的蜂群数量大量减少。据浙江省平湖市畜牧兽医部门统计,平湖的浙江浆蜂蜂群数量已由2005 年的1.1 万群(峰值)减少到2019年的6 000多群,养蜂户数也减少了一半。为保护浙江浆蜂这一宝贵的蜂种资源,非常有必要对浙江浆蜂进行遗传多样性的监测研究,从而及时采取有效的保护措施。
微卫星分子标记技术具有分布广泛、多态性丰富、共显性遗传、侧翼序列相对保守、稳定性好、检测简便等优点,已被广泛用于物种遗传多样性、种群结构、亲缘关系等的分析中,也是评价保种效果的有效分子标记之一[2-3]。蜜蜂是社会性昆虫,同一个蜂群里的所有工蜂具有相同的母系,而其线粒体DNA(mitochondrial DNA, mtDNA)为母系遗传,因此,利用线粒体DNA进行蜜蜂遗传多样性研究具有很大的优势[4]。吉挺等[5]利用微卫星分子标记研究发现,平湖浆蜂具有较高的群体杂合度和丰富的遗传多样性。YIN 等[6]利用微卫星分子标记发现,不同分布区的浙江浆蜂的遗传多样性较丰富,而且不同分布区之间存在明显的遗传分化。CAO等[7]利用线粒体COⅠ-COⅡ序列和ND2序列分析了浙江浆蜂的线粒体基因型,其中,COⅠ-COⅡ序列分析结果支持浙江浆蜂来源于意大利蜂,但是ND2序列分析结果显示浙江浆蜂与意大利蜂存在一定差异。本研究进一步利用微卫星分子标记和线粒体DNA分析了不同年份浙江浆蜂(平湖)群体的遗传多样性变化,从而为有效保护浙江浆蜂提供理论依据。
1 材料与方法
1.1 样本采集
于2012、2015、2019 年分别在浙江省嘉兴市平湖市的30个蜂场每场随机选择1个蜂群,每蜂群随机取30只左右工蜂,放入无水乙醇中,置于-20 ℃冰箱中保存,备用。所有蜂场饲养的均为浙江浆蜂,且长期定地饲养或者小转地饲养。
1.2 实验方法
1.2.1 基因组DNA 提取
取无水乙醇浸泡保存的蜜蜂样本,每群随机取1只工蜂,剪取蜜蜂胸部肌肉,按照细胞/组织基因组DNA 提取试剂盒DP1201(北京百泰克生物技术有限公司)的说明和步骤提取蜜蜂总DNA。
1.2.2 微卫星位点选择及扩增分型
参考文献[8],选择最常用、多态性较好的5 个微卫星位点,其引物信息见表1。10 μL聚合酶链式反应(polymerase chain reaction, PCR)体系如下:10×缓冲液1 μL,25 mmol/L MgCl20.60~0.68 μL,10 mmol/L dNTP 1 μL,10 nmol/L 上下游引物各0.4 μL,DNA 模板1 μL,Taq酶0.1 μL,用纯水补齐。PCR 扩增程序:94 ℃预变性4 min;94 ℃变性0.5 min,55~58 ℃退火0.5 min,72 ℃延伸0.5 min,35个循环;72 ℃延伸10 min。含荧光标记的PCR产物由北京擎科新业生物技术有限公司进行测序检测。
1.2.3 线粒体DNA 序列扩增与测序
使 用 引 物E2(5´-GGCAGAATAAGTGCATT G-3´)和H2(5´-CAATATCATTGATGACC-3´)[9]对mtDNA 的COⅠ-COⅡ序列进行扩增。使用引物ILE(5´-TGATAAAAGAAATATTTTGA-3´)和L1(5´-GAATCTAATTAATAAAAAA-3´)[10]对mtDNAND2序列进行扩增。40 μL PCR扩增体系如下:10×缓 冲 液4 μL,25 mmol/L MgCl24 μL,10 mmol/L dNTP 4 μL,10 nmol/L上下游引物各1.6 μL,DNA模板3 μL,Taq酶0.5 μL,用纯水补齐。PCR 扩增程序为:94 ℃预变性5 min;94 ℃变性1 min,48 ℃或42 ℃退火1 min,72 ℃延伸1 min,35 个循环;72 ℃延伸10 min。PCR产物送至生工生物工程(上海)股份有限公司进行双向测序。

表1 微卫星位点的引物信息及反应条件Table 1 Primer information and reaction conditions for microsatellite loci
1.2.4 数据统计与分析
使用GeneMapper 4.0软件导出微卫星数据的图谱文件,根据图谱中的波峰位置判断目标片段的大小,并生成Excel 格式的数据。使用POPGENE 1.32软件[11]对观察等位基因数(Na)、有效等位基因数(Ne)、等位基因频率、观察杂合度(Ho)、期望杂合度(He)等进行计算和哈代-温伯格平衡(Hardy-Weinberg equilibrium,HWE)检验。利用Microsatellite-Toolkit软件计算多态信息含量(polymorphism information content,PIC)。运用SPSS 17.0 对3 个年份间的遗传多样性指标进行差异显著性分析,以P<0.05 表示差异有统计学意义。
使用DNAStar 5.0(美国DNAStar 公司)对线粒体DNA序列进行拼接。利用DnaSP 6.0软件[12]进行单倍型分析。获得的单倍型序列使用NCBI数据库(https://www.ncbi.nlm.nih.gov/)中的BLAST 确定单倍型类型,并统计各单倍型的分布频率。
2 结果与分析
2.1 微卫星位点分析结果
2.1.1 浙江浆蜂(平湖)全群的遗传多样性
浙江浆蜂(平湖)全群的不同微卫星位点的观察等位基因数、有效等位基因数、杂合度和多态信息含量如表2 所示。从中可以看出:在全群中共检测到53个等位基因,其平均观察等位基因数(Na)为10.6个,平均有效等位基因数(Ne)为3.859 1个,平均观察杂合度(Ho)和平均期望杂合度(He)分别为0.567 4、0.685 8,平均多态信息含量(PIC)为0.653 1。说明浙江浆蜂(平湖)的遗传多样性较丰富。
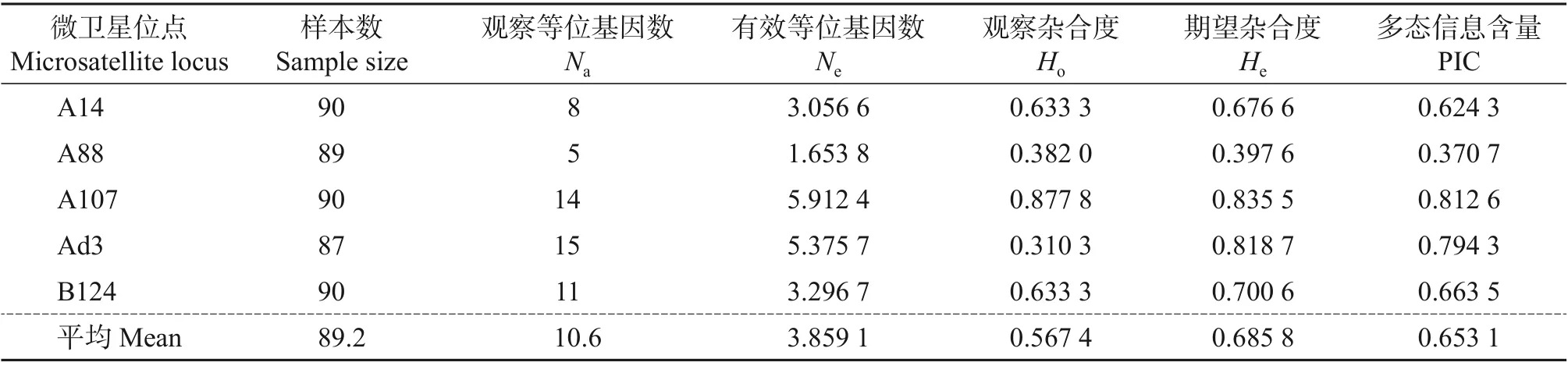
表2 基于微卫星位点浙江浆蜂(平湖)全群的遗传多样性检测结果Table 2 Genetic diversity testing results of Zhejiang Royal Jelly bee(Pinghu)based on microsatellite loci
在所检测的5个微卫星位点中,A14、A107、Ad3和B124的PIC>0.5,说明这些基因位点为高度多态的基因位点,A88为中度多态基因位点。
2.1.2 不同年份优势等位基因频率的比较
优势等位基因是群体中最稳定的基因,在某种程度上体现了群体的特征。不同年份各微卫星位点的优势等位基因频率比较结果见表3。从中可知:A107 和Ad3 的优势等位基因频率在30%左右,A14和B124的优势等位基因频率在50%左右,A88的优势等位基因频率在70%左右。F检验结果显示,P2012∶2015=0.621,P2015∶2019=0.557,P2012∶2019=0.925,即3个年份间在5个微卫星位点的优势等位基因频率差异不显著。
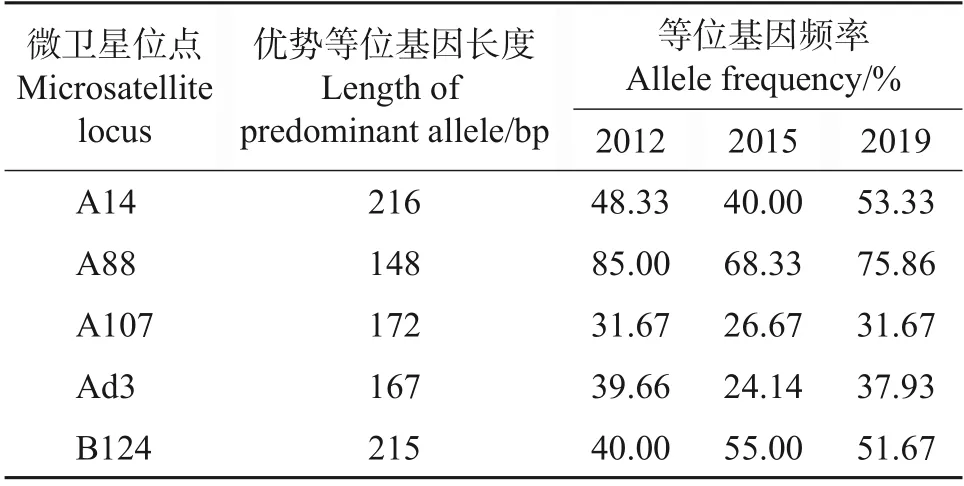
表3 不同年份浙江浆蜂(平湖)的优势等位基因长度及频率Table 3 Length and frequencies of predominant alleles for five microsatellite loci in Zhejiang Royal Jelly bee(Pinghu)among different years
2.1.3 不同年份的微卫星位点遗传多样性比较
浙江浆蜂(平湖)不同年份各微卫星位点的遗传多样性指标数值见表4。从中可知:不同年份不同微卫星位点的观察等位基因数(Na)在4~12 之间,2012、2015 和2019 年的平均观察等位基因数(Na)分别为8.2、8.2、9.0;不同年份不同微卫星位点的有效等位基因数(Ne)在1.366 7~6.844 1 之间,2012、2015和2019年的平均有效等位基因数(Ne)分别为3.505 4、4.152 7、3.617 8;不同年份不同微卫星位点的观察杂合度(Ho)在0.275 9~0.933 3 之间,2012、2015和2019年的平均观察杂合度(Ho)分别为0.535 2、0.615 4、0.551 5;不同年份不同微卫星位点的期望杂合度(He)在0.272 9~0.868 4之间,2012、2015和2019年的平均期望杂合度(He)为0.658 4、0.711 8、0.680 8;不同年份不同微卫星位点的多态信息含量(PIC)在0.255 1~0.839 0 之间,2012、2015 和2019年的平均多态信息含量(PIC)为0.616 5、0.665 4、0.642 6。经F检验,3 个年份间的所有遗传多样性指标差异均不显著(P>0.05)。
2.2 线粒体DNA 分析结果
线粒体COⅠ-COⅡ序列分析结果(表5)显示,浙江浆蜂(平湖)全群存在2 种单倍型C1a 和C2d。在2012、2015 和2019 年,C1a 的分布频率由80.0%上升到93.3%,而C2d 的分布频率则由20.0%降低为6.7%。
线粒体ND2序列分析结果(表5)显示,浙江浆蜂(平湖)全群存在4 种单倍型。在2012、2015 和2019 年,单倍型N1 的分布频率由56.7%升高到90.0%,而单倍型N2、N3、N4 的分布频率都逐渐降低,且单倍型N4 在2019 年的实验样本中没有被发现。
3 讨论与结论
微卫星标记评价遗传多样性受到微卫星位点和数目、基因型分型方法、取样等因素影响。选择的微卫星位点和数目不同,反映的遗传信息就不同,获得的等位基因数可能就会有差异。传统的微卫星基因型分型方法是采用聚丙烯酰胺凝胶电泳与银染相结合,设备简单,成本低,但是误差较大,所以目前一般都采用荧光PCR 结合测序仪来判断基因型,以提高实验的准确性。衡量微卫星位点多态性高低的重要指标是多态信息含量(PIC)。当PIC>0.5时,微卫星位点具有高度多态性;当0.25<PIC<0.5时,微卫星位点具有中度多态性;当PIC<0.25 时,微卫星位点为低度多态性[13]。本研究进行全群分析和不同年份分析时,A14、A107、Ad3 和B124的PIC在0.591 3~0.839 0之间,属于高度多态性的基因位点,A88的PIC在0.255 1~0.440 3之间,属于中度多态性基因位点,说明本研究所选的基因位点较合适,能够提供充分的遗传信息。经差异显著性检验,全群以及不同年份的有效等位基因数显著小于观察等位基因数(P<0.05),说明浙江浆蜂(平湖)群体的等位基因分布不均匀。基因位点Ad3在不同年份群体中都显著偏离哈代-温伯格平衡,而且观察杂合度显著小于对应的期望杂合度,出现杂合子缺失现象,推测可能与人工选择有关,也可能是由于引物结合区序列发生了突变,致使部分等位基因不能有效扩增。
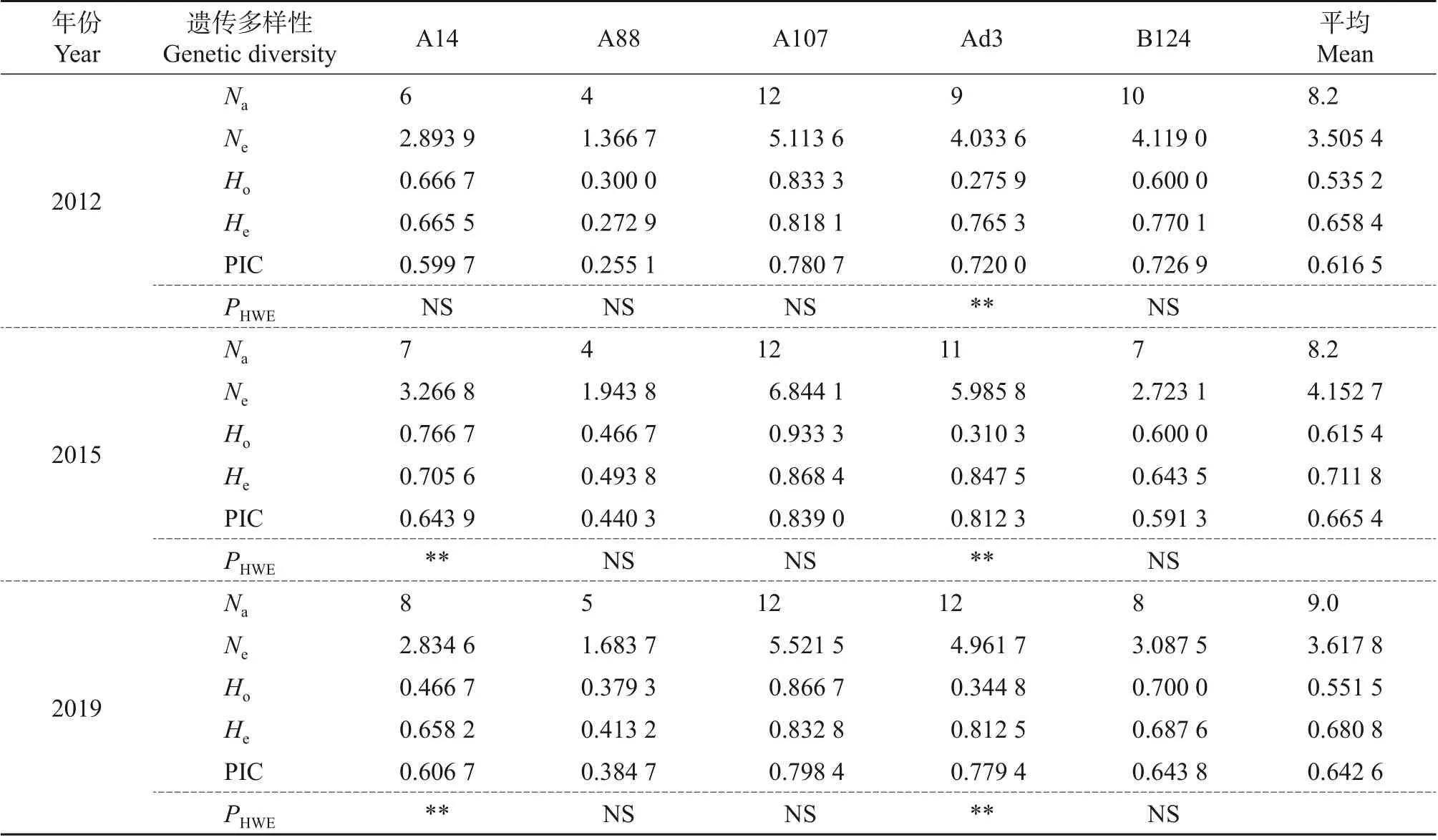
表4 不同年份基于微卫星位点浙江浆蜂(平湖)的遗传多样性检测结果Table 4 Genetic diversity testing results of Zhejiang Royal Jelly bee(Pinghu)among different years based on microsatellite loci

表5 不同年份浙江浆蜂(平湖)的线粒体单倍型分布频率Table 5 mtDNA haplotype distribution frequencies in Zhejiang Royal Jelly bee(Pinghu)among different years
基因杂合度也称为基因多样度,一般认为,它是度量群体遗传变异的一个最适参数。与观察杂合度相比,期望杂合度受样本取样的影响较小,常用它来度量群体的遗传多样性。当杂合度在0.5~0.8 之间则可认为群体具有较高的多样性[14]。本研究中,浙江浆蜂(平湖)全群的平均有效等位基因数为3.859 1个,平均观察杂合度和平均期望杂合度分别为0.567 4和0.685 8,不同年份群体的观察杂合度和期望杂合度也均在0.5~0.8 之间,而且除微卫星位点A88 以外,其余的PIC 均大于0.5,说明浙江浆蜂(平湖)具有较高的遗传多样性。吉挺等[15]利用6个微卫星标记分析了92 群江苏省当地意大利蜂的遗传多样性,得出其平均有效等位基因数为5.17,平均观察杂合度和平均期望杂合度分别为0.583 8 和0.500 7。彭文君等[16]利用16 个微卫星标记分析了245 群东北黑蜂的遗传多样性,得出其平均观察杂合度和平均期望杂合度分别为0.62 和0.65,平均多态信息含量为0.60。陈孝梅等[17]利用16 个微卫星标记分析了30群东北黑蜂保护区的样品,得出东北黑蜂的平均期望杂合度和PIC 分别为0.612 和0.571。浙江浆蜂(平湖)群体的平均期望杂合度(0.685 8)大于江苏省当地意大利蜂的平均期望杂合度(0.500 7),也大于东北黑蜂的平均期望杂合度(0.65 和0.612),说明与其他蜜蜂群体相比,浙江浆蜂(平湖)的遗传多样性较高。浙江浆蜂(平湖)饲养量较大,且分布在平原地区,没有地理隔离,有利于群体间的交流。浙江浆蜂(平湖)遗传多样性较丰富,有利于进行进一步选育。
F检验显示,3 个年份间在平均等位基因数、平均观察杂合度、平均期望杂合度、平均多态信息含量等指标上差异均不显著,说明近年来浙江浆蜂(平湖)的遗传多样性较稳定。这可能与浙江浆蜂(平湖)饲养量较大且饲养区域较封闭有关。吉挺等[5]利用6个微卫星标记分析了92群平湖浆蜂的遗传多样性,得出其平均观察杂合度和平均期望杂合度分别为0.494 0 和0.498 1。YIN 等[6]利用18 个微卫星标记分析了48群平湖浆蜂的遗传多样性,得出其平均观察杂合度和平均期望杂合度分别为0.507和0.522。上述相关研究所获得的杂合度小于本研究的结果,可能与样本采集的代表性或者使用的微卫星标记不同有关。
蜜蜂属于一雌多雄的交配方式,即在一个蜂群里所有的工蜂都是同一只蜂王的后代,但是工蜂的父亲则是与蜂王交配的多只雄蜂。西方蜜蜂蜂王一般与10 多只雄蜂完成交配[18]。在蜜蜂养殖过程中,蜂农一般只选择个别优良蜂群培育新的后代蜂王,以用来替换所有蜂群的老蜂王,即一个蜂场里的所有蜂王均来自少数几个母亲蜂王,但是,交配的雄蜂一般不加以控制,而是来自周边所有蜂场的蜂群。为避免可能的近交衰退,蜂农之间经常交换蜂王。浙江浆蜂(平湖)目前的饲养量较大,蜂场较多,且基本没有地理隔离,与蜂王交配的雄蜂来源较丰富,因此,作为双性遗传的微卫星标记的研究结果显示其拥有较高的遗传多样性。但是线粒体属于母性遗传,在蜂农培育新蜂王的过程中受到强烈的人工选择的影响,线粒体单倍型的变化对此较为敏感。本研究结果显示:浙江浆蜂(平湖)群体里只存在少数几种单倍型,而且主要单倍型的分布频率随着时间的推移逐渐升高,其他单倍型的分布频率则都逐渐降低,单倍型单一化越来越明显。近些年,交通日益便利,蜂农之间的交流也更加方便,蜂农之间交换蜂王也更加频繁,这可能造成主要单倍型蜂王的使用越来越普遍。
浙江浆蜂是在特殊的历史条件和特殊的自然地理环境下,经人工选育而获得的优良蜜蜂资源,具有重要的生产应用和研究价值。但是,随着原产地生态环境的改变,尤其是蜂农老龄化严重,养蜂后继乏人,原产地浙江浆蜂的蜂场数量及蜂群数量正在大量减少,这些都加剧了保护浙江浆蜂资源的紧迫性。浙江浆蜂虽然在我国养蜂生产中大量使用,但一般都是用作杂交亲本。国家级蜜蜂基因库虽然保存了浙江浆蜂,但是由于蜜蜂的群体性和特殊的交配方式,使得设立保护区成为保护蜜蜂资源的最佳方式。平湖作为浙江浆蜂的主要原产地和主要分布区,其自然地理条件和饲养方式非常适合浙江浆蜂资源的保护。目前的研究结果表明,浙江浆蜂(平湖)的遗传多样性较丰富,从而为浙江浆蜂的资源保护提供了有利条件。但线粒体单倍型的逐渐单一化也提出了警示,尤其是在未来,如果蜂场数量和蜂群数量继续大量减少,势必会影响浙江浆蜂(平湖)的遗传多样性水平。因此,建议加大对浙江浆蜂(平湖)的保护力度,一方面支持平湖地区的传统养蜂生产,维持足够的蜂场数量和蜂群数量,同时改善生态环境,尤其是蜜粉源条件;另一方面加强对浙江浆蜂(平湖)资源的监测,在平湖不同地理区域选择蜂场建立监测点,进行持续跟踪监测,以便及时采取更有效的保护措施。
综上所述,微卫星分析结果表明,浙江浆蜂(平湖)的遗传多样性较丰富,且近年来遗传多样性保持相对稳定;而线粒体DNA 分析结果显示,浙江浆蜂(平湖)的线粒体单倍型单一化越来越明显。因此,建议对浙江浆蜂(平湖)的遗传多样性变化进行持续监测,同时采取必要的保护措施。
