环状RNA hsa_circ_0091579对肝癌细胞增殖、迁移和侵袭的影响
2021-05-17于维凯冯婷婷陈晓兵骆继业冯万文王言理
于维凯,冯婷婷,陈晓兵,骆继业,冯万文,王言理
1 连云港市第一人民医院 急诊内科,江苏 连云港 222000;2 连云港市市立东方医院 骨科,江苏 连云港 222042
肝细胞癌(HCC)是一种常见的恶性肿瘤,位居全球第三大癌症相关死亡原因[1],具有侵袭性、预后差、治疗机会有限的临床特点。目前,手术是HCC最常见的治疗方式,但很多HCC发现时已是晚期,无法进行手术切除,导致患者预后很差[2]。因此,进一步了解HCC进展的分子机制,寻找有效的治疗靶点具有重要意义。
越来越多的证据[3-4]表明,环状RNA(circular RNA,circRNA)失调在多种肿瘤的发生和发展中发挥重要作用。circRNA是一类内源性非编码RNA,具有高度保守性;与线性RNA相比,它具有共价闭合环结构,因而比较稳定且不易被RNA外切酶降解[5-6]。circRNAs广泛存在于真核生物体内,具有基因调控潜能,从而参与了增殖、侵袭、迁移、自噬、凋亡和代谢等多种细胞生物学进程[7-9]。据报道[10-11],circRNAs在很多疾病中异常表达,参与了这些疾病的进展,并与预后密切相关。随着高通量测序和生物信息学的发展,许多circRNAs被发现在HCC中异常表达,可作为HCC的生物学标志物,并参与了HCC的发生与发展[12-14]。
Zhang等[15]研究发现,hsa_circ_0091579可能在HCC进展中起到关键作用,并可能作为HCC患者预后的潜在生物标志物。然而,在HCC中,并无hsa_circ_0091579相关功能及机制研究。因此,本研究在HCC细胞系中检测hsa_circ_0091579的表达,并探索其对HCC细胞增殖和迁移的影响。
1 材料与方法
1.1 细胞培养及转染 体外培养购买于ATCC公司的人HCC细胞系SMMC-7721、HuH-7、MHCC-97H、HepG2和人正常肝细胞系HL-7702。培养基为含10%胎牛血清(Gibco,USA)的DMEM高糖培养基(Gibco)。培养于37 ℃、5% CO2的环境中。采用Lipofectamine 3000试剂(Invitrogen,USA)将hsa_circ_0091579 siRNA及阴性对照(negative control,NC)转染入细胞内,使用实时荧光定量PCR(qRT-PCR)评估转染效率。
1.2 RNA提取及qRT-PCR 根据说明书,使用Trizol试剂(Invitrogen)从细胞中提取总RNA,并使用分光光度计测定RNA的纯度和浓度。取1 μg总RNA,采用PrimeScript-RT试剂盒(Takara Bio,Japan)将RNA逆转录成cDNA。以DNA为模板,使用SYBR Select Master Mix试剂盒(Applied Biosystems,USA)及ABI Prism 7900检测系统(Applied Biosystems)进行qRT-PCR反应。hsa_circ_0091579的表达以GAPDH为内参,采用2-△△Ct法计算相对表达量。
1.3 CCK8细胞增殖实验 细胞增殖能力采用CCK-8实验进行分析。细胞以5×103/孔的密度接种于96孔板,并转染siRNA,在37 ℃、5% CO2的环境中培养。转染24、48或72 h后,将10 μl CCK-8试剂(Transgen Biotech,USA)添加至每个孔中,并在37 ℃下孵育1 h。根据说明书在450 nm波长下测量吸光度。
1.4 细胞凋亡实验 细胞凋亡采用流式细胞术进行分析。将细胞接种于培养板中,培养24 h后进行转染。转染48 h后收集细胞,用PBS洗涤,并使用Annexin V-FITC/PI凋亡检测试剂盒(Solarbio)对细胞进行双重染色,用FlowJo软件分析细胞凋亡率。
1.5 细胞迁移实验 通过细胞划痕实验研究细胞迁移能力。将细胞接种于6孔板,培养24 h后进行转染。用10 μl无菌吸头尖划伤单层细胞制造划痕,用PBS洗涤细胞3次以冲掉划下的细胞。加入无血清的DMEM高糖培养基置于细胞培养箱中继续培养24 h。使用光学显微镜对0 h和24 h的划痕进行拍照记录,计算细胞迁移率。
1.6 细胞侵袭实验 使用Transwell小室(Thermo Fisher Scientific)研究细胞侵袭能力。转染后的细胞消化并用无血清的DMEM培养基重悬,添加到涂有基质胶的Transwell上室,下室加入含有10%血清的DMEM培养基。小室置于细胞培养箱中培养24 h后,轻轻去除膜上的细胞,膜下的细胞用甲醇固定,结晶紫染色并计数。
1.7 靶点预测及荧光素酶报告基因实验 使用Circular RNA Interactome (https://circinteractome.nia.nih.gov/index.html)数据库对hsa_circ_0091579的靶microRNA(miRNA)进行预测。利用pmirGLO载体(Promega)分别构建野生型(wt)和突变型(mut)荧光素酶报告基因质粒。将荧光素酶报告基因质粒和miRNA mimics共转染入HepG2细胞,用双荧光素酶报告基因系统(Promega)测定荧光素酶活性。

2 结果
2.1 hsa_circ_0091579在HCC细胞系中的表达 通过qRT-PCR检测了人HCC细胞系和人正常肝细胞系中hsa_circ_0091579的表达情况,并进行了对比。结果显示,人HCC细胞系SMMC-7721、HuH-7、MHCC-97H、HepG2中hsa_circ_0091579的表达水平明显高于人正常肝细胞系HL-7702,差异均有统计学意义(t值分别为14.27、36.34、26.70、36.16,P值均<0.001)(图1)。
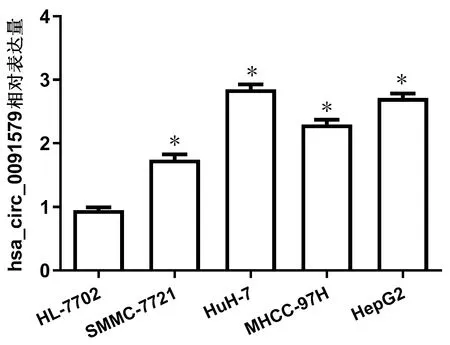
注:与HL-7702组比较,*P<0.05。
2.2 hsa_circ_0091579 siRNA设计及转染 针对hsa_circ_0091579的环化拼接位点设计siRNA,siRNA靶序列为ACCAGAGGCCTTTGAAATTGT(图2a),qRT-PCR结果显示,在HepG2和HuH-7细胞中转染hsa_circ_0091579 siRNA能够明显降低hsa_circ_0091579的表达水平(t值分别为14.22、27.20,P值分别为0.005、0.001)(图2b)。
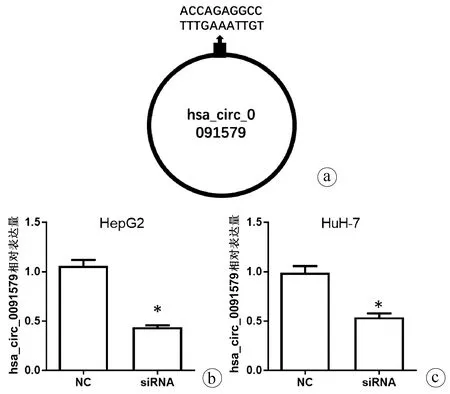
注:a,hsa_circ_0091579 siRNA 靶序列;b,qRT-PCR验证在HepG2和HuH-7细胞中转染降低hsa_circ_0091579。与NC组比较,*P<0.05。
2.3 沉默hsa_circ_0091579对HCC细胞增殖和凋亡的影响 在HepG2和HuH-7细胞中转染hsa_circ_0091579 siRNA,CCK8实验和流式细胞术结果显示,与NC组相比,沉默hsa_circ_0091579能够在48 h和72 h明显抑制HepG2和HuH-7细胞的增殖活性(P值均<0.05)(图3),并能够明显加速HepG2和HuH-7细胞的凋亡(t值分别为9.50、25.89,P值分别为0.011、0.002)(图4)。
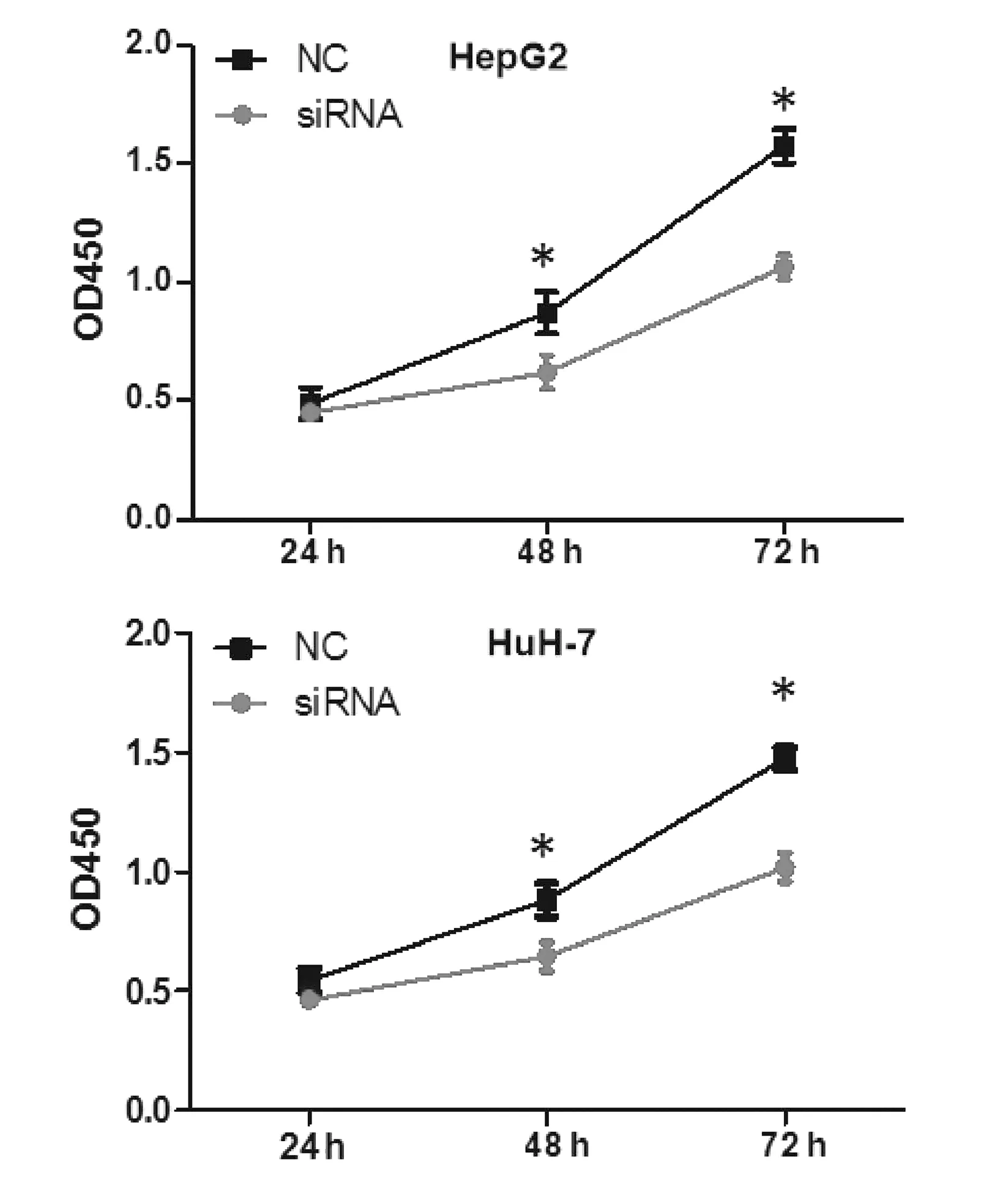
注:与NC组比较,*P<0.05。
2.4 沉默hsa_circ_0091579对HCC细胞迁移和侵袭的影响 划痕实验和Transwell实验结果显示,与NC组相比,沉默hsa_circ_0091579能够明显抑制HepG2和HuH-7细胞的迁移和侵袭能力(t值分别为19.63、13.61、20.75、18.45,P值分别为0.003、0.005、0.002、0.003)(图5、6)。
2.5 hsa_circ_0091579靶miRNAs预测及验证 通过Circular RNA Interactome数据库,发现miR-149、miR-490-5p和miR-502-5p可能是hsa_circ_0091579的靶miRNAs。荧光素酶报告基因实验结果显示,与NC组相比,miR-149、miR-490-5p和miR-502-5p均能明显降低野生型荧光素酶质粒的活性(t值分别为10.01、9.13、61.49,P值分别为0.010、0.012、<0.001)(图7)。
3 讨论
到目前为止,HCC进展的机制仍不清楚,然而,越来越多的证据[16-17]表明,HCC的发生可能是由HBV感染、癌基因激活、抑癌基因失活所引起。近年来,非编码RNA已成为肝癌研究的热点。一些研究[18-19]已表明肿瘤特异性非编码RNA可以应用于生存预测和治疗干预。部分异常调控的miRNAs和长链非编码RNA(long non-coding RNAs, lncRNAs)是HCC耐药性形成的重要调节因子,肿瘤特异性miRNAs和lncRNAs可作为HCC新的治疗靶点和预后标志物[20]。

注:a,HepG2;b,HuH-7。与NC组比较,*P<0.05。
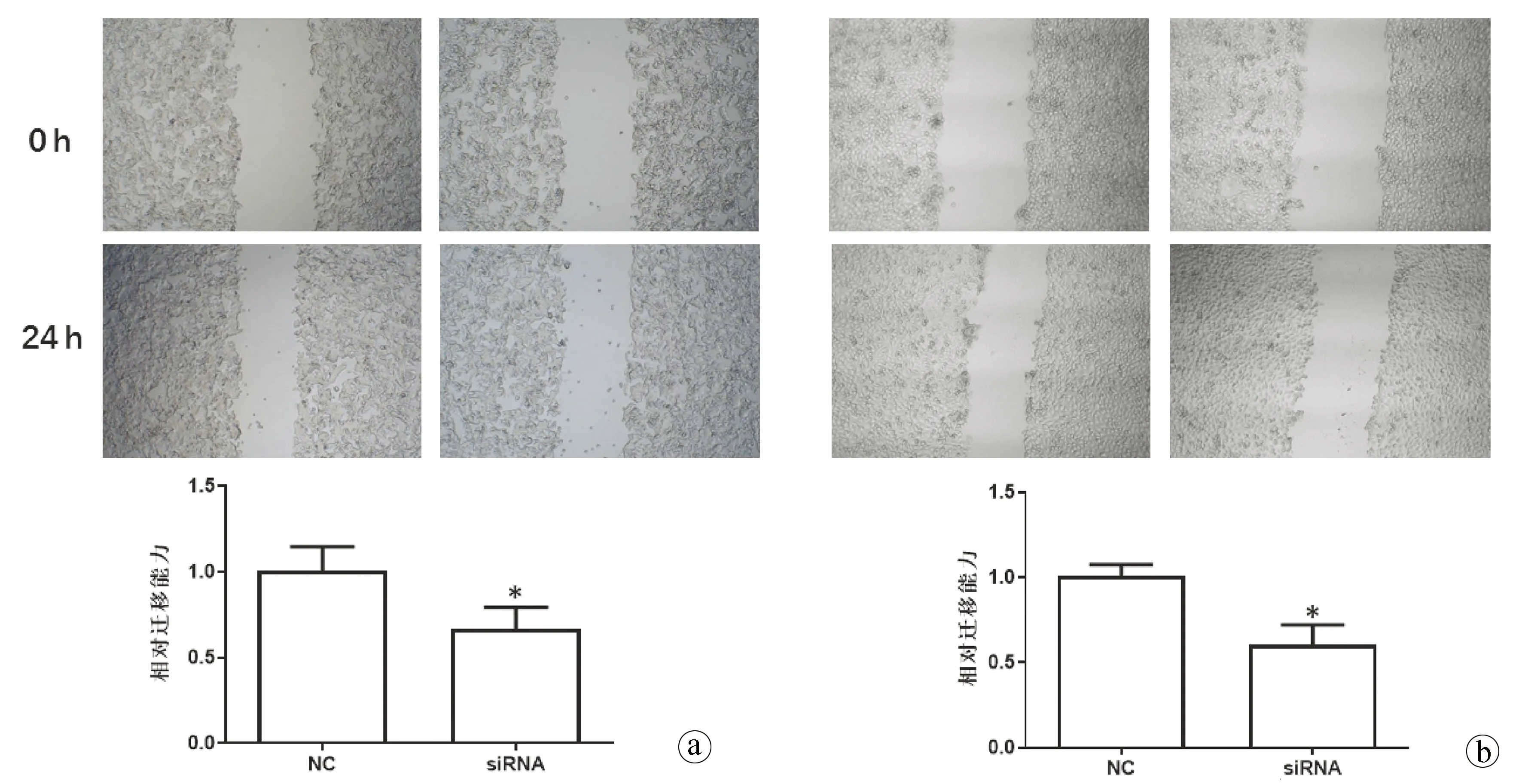
注:a,HepG2;b,HuH-7。与NC组比较,*P<0.05。
在与HCC相关的非编码RNA中,circRNA日益受到关注[21-22]。例如,异常表达circRNAs可用于区分HCC和健康人群,预测患者预后,并与肿瘤大小、分化程度、微血管浸润、转移、TNM分期及甲胎蛋白水平等临床因素密切相关,提示异常表达的circRNAs可作为一种新的HCC诊断和预后的无创生物标志物[23]。circABCB10在HCC组织和细胞系中的表达明显增加,并通过调节miR-670-3p/HMG20A轴促进HCC的进展,可能是HCC的潜在治疗靶点[24]。circ-0003418在HCC组织和细胞株表达下调,具有抗肝癌作用,通过抑制Wnt/β-catenin途径促进HCC细胞的增殖、迁移和侵袭,并提高HCC细胞对顺铂的敏感性[25]。

注:与NC组比较,*P<0.05。
本研究选取了hsa_circ_0091579作为研究对象。2018年,Zhang等[15]使用circRNA微阵列分析检测了3例HCC伴癌栓患者肿瘤组织和配对正常肝组织中circRNA的表达谱,发现hsa_circ_0091579在癌组织中高表达;随后他们用qRT-PCR在75对肿瘤组织和配对正常肝组织中进行了验证,并进一步发现hsa_circ_0091579的高表达与HCC患者总体生存率差密切相关;但他们并没有对hsa_circ_0091579在HCC细胞系中的表达和功能做进一步研究。在此基础上,笔者推测hsa_circ_0091579可能在HCC的发生和进展过程中发挥重要的作用,因而做了进一步探索。本研究结果显示,hsa_circ_0091579在HCC细胞系中同样高表达,这与其在人体组织中的高表达相符。进一步的功能实验表明,在体外通过siRNA沉默hsa_circ_0091579后,HCC细胞的增殖、迁移和侵袭活性明显降低,凋亡明显加快。因此,笔者认为hsa_circ_0091579可发挥癌基因的作用促进HCC进展,此结果也可解释Zhang等[15]研究所报道的hsa_circ_0091579高表达能够影响HCC患者生存率。
在多种癌症中,circRNAs发挥其功能的一个重要机制是靶向结合部分肿瘤相关miRNAs,并抑制这些miRNAs的功能[26]。本研究中,通过生物信息学预测发现miR-149、miR-490-5p和miR-502-5p可能是hsa_circ_0091579的靶miRNAs,并通过荧光素酶报告基因实验进行了验证。已有研究[27-29]证实miR-149、miR-490-5p和miR-502-5p在HCC中发挥抑癌基因的作用,抑制肿瘤进展。因此,笔者认为hsa_circ_0091579可能通过抑制上述具有抑癌作用的miRNAs发挥其癌基因的作用。
综上,本研究结果表明,hsa_circ_0091579在HCC细胞系中高表达;在体外HCC细胞系中沉默hsa_circ_0091579能够抑制HCC细胞的增殖、迁移和侵袭。hsa_circ_0091579可能通过抑制miR-149、miR-490-5p和miR-502-5p发挥癌基因的作用,其有希望成为有效的临床治疗靶点用于HCC的治疗。
利益冲突声明:本研究不存在研究者、伦理委员会成员、受试者监护人以及与公开研究成果有关的利益冲突。
作者贡献声明:于维凯、冯婷婷、冯万文负责课题设计,资料分析,撰写论文;陈晓兵、骆继业参与收集数据,修改论文;于维凯、王言理负责拟定写作思路,指导撰写文章并最后定稿。
