癌旁组织二酯酰甘油激酶γ表达水平对肝癌患者术后生存的影响
2021-05-17钱相君郭正阳聂涵笑王效谦万百顺姚明解
钱相君,郭正阳,王 莉,聂涵笑,贺 涛,王效谦,万百顺,姚明解,张 玲
1 郑州大学附属肿瘤医院 肝胆胰外科,郑州 450008; 2 北京大学医学部基础医学院 a.病原生物学系暨感染病中心,b.人体解剖学与组织胚胎学系,北京 100191;3 北京大学第三医院 基础医学研究中心,北京 100191
肝细胞癌(HCC,简称肝癌)居我国最常见恶性肿瘤的第四位及肿瘤致死病因的第二位,严重威胁着人民的生命健康[1-3],肝切除术是肝癌的主要治疗方式之一[4],虽然近年来肝癌的外科治疗技术不断发展,但患者的长期预后并不十分理想[5-7]。因此,临床上针对肝癌的多学科综合治疗受到越来越多的重视[5-6]。评估肝癌切除术后患者的预后并为其制订科学合理的综合治疗方案对于改善术后生存至关重要,而目前这一过程的实现仍面临着一些挑战。
二酯酰甘油激酶(DGK)是使二脂酰甘油(DAG)磷酸化产生磷脂酸(PA)的一类激酶;通过对DAG和PA作为第二信使所参与的体内诸多生理信号通路的调节,DGK在许多肿瘤的发生发展中发挥着重要作用[8-10]。DGKγ是DGK家族的Ⅰ型成员之一,目前关于DGKγ在肿瘤中的作用研究比较有限。除了Kai等[11]报道的DGKγ在结直肠癌中发挥抑癌作用外,作者的前期研究[12]发现DGKγ在肝癌的发生发展中扮演着肿瘤抑制因子的角色。此外,该研究还发现相比于肝癌组织中DGKγ的低表达,癌旁组织中DGKγ的表达水平较高;且相比于肝癌组织中DGKγ高表达组的32.87个月的中位生存期,癌/癌旁组织中DGKγ非低表达组的中位生存期则为50.43个月[12]。这些结果提示了癌旁组织中DGKγ的表达水平可能对肝癌患者的预后也存在影响,但目前尚无对此的直接研究报道。本文通过相关的比较和生存分析,首次探究了肝癌患者癌旁组织中DGKγ的表达水平与肝癌术后预后的直接关系,并评估了其作为预后指标的临床价值。
1 资料与方法
1.1 研究对象 选取2008年12月—2012年8月于郑州大学附属肿瘤医院被诊断为肝癌并行手术切除术的患者82例;经长期随访最终入组的患者为78例,随访率为95.1%。78例患者均为伴有肝硬化的肝癌患者,其中男67例,女11例,平均(54.32±10.74)岁。纳入的患者符合:肝肿瘤手术切除,术后病理证实为HCC;一般情况较好,肝功能Child分级为A级或B级;术前未进行放化疗。排除临床资料不完整、合并有血液及免疫系统疾病及失访的患者。长期随访采用医院就诊和电话相结合的方式,第1年每3个月随访1次,随后每6个月随访1次,最后随访日期为2018年7月1日。
1.2 临床资料的采集 收集研究对象的年龄、性别等临床基本信息;术前实验室检查:HBsAg、AFP、ALT、AST、ALP、GGT、TBil、Alb、球蛋白(Glb)、RBC、PLT、PT、国际标准化比值(INR)、纤维蛋白原(FIB);以及术中输血、肿瘤大小和数目、癌栓、切缘等资料。
1.3 癌旁组织中DGKγ的检测 取手术切除肿瘤后距离肿瘤边缘1~2 cm范围的肝组织50 mg作为癌旁组织样本,-80 ℃冻存保存,在研钵中加入适量的液氮充分研磨,之后收集至10 ml离心管中,加入1 ml TRIzol吹打混匀,室温静置5 min。然后提取RNA,经逆转录后,以C末端结合蛋白1为内参基因,通过实时荧光定量PCR(SYBR Green I Master Mix, Roche)检测癌旁组织中DGKγ mRNA的表达水平。
1.4 伦理学审查 本研究方案经由北京大学生物医学伦理委员会审批,批号:IRB00001052-12088,患者均知情同意。

2 结果
2.1 癌旁组织DGKγ 低表达组与高表达组的临床资料比较 78例HCC患者癌旁DGKγ表达水平分别为0.079 5(0.007 0~1.697 5)。通过受试者工作特征曲线(ROC曲线)分析78例HCC患者的癌旁DGKγ检测值对患者长期生存状态的预测能力,曲线下面积(AUC)为0.733(P=0.001),确定癌旁DGKγ的最佳截断界值为0.086 2(图1)。以0.086 2为界,将78例患者分为低表达组(DGKγ<0.086 2,简称LEP组,n=41)和高表达组(DGKγ≥0.086 2,简称HEP组,n=37)。

图1 癌旁DGKγ预测患者生存状态的ROC曲线
78例患者的临床资料如表1所示,18例HBsAg阴性的患者中抗-HBc和抗-HCV阳性的患者分别为4例和3例。比较肝癌患者癌旁组织DGKγ LEP组与HEP组的临床资料,结果显示:LEP组中的PT低于HEP组,差异具有统计学意义(P<0.05);而2组间的年龄、性别、HBsAg(阳性/阴性)、术中输血、BCLC分期、肿瘤大小和数目及其他的实验室指标的差异均无统计学意义(P值均>0.05)(表1)。
2.2 肝癌生存预后的单因素及多因素Cox回归分析 单因素Cox分析结果显示HBsAg、AFP、Alb、PLT、术中输血、BCLC分期、肿瘤大小、肿瘤数目、切缘及癌旁组织DGKγ对肝癌患者术后OS的影响差异具有统计学意义(P值均<0.05)(表2)。共线性诊断分析未发现单因素Cox分析有意义的指标存在共线性;将这些指标纳入多因素Cox回归模型,结果显示癌旁DGKγ(HR=1.913,95%CI: 1.111~3.296,P=0.019)、HBsAg(HR=2.645,95%CI:1.264~5.537,P=0.010)、Alb(HR=0.952,95%CI:0.916~0.990,P=0.013)、BCLC分期(HR=1.702,95%CI:1.267~2.286,P<0.001)、肿瘤大小(HR=1.083,95%CI:1.019~1.152,P=0.011)是肝癌患者术后OS的独立影响因素;其中癌旁组织DGKγ的高表达是危险因素,HEP组的死亡风险是LEP组的1.913倍。
2.3 癌旁组织DGKγ LEP组与HEP组的生存曲线比较 基于以上结果,进一步分析比较LEP组与HEP组的生存情况。在78例总患者中,LEP组和HEP组OS近期差异(Breslow检验)与远期差异(log-rank检验)均具有统计学意义(P值均<0.05,图2a),中位生存时间分别为45.0和22.9个月;LEP组与HEP组1、3、5年生存率分别为82.9%、56.1%、43.9%和64.9%、24.3%、13.5%。图2b显示出BCLC A期患者的OS要显著优于BCLC B期和C期的患者,中位生存时间分别为43.9、22.9和11.5个月。随后,分别分析比较了在BCLC A期、BCLC B和C期中LEP组与HEP组的生存差异。结果显示,对于BCLC A期的患者,LEP组和HEP组OS的远期差异具有统计学意义(P<0.05,图2c),中位生存时间分别为81.9和34.2个月;B期和C期患者中,LEP组和HEP组OS近期与远期差异均无统计学意义(P值均>0.05,图2d),但前者中位生存时间要高于后者,分别为16.5和10.8个月。
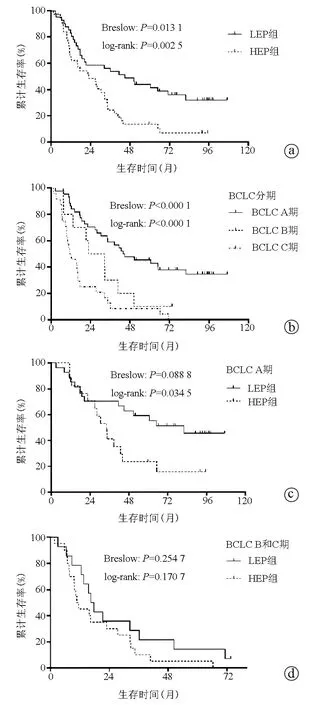
注:a、c、d分别为所有患者、BCLC A期、BCLC B和C期中的LEP组与HEP组生存曲线;b为BCLC各期患者的生存曲线。
3 讨论
近年来,全世界及中国的肝癌发病和死亡人数仍然呈现上升趋势[5,7]。尽管随着临床围手术期管理和诊疗技术的不断进步,对合并有肝硬化的肝癌患者的外科手术干预的短期风险大大降低,但整个肝癌患者人群的长期预后仍不理想[1,5]。对术后患者进行长期生存风险的评估和预测,并为其制订科学合理的随访复查与及时干预方案以达到改善肝癌患者术后长期生存的目的,是临床医生和研究人员长期努力的方向。既往作者实验室及其他实验室的研究结果表明HBsAg[13]、Alb[14-15]、肿瘤大小[16]和BCLC分期[15,17]是肝癌患者长期生存的独立影响因素。而本研究中的结果也显示这些指标对肝癌患者术后的长期生存有着一定的预测作用,同时这些风险因素也反映出肝癌患者的长期生存风险是受到了病毒性肝炎、肝功能及肿瘤本身的综合影响作用。
DAG是脂质代谢过程中的中间产物,作为一种中性脂质也是细胞膜的重要构成成分;DAG经DGK磷酸化后可产生PA[18]。在体内许多的生物学进程中,DAG和PA作为关键的第二信使执行着特殊的功能任务,而DGK磷酸化DAG也是信使DAG的主要代谢方式[18]。不同亚型的DGK可以通过终止DAG信号和激活PA介导的通路来调控多种细胞内过程。近年来,关于DGK在肿瘤的增殖、侵袭和转移等生物学进程中的作用受到越来越多的重视。研究较多的是DGKα,目前已知其在乳腺癌[19]、子宫内膜癌[20]、神经胶质母细胞瘤[21]和血液系统肿瘤[22]等恶性肿瘤中主要扮演着促癌基因的功能。这可能与肿瘤微环境能够促进DGKα的表达有关;一方面,DGKα介导生成的PA能够促进肿瘤的生存、迁移和耐药性的产生;另一方面,DGKα所介导的DAG磷酸化代谢能够减弱T淋巴细胞的应答反应并可使T淋巴细胞进入无应答状态[10]。而在胃癌和结直肠癌中,DGKα的表达则是下调的,可能主要发挥了抑癌基因的功能[23-24]。对于肝癌,Takeishi等[25]研究发现表达上调的DGKα依赖于其激酶活性,可通过激活丝裂原活化蛋白激酶(MAPK)通路促进肝癌细胞的增殖和肿瘤进展。
不同于DGKα,作者的前期研究发现DGKγ可通过其激酶活性下调肝癌细胞葡萄糖转运体1的水平而发挥抑癌作用;而相比于肝癌组织中低表达DGKγ的患者,高表达组有着更长的中位生存时间(21.17个月vs 32.87个月,P=0.009 2)[12]。然而,本研究的结果发现癌旁组织中的DGKγ表达水平也是肝癌患者术后长期生存的独立影响因素,癌旁组织中DGKγ的水平越低,患者的术后总体生存越好;在BCLC不同分期的亚组分析中也得到了相似的结果。不同于DGKγ在癌组织中发挥抑癌因子的作用,癌旁组织中DGKγ的表达水平对肝癌患者术后生存影响的具体机制可能与DGKγ参与DAG和PA代谢进而长期影响肝脏的代谢功能有关。一方面,癌旁组织DGKγ LEP组中肝功能Child-Pugh B级患者占7.3%,要低于HEP组的16.2%;另一方面前者的PT要显著地低于后者;这些差异提示了癌旁组织中DGKγ可能通过调节肝脏的合成代谢功能来影响肝癌患者的预后。
综上所述,对于肝癌患者,癌旁组织中DGKγ的表达水平是术后长期生存的独立影响因素,可能是一种新的肝癌预后指标;其能够在一定程度上帮助临床医师对术后患者的长期生存风险进行预测和评估,从而更好地帮助临床决策。此外,本研究尚存在着样本量少的局限性,扩大研究的样本量及探索相关的具体作用机制是下一步的研究方向。
利益冲突声明:本研究不存在研究者、伦理委员会成员、受试者监护人以及与公开研究成果有关的利益冲突。
作者贡献声明:钱相君、郭正阳负责课题设计,收集数据,资料分析和撰写论文;王莉、聂涵笑参与收集数据;贺涛、王效谦、万百顺参与修改论文;姚明解、张玲负责拟定写作思路,指导撰写文章并最后定稿。
